血清YKL-40、MCP-1水平与乳腺癌患者转移和预后的关系
2015-03-07丁克保施开德朱际彪
唐 琴,丁克保,施开德,朱际彪,鲁 斌,吕 刚
(安徽医科大学附属巢湖医院甲乳外科,安徽 巢湖 238000)
血清YKL-40、MCP-1水平与乳腺癌患者转移和预后的关系
唐琴,丁克保,施开德,朱际彪,鲁斌,吕刚
(安徽医科大学附属巢湖医院甲乳外科,安徽 巢湖238000)
摘要:目的探讨人软骨糖蛋白39(YKL-40)和单核细胞趋化蛋白1(MCP-1)水平与乳腺癌转移和预后的相关性。方法采用酶联免疫吸附法分别检测64例乳腺癌和47例健康人群血清YKL-40和MCP-1水平,分析两项指标与乳腺癌临床病理的相关性以及与生存期和预后关系。结果乳腺癌组患者YKL-40和MCP-1平均水平分别为(286.3±96.7 )ng·L-1和(171.2±105.4)μg·L-1,明显高于健康人群(164.1±70.9)ng·L-1和(118.5±77.6)μg·L-1(P<0.01);YKL-40升高与淋巴结转移有关(P<0.05),而MCP-1升高与有无淋巴结转移和TNM分期有关(P<0.05)。Kaplan-Meier分析显示YKL-40和MCP-1升高组3年生存率分别为46.75%和53.12%,而YKL-40和MCP-1正常组3年生存率分别为76.56%和81.25%(P<0.05)。Cox风险回归分析显示YKL-40和MCP-1均是判断乳腺癌预后的独立危险因素,而YKL-40升高对预后不良的相对危险度更高(RR=2.87 vs 2.25)。结论血清YKL-40和MCP-1升高的乳腺癌患者淋巴结转移风险高。测定血清YKL-40和MCP-1水平,有助于判断乳癌患者预后。
关键词:人软骨糖蛋白39(YKL-40);单核细胞趋化蛋白1(MCP-1);乳腺癌;转移;预后
乳腺癌是我国最常见的影响女性健康的恶性肿瘤性疾病之一,虽然近年来手术方式的不断改进以及放化疗手段的更新,但5年生存率仍难以达到50%以上,其中有无远处转移是影响预后的重要因素。目前仍缺乏预测乳腺癌转移和预后的有效肿瘤标记物,故筛选有效标记物、准确判断预后有重要临床价值。人软骨糖蛋白39(YKL-40)是一种壳质酶家族的分泌型糖蛋白,已经证实在宫颈癌、大肠癌、肺癌等多种实体瘤中高表达,主要参与细胞外基质重建以及血管生产,是细胞生长和肿瘤侵袭转移的标记物[1-3]。单核细胞趋化蛋白1(MCP-1)属于CC类趋化因子家族,研究证实,MCP-1可通过分泌血管内皮生长因子、MMP等多种途径作用于肿瘤细胞,促进肿瘤生长和浸润[4-5]。当前针对血清YKL-40和MCP-1水平在乳腺癌患者发生转移及预后中的应用,国内外报道罕见,2008年3月—2011年5月我们对乳腺癌患者血清YKL-40和MCP-1浓度联合检测,拟探讨两者与乳腺癌患者发生转移、预后的相关性。
1资料和方法
1.1一般资料选取2008年3月—2011年5月安徽医科大学附属巢湖医院收治乳腺癌患者64例,均为女性,年龄38~79岁,平均年龄(63.4±11.7)岁。所有患者均经手术和病理明确诊断为乳腺癌,且采集血清标本前无放化疗等辅助治疗史。病理学类型:浸润性导管癌42例,浸润性小叶癌9例,混合性浸润癌5例,髓样癌3例,鳞状细胞癌1例,其他类型4例。有淋巴结转移者28例,无淋巴结转移者36例。其中53例接受手术治疗,术后规律放化疗1~10周期,平均4.6个周期;另11例因不具备手术条件或其他手术禁忌予姑息性治疗。选取同期来我院体检健康人群47例作为对照,均为女性,年龄35~75岁,平均(61.7±9.5)岁。排除标准:(1)随访资料不完全者;(2)既往有其他器官恶性肿瘤性疾病史者;(3)合并骨关节炎;(4)合并肾功能不全;(5)合并其他报道的可能引起YKL-40和MCP-1异常的疾病如病毒性肝炎、血液系统疾病等。
1.2方法
1.2.1标本采集所有患者入院后次晨抽取静脉血10 mL,分装于两试验干管内,3 000 r·min-1高速离心10 min,分别取上清液1.5 mL分装两管,置于-20 ℃冰箱内保存,每3个月集中检测一次。上述步骤均于标本收集后30 min内完成。健康对照人群血清样本亦按照上述步骤采集。
1.2.2实验检测YKL-40和MCP-1均采用酶联免疫吸附实验(ELISA)法测定,兔抗人YKL-40多克隆抗体试剂盒购自上海蓝基生物有限公司,山羊抗人MCP-1单克隆抗体购自北京中山生物有限公司,所有操作严格按试剂说明书进行。根据标本吸光度绘制标准曲线并转化为YKL-40和MCP-1浓度。YKL-40和MCP-1升高临界值(Cut-off)由ROC曲线确定,即对应youden指数(灵敏度+特异度-1最大值)时的浓度。
1.3随访随访资料通过查阅住院病例、电话随访、门诊随访的方式获得。随访时间3~36个月,从手术或首次放化疗日作为起始,至2014年5月1日终止,随访率100%。总生存期(OS)为患者手术或首次放化疗日至死亡日的期限;对于随访截止日仍存活的患者,以手术或首次放化疗日至末次随访日之间的期限为准。

2结果
2.1血清YKL-40和MCP-1水平及ROC分析乳腺癌组患者YKL-40和MCP-1平均水平分别为(286.3±96.7)ng·L-1和(171.2±105.4)μg·L-1,明显高于健康人群(164.1±70.9)ng·L-1和(118.5±77.6)μg·L-1,差异显著,具有统计学意义(P<0.01)。其中,有淋巴结转移的乳腺癌28例YKL-40和MCP-1水平分别为(303.6±108.2 )ng·L-1和(194.0±118.6 )μg·L-1,高于无淋巴结转移组(272.8±83.1)ng·L-1和(153.5±97.7)μg·L-1(P<0.05)。
ROC曲线分析结果显示,对应曲线中youden指数的YKL-40和MCP-1取值(升高的临界值)分别为259.4 ng·L-1和146.7 μg·L-1。(图1)
2.2YKL-40和MCP-1和临床病理的相关性将YKL-40>259.4 ng·L-1,MCP-1>146.7 μg·L-1患者定义为升高组,反之则为正常组。YKL-40升高与淋巴结转移(P<0.05),与年龄、肿瘤大小、TNM分期、分化程度、病理类型无关(P>0.05);而MCP-1升高与有无淋巴结转移和TNM分期有关(P<0.05),与年龄、病理类型、肿瘤大小、分化程度无关(P>0.05)。见表1。
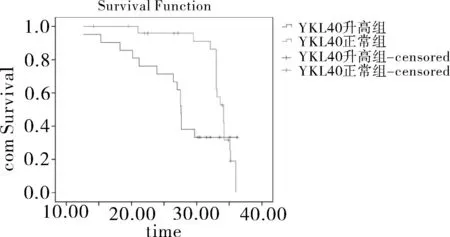
2.3生存分析-YKL-40、MCP-1和生存期YKL-40升高组中位生存期为33个月(95%CI:30.1~35.7月),明显短于YKL-40正常组的27个月(95%CI:22.0~30.4月);YKL-40升高组3年总生存率(Overall survival,OS)46.75%,而正常组OS为76.56%,差异具有统计学意义(P<0.05)。同时,MCP-1正常组和升高组的中位生存期分别为31个月(95%CI:29.5~33.8月)和24个月(95%CI:21.2~24.9月);对应的3年OS分别为81.25%和53.12%(P<0.05)。见图2。
2.4乳腺癌的预后因素分析以年龄、肿瘤大小、分化程度、病理类型、有无淋巴结转移、TNM分期、YKL-40水平(>259.4 ng·L-1)、MCP水平(>146.7 μg·L-1)因素行COX风险回归分析,结果显示分化程度、有无淋巴结转移、TNM分期、YKL-40水平、MCP水平均是影响预后的独立危险因素(P均<0.05)。但YKL-40升高对预后不良的相对危险度RR=2.87(95%CI:2.13~3.47),高于MCP-1的RR值2.25(95%CI:1.77~2.62)。见表2。
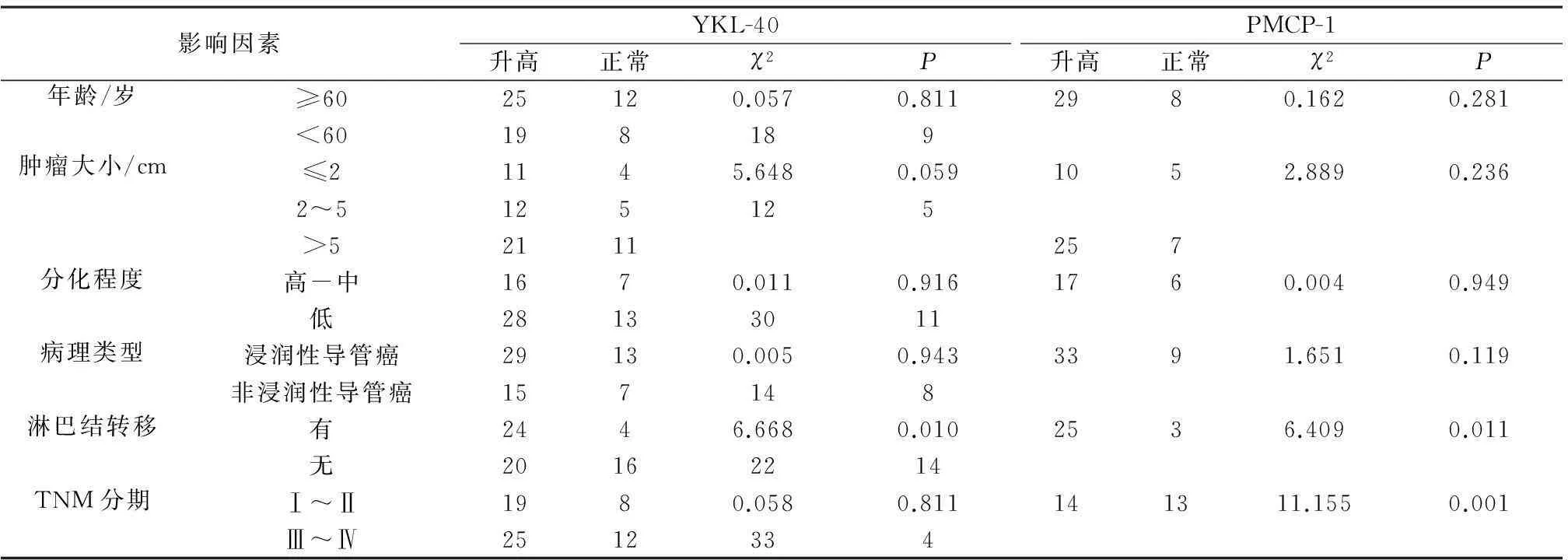
表1 YKL-40和MCP-1和临床病理特点的相关性/例
3讨论
YKL-40是哺乳动物18糖蛋白家族中的成员之一,最早发现在人骨肉瘤细胞株MG63中大量分泌,故又称为人软骨糖蛋白-39。其编码基因位于染色体1q31-q32区域,是具有一段10个外显子,长约8 kb,共7 948个碱基配对的DNA片段[6]。目前已知,YKL-40可通过促进血管平滑肌细胞迁徙,增加与瘤旁间质的黏附活性,从而帮助肿瘤血管生成和浸润转移,同时可参与肿瘤外基质重建,是构成肿瘤形成、生长微环境的重要因子[7-8]。现有的研究还发现,YKL-40可通过激活蛋白激酶、三磷酸激酶信号通道的途径,使调控分裂的蛋白激酶磷酸化,产生瀑布样放大的增殖信号,进而发挥调控细胞增殖作用[9]。研究表明,YKL-40在肺癌、大肠癌、宫颈癌、胰腺癌等多种恶性肿瘤患者血清中高表达,且可能与腺上皮细胞肿瘤来源有关[10-11]。Kim等[12]研究发现,恶性胸腔积液中YKL-40水平明显高于结核性、漏出性胸腔积液,并指出YKL-40是鉴别良恶性胸水的肿瘤标记物。另外,Tarpgaard等[13]指出,YKL-40升高是大肠癌预后不良的独立危险因素,且化疗前YKL-40高表达人群在应用一线化疗药物时敏感性较差[10],故化疗前检测YKL-40水平对于预判化疗疗效,进而改变治疗策略亦有一定指导意义。
本研究通过对YKL-40升高组和正常组乳腺癌患者随访后发现,术前血清YKL-40>259.4 ng·L-1患者生存时间、总体生存率均低于YKL-40正常组,进一步证实了YKL-40升高是乳腺癌不良预后的危险因素。同时,YKL-40升高与有无淋巴结转移有关,与YKL-40参与基质重塑、血管生成、肿瘤侵袭的特点一致。
MCP-1属于CC类趋化因子家族,是反应机体炎症反应和肿瘤免疫的指标之一,在正常组织中可由内皮细胞和成纤维细胞少量分泌,而在肿瘤细胞中大量分泌,故在健康人群中可检测到低水平MCP-1表达,而肿瘤患者血清中明显升高[14-15]。虽然当前对于MCP-1的具体生物学功能尚未完全明确,但国内外研究显示MCP-1是阻止肿瘤细胞凋亡的因子之一,其主要通过PI3K/AKT通路以及上调Survivin表达的途径,破外正常细胞凋亡程序,促进肿瘤生长。同时,MCP-1还能促进VEGF、MMP分泌和释放,参与毛细血管生成和基质溶解,进而有助于瘤体边缘扩散和远处转移[16-18]。有研究指出[19],MCP-1在大肠癌癌旁组织中几乎不表达,而在肿瘤组织中呈高表达,大肠癌患者血清中MCP-1明显升高。Yoshidome[20]的研究还证明,大肠癌患者中,MCP-1高表达与肝脏转移有关,初诊患者血清MCP-1水平直接关系到患者预后良差。
本研究发现,乳腺癌患者MCP-1平均水平(171.2±105.4)μg·L-1,明显高于健康人群(118.5±77.6 )μg·L-1。Ⅲ~Ⅳ期以及有淋巴结转移的乳腺癌患者中MCP-1升高的人数明显高于Ⅰ~Ⅱ期以及无淋巴结转移者,考虑可能与机体肿瘤细胞负荷以及MCP-1在促进肿瘤转移中的作用有关。进一步对比MCP-1>146.7 μg·L-1和MCP-1≤146.7 μg·L-1两组患者生存时间后发现,MCP-1≤146.7 μg·L-1预后明显优于升高组,生存时间、OS均有显著差异,MCP-1是乳腺癌患者预后的独立危险因素之一。
本研究同时检测乳腺癌患者YKL-40和MCP-1水平,发现术前或放化疗前YKL-40、MCP-1升高均提示转移风险增加,生存时间缩短以及总体生存率降低,导致预后不良,表明YKL-40、MCP-1在判断乳腺癌患者预后中有一定临床价值。但在对比两者应用优势后发现,YKL-40升高对预后不良的相对危险度更高(RR=2.87vs2.25),故YKL-40作为乳腺癌预后的指标时较MCP-1更为准确,正如翟博等[21]报道YKL-40是乳腺癌预后的强标志物。临床上,单独检测YKL-40水平可以一定程度上判断乳腺癌患者预后情况,YKL-40和MCP-1联合检测更能显著提高预测乳腺癌患者的转移或预后情况的准确性。
参考文献:
[1]Francescone R,Ngernyuang N,Yan W,et al. Tumor-derived mural-like cells coordinate with endothelial cells: role of YKL-40 in mural cell-mediated angiogenesis[J].Oncogene,2014,33(16):2110-2122.
[2]Allin KH,Bojesen SE,Johansen JS,et al.Cancer risk by combined levels of YKL-40 and C-reactive protein in the general population[J].Br J Cancer,2012,106(1):199-205.
[3]周芳,胡秀峰,杨柳.YKL- 40与肿瘤相关巨噬细胞在非小细胞肺癌中的表达及预后分析[J].中国当代医药,2011,18(12):11-13.
[4]Horacek JM,Kupsa T,Vasatova M,et al.Evaluation of serum levels of multiple cytokines and adhesion molecules in patients with newly diagnosed acute lymphoblastic leukemia using biochip array technology[J].Exp Oncol,2013,35(3):229-230.
[5]贺恒鹏,于雯婷.胰腺癌患者血清MCP-1的检测及其临床意义[J].现代肿瘤医学,2013,21(2):375-377.
[6]Rehli M,Krause SW,Andreesen R,et al.Molecular characterization of the gene for human cartilage gp-39 CHI3L1 a member of the chitinase protein family and marker for late stages of macrophage differentiation[J].Genomics,1997,43(2):221-225.
[7]杨帅,王伟民,张小鹏,等.血清YKL40水平与胶质瘤病理分级及预后的相关性研究[J].中国微侵袭神经外科杂志,2014,19(10):437-439.
[8]尚倩,赵淑萍.YKL-40和VEGF在上皮性卵巢癌组织中的表达及其临床意义[J].泰山医学院学报,2014,35(3):171-173.
[9]Nishikawa KC,Miuis AJ.Gp38k(cHDLl)is a novel adhesion and migration factor for vascular cells[J].Exp Cell Res,2003,287(1):79-87.
[10] Ma JY,Li RH,Huang K,et al.Increased expression and possible role of chitinase 3-like-1 in a colitis-associated carcinoma model[J].World J Gastroenterol,2014,20(42):15736-15744.
[11] Ngernyuang N,Francescone RA,Jearanaikoon P,et al.Chitinase 3 like 1 is associated with tumor angiogenesis in cervical cancer[J]. Int J Biochem Cell Biol,2014,51:45-52.
[12] Kim HR,Jun CD,Lee KS,et al.Levels of YKL-40 in pleural effusions and blood from patients with pulmonary or pleural disease[J].Cytokine,2012,58(3):336-343.
[13] Tarpgaard LS,Guren TK,Glimelius B,et al.Plasma YKL-40 in patients with metastatic colorectal cancer treated with first line oxaliplatin-based regimen with or without cetuximab: result from the nordic VII Study[J].PLoS One,2014,9(2):e87746.
[14] Kiguchi N,Saika F,Kobayashi Y,et al.Epigenetic regulation of CC-chemokine ligand 2 in nonresolving inflammation[J].Biomol Concepts,2014,5(4):265-273.
[15] 沈国定,姜润秋,孙倍成.炎症相关因子IL-1β,TGF-β及MCP-1在肝细胞肝癌的表达[J].江苏医药,2011,37(7):797-799.
[16] 张文文,叶翎.急性白血病患者血清MCP-1、sIL-2R的检测及临床意义[J].济宁医学院学报,2012,35(1): 31-33.
[17] 宋军民,李杨,李琳.人胃癌组织中MCP-1和CD34的表达及临床意义[J].胃肠病学和肝病学杂志,2013,22(4):344-347.
[18] Bonapace L,Coissieux MM,Wyckoff J,et al.Cessation of CCL2 inhibition accelerates breast cancer metastasis by promoting angiogenesis[J].Nature,2014,515(7525):130-133.
[19] 胡书生,孙立新,孙力超,等.血清MCP-1在结直肠癌肝脏转移诊断及预后判断中的作用[J].中国肿瘤,2013,22(4):312-316.
[20] Yoshidome H,Kohno H,Shida T,et al.Significance of monocyte chemoattractant protein1 in angiogenesis and survival in colorectal liver metastases[J].Int J Oncol,2009,34(4):923-930.
[21] 翟博,胡凤丽,姜争,等.血清肿瘤标志物YKL-40与乳腺癌预后关系的研究[J].中国现代普外科进展,2012,15(4):266-269.
Relationship of the level of YKL-40 and MCP-1 with the metastasis and prognosis of breast cancer.
TANG Qin,DING Ke-bao,SHI Kai-de,et al
(GeneralSurgeryDepartment,TheChaohuaffiliatedHospitalofAnhuiMedicaluniversity,Chaohu,Anhui238000,China)
Abstract:ObjectiveTo investigate the relationship between the serum cartilage glycoprotein 39 (YKL-40) and monocyte chemotactic protein-1 (MCP-1) with metastasis and prognosis in breast cancer patients.MethodsThe enzyme-linked immunosorbent method was carried out to detect the levels of serum YKL-40 and MCP-1 in 64 cases of breast cancer patients and 47 healthy people as control group.Analysis the relationship between indicators and clinical pathologic,survival and prognosis of breast cancer patients.ResultsThe average value of YKL-40 and MCP-1 in Breast cancer patients were respectively (286.3±96.7) ng·L-1and (171.2±105.4)μg·L-1,significantly higher than that of healthy people(164.1±70.9)ng·L-1and (118.5±77.6)μg·L-1(P <0.01).The evaluated of YKL-40 was relate to lymph node metastasis (P<0.05),while the promotional of MCP-1 was associated with presence of lymph node metastasis and TNM stages (P<0.05).Kaplan-Meier analysis showed the 3 year survival rate in YKL-40 and MCP-1evaluated group were 46.75% and 53.12% respectively,has significant difference with the normal YKL-40 and MCP-1 groups(76.56% and 81.25%,respectively )(P<0.05).Cox regression analysis showed YKL-40 and MCP-1 were independent risk factors of prognosis of breast cancer,but the relative risk of YKL-40 was even higher than MCP-1(RR = 2.87 vs 2.25).ConclusionThe breast cancer patients with elevated serum YKL-40 and MCP-1 have high risk of lymph node metastasis.It is helpful to judge the prognosis of patients with breast cancer by detect the serum levels of YKL-40 and MCP-1.
Key words:YKL-40;MCP-1;breast cancer;metastasis ;prognosis
(收稿日期:2014-12-11,修回日期:2015-04-05)
doi:10.3969/j.issn.1009-6469.2015.09.023
通信作者:施开德,男,主任医师,研究方向:甲乳外科,E-mail:wujqing2014@163.com
