光合作用模型在山地森林附生树平藓光合特性研究中的适用性1)
2015-03-06陈曦刘文耀宋亮武传胜李苏卢华正
陈曦 刘文耀 宋亮 武传胜 李苏 卢华正
(中国科学院西双版纳热带植物园,昆明,650223)
责任编辑:程 红。
植物与光的关系一直是植物生理生态学研究的热点问题之一,光响应曲线描述的就是光量子通量密度(PPFD)与净光合速率(Pn)之间的关系。通过分析光响应曲线可以得出反映植物光合特性的相关生理参数[1],如最大净光合速率(Pnmax)、表观量子效率(AQE)、暗呼吸速率(Rd)、光饱和点(Isat)及光补偿点(Ic)等,而光合响应模型则是光合作用对环境因子响应模拟的核心。
林下附生苔藓是热带和温带森林生态系统的重要结构性组分之一,它们在维系生态系统生物多样性、生物量、水分和养分循环、指示环境质量状况等方面具有重要作用[2]。苔藓为变水植物,不具备维管组织,也没有控制水分蒸腾的气孔,其绝大多数种类的叶片仅由单层细胞构成,植株个体含水量极易受周围大气湿度和降水的影响,因此其生理功能对外界环境因子的变化十分敏感[3],而它们生理生化参数的变化,在一定程度上也对气候变化具有指示作用[4]。林下生境的显著特征是低光照,苔藓植物在光强超过饱和点时便产生光抑制[5],强光甚至会导致光合速率下调。以往对林下附生苔藓植物光合特征的研究很少,特别是有关光合模型在苔藓植物上的适用性研究鲜有报道。目前关于附生苔藓植物光合速率及其与光照、CO2摩尔分数、温度、水分等因子之间的关系也了解不多[6]。
位于云南西南部海拔2 200~2 600 m的哀牢山徐家坝地区,分布有大面积连片的原生常绿阔叶林,是目前我国亚热带地区保存面积最大的原生山地湿性常绿阔叶林,森林结构保存较为完整,林内附生植物尤其是附生苔藓特别发达,已被记录的苔藓物种共有38科69属141种[7],其中树平藓(Homaliodendron flabellatum)是该区森林附生苔藓植物的主要优势种之一。本研究选择树平藓作为研究对象,以非直角双曲线模型、指数方程和直角双曲线修正模型为基本模型,推导出包含光强、CO2摩尔分数和温度3个生态因子的光合作用综合模型。利用试验观测数据确定模型参数,并对模型的预测效果进行检验。旨在利用模型开展山地森林附生苔藓的生长模拟,为探索未来气候变化条件下山地森林生态系统的附生苔藓植物的响应机制提供理论依据。
1 研究区概况
试验在中国科学院哀牢山亚热带森林生态系统研究站进行,哀牢山生态站位于哀牢山国家自然保护区的核心区,根据生态站的气象站观测结果:该区年平均降水量1 947 mm,85%以上集中在雨季(5—10月份),年蒸发量1 485.9 mm,空气相对湿度86%;年平均气温11.3℃,最低月平均气温4.7℃,最高月平均气温16.4℃,全年无霜期180 d,终年温凉潮湿。中山湿性常绿阔叶林是该地区的主要植被类群,主要由木果柯(Lithocarpus xylocarpus)、变色锥(Castanopsis wattii)、硬壳柯(Lithocarpus hancei)、滇木荷(Schima noronhae)、翅柄紫茎(Hartia sinensis)、红花木莲(Manglietia insignis)等组成,林相完整,林冠郁闭。
2 材料与方法
2.1 光合测定
以哀牢山徐家坝地区的优势附生苔藓—树平藓为研究对象。鉴于苔藓植物特殊的形态特征,光合速率测定时利用便携式光合测定系统(LI-6400,Li-Cor Inc.,Lincoln,NE,USA),由整株拟南芥叶室(6400-17)配合RGB光源(6400-18)完成。测量时为了保持样品的最佳含水量(约220%),在叶室底部放一张湿润滤纸[8];苔藓的光合速率较低,测定时流速设定为300μmol·mol-1。剪取长3.0~5.5 cm的新鲜叶状枝,先由平板扫描仪V700(Seiko Epson Corp.,Nagano,Japan)扫描,叶面积由根系分析系统WinRHIZO Pro 2009b(Regent Instruments,Quebec,Canada)得到。因为光与CO2的吸收、蒸腾作用在本质上都是以面积为基础的生理现象,所以光合速率以面积来表示(μmol·m-2·s-1)比用质量表示更合理[9]。苔藓植物光合表面缺乏气孔,二氧化碳扩散是被动地受表面可变水层控制的[10],因此试验中模型拟合时使用的是空气中的二氧化碳摩尔分数(Ca)而不是胞间二氧化碳摩尔分数(Ci)。光合测定中光强、CO2摩尔分数、温度分别由RGB光源(6400-18)、CO2注入系统(6400-01)和人工气候室控制,共设5次重复,每次重复包括31组3因子不同处理组合下的净光合速率数据。
2.2 光合模型的建立
2.2.1 基本模型
光合模型的选择和参数的确定是建立模型的主要环节,现有的光合模型主要有双曲线和指数曲线两大类,而且不同模型间所提取的参数存在差异[11],其中应用最广泛的非直角双曲线模型[12]与渐进指数方程的表达式分别为[13]:
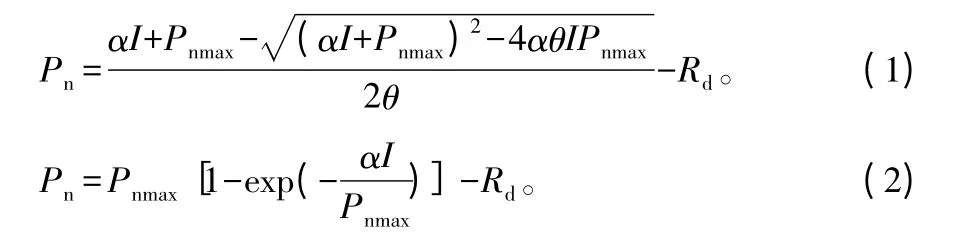
式中:Pn为叶片净光合速率;Pnmax为最大净光合速率;I为光量子通量密度;Rd为暗呼吸速率(以上单位相同,μmol·m-2·s-1);α为光响应曲线的初始量子效率;θ为曲线的曲角,它是反映曲线的弯曲程度的一个参数,曲率越大,曲线的弯曲程度越小。
研究表明,利用上述模型拟合光响应数据时,所给出的最大净光合速率值常远大于实测值[14],而所给出的光饱和点远小于实测值[15];而且这2个模型不能很好地处理光抑制和低光强条件下的光响应问题[16]1-24。因为它们是一条渐近线,不存在极点,所以也无法由这两个模型直接给出植物的光饱和点和最大净光合速率的解析解。为此,Ye Zipiao[17]近年来建立了一个直角双曲线修正模型:
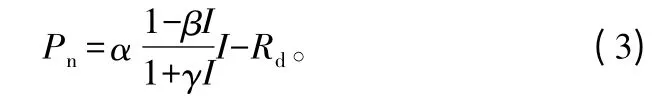
式中:β、γ为参数(m2·s·μmol-1)代表光抑制项和光饱和项,其它参数定义同式(1)。
2.2.2 光合作用综合模型的建立
除光强外,CO2摩尔分数也是影响光合速率的主要因子之一。CO2摩尔分数变化对光合作用的影响可根据下面的函数来校正[18]:

式中:FC为CO2摩尔分数对最大光合速率的影响因子,取值在0~1;Ca为大气CO2摩尔分数(μmol·mol-1);C0=390μmol·mol-1,为目前大气CO2平均水平;μ是模型参数。
另外,温度对光合速率的影响可用下面的函数表示[19]:

式中:FT为温度对光合速率的影响系数;T为温度;Tmax为光合最适温度;B=10,为模型常数。
暗呼吸速率Rd受温度的影响,一般采用指数形式描述[20]:

式中:Rd0为温度在25℃时的叶片暗呼吸速率,作为模型参数通过非线性拟合确定,T为温度。
结合式(1)~(6),包含CO2摩尔分数和温度因子的叶片光合作用综合模型可分别表示为:
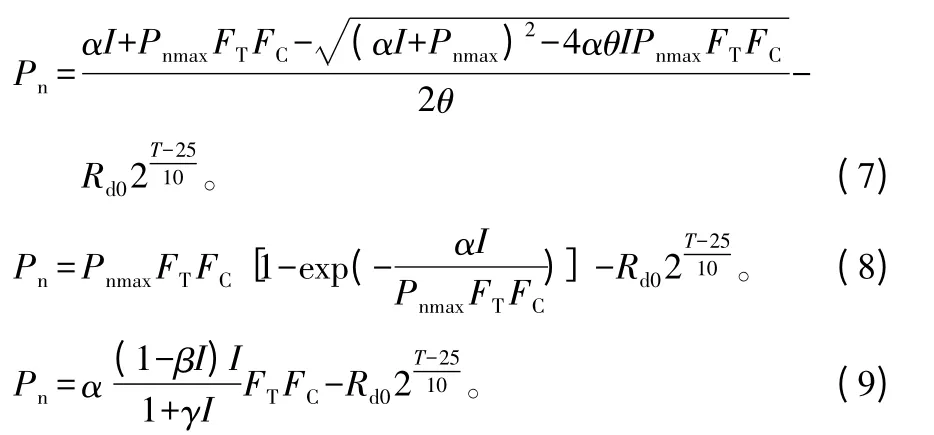
2.3 数据整理与分析
试验观测数据分成两部分:第1部分包括2次重复的62组数据用于模型参数的确定;第2部分包括3次重复的93组数据用于模型预测效果的检验。将第1部分实测数据的光强、CO2摩尔分数、温度及净光合速率等数据分别代入(7)~(9)式,通过非线性拟合得到3个模型的参数。利用这些参数对第2部分未参与参数拟合的数据进行回代检验,得到对应的预测值,并与实测值相比较。通过比较预测值与实测值的线性回归斜率与实测值的1∶1线的变化程度,并结合决定系数(R2)及均方根误差(RMSE)来评价模型的预测效果。在线性回归中引入虚拟变量模型y=(1+k'D)x,其中当D=0代表实测值的1∶1回归线,D=1代表预测值与实测值的回归线,k'为二者的斜率差[21]。采用Sigmaplot 11.0(Systat Software Inc.,California,USA)进行参数拟合及作图。
3 结果与分析
3.1 参数拟合结果
由第1部分数据拟合得到的3个光合作用模型参数均在其生物学意义所允许的范围内(表1),但由非直角双曲线模型得到的初始量子效率α明显偏小(多在0.03~0.07)。总体来看,光强、CO2摩尔分数、温度能够很好地解释净光合速率的变化,解释程度均在96%以上。

表1 光合作用综合模型的参数拟合结果
3.2 模型预测的效果
根据表1中的参数对3个综合模型的回代检验结果见图1。表明由直角双曲线修正模型得到的预测值略大于实测值(图1a);而由非直角双曲线模型和指数方程得到的预测值小于实测值(图1b-c)。直角双曲线修正模型的决定系数R2最大而均方根误差RMSE最小;虚拟变量回归结果同时表明,非直角双曲线模型和指数方程显著改变了预测值与实测值的回归斜率,其预测值与实测值相比差异极显著(P<0.01),偏差(k')分别达到了7.8%和7.1%;而由直角双曲线修正模型得到的预测值与实测值之间差异不显著(P>0.05),其预测值与实测值相比偏差仅为2.7%。

图1 光合作用综合模型的预测效果
4 讨论
4.1 低光照下光响应模型的选择
非直角双曲线和指数方程是目前光响应曲线拟合时应用最为广泛的两个模型,但上述模型均是一条渐近线,不存在极点,所以无法由这些模型直接给出植物的Pnmax和Isat的解析解。对于非直角双曲线模型而言,要想由光响应曲线求取Isat就必须结合其它方法[22],即先假定光量子通量密度在0~200 μmol·m-2·s-1范围内的P(I)响应曲线为一直线,它与X轴的交点就是Ic,该直线与Y=Pnmax直线相交,交点所对应的X轴的数值即为Isat,但用该方法得到光饱和点结果不可靠,会使计算值明显偏小[23];而指数方程则需假设光合速率为0.9 Pnmax[24]所对应的光强为饱和光强,所以,用接近Pnmax一定比例的方法估计Isat也存在较大偏差。而直角双曲线修正模型则可以直接计算植物的Pnmax和Isat,这是该模型与其他两个模型的主要区别。以树平藓的光响应曲线为例,按上述方法得到的3个基本模型的参数如表2。
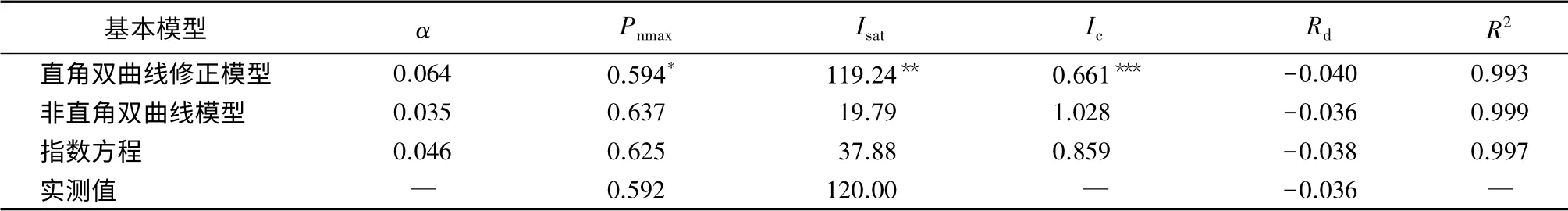
表2 光合基本模型的光响应曲线的参数拟合结果
虽然3个基本模型的R2均大于0.99,但R2越大只能说明模型拟合程度越高,并不能保证拟合结果一定与实测值相符[25]。由非直角双曲线和指数方程得到的Pnmax大于实测值,尤其是Isat远小于实测值(表2),已有研究还表明,这2个模型均不能解决低光强下的光抑制问题[16]1-24;而直角双曲线修正模型中加入了参数β、γ,分别为光抑制项与光饱和项,这两个参数可以有效地调节响应曲线的弯曲程度,故而该模型可以对不同生境下的响应曲线实现高精度的拟合,且拟合得到的光合参数与实测值最符合。因此,对适应于林下弱光生境,且存在光抑制现象的附生苔藓进行光响应曲线拟合时,直角双曲线修正模型是更好的选择。
4.2 参数μ的生态学意义
环境因子相互作用共同决定附生苔藓的光合表现[26]。作为CO2摩尔分数对光合速率响应的一个重要参数,本研究中μ的取值范围为1.19~1.34,大于在小麦等上的研究结果[27],这可能与苔藓植物的解剖结构有关。由于其叶片仅由单层细胞构成,CO2到达叶肉细胞发生生化反应所经历的扩散路径更短,所以其光合速率对CO2响应比对光强的响应更敏感(图2)。
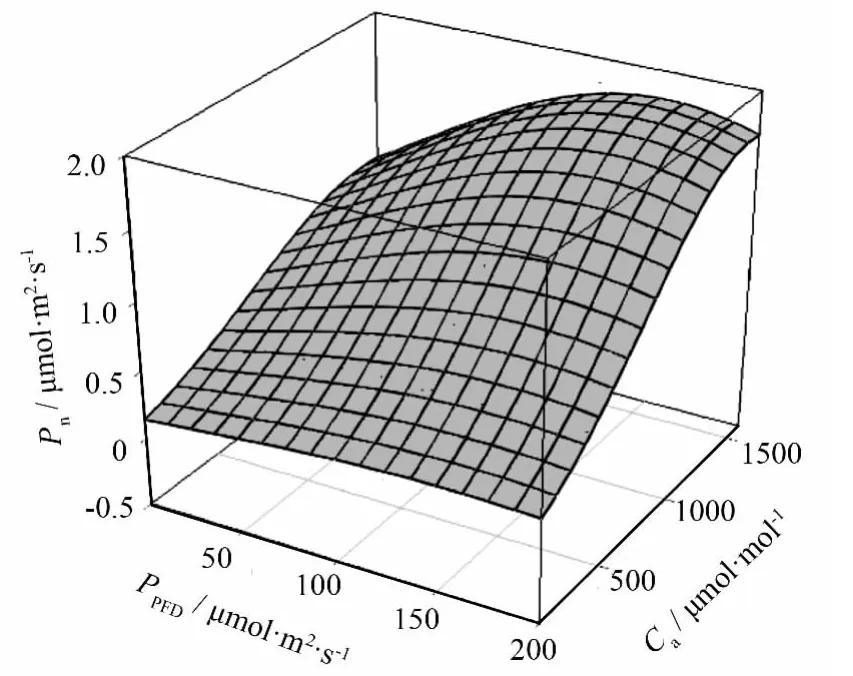
图2 树平藓对光和CO2的光合响应敏感性
这一结果也与以前的研究相佐证,如Michel等[28]研究发现:相比维管植物,苔藓植物功能性状的可塑性对其水分利用策略起着至关重要的作用,在一定程度上,苔藓植物能够通过调节自己的生理进程以适应外界环境梯度的变化[29]。因此,推测该植物类群能够适应未来大气CO2摩尔分数升高这一气候变化并从中获益。
综上,对生存于林下低光照生境的树平藓进行光合响应拟合时,无论是包含多因子的光合作用综合模型,还是单因子光响应模型,拟合效果均显示直角双曲线修正模型优于非直角双曲线模型和指数方程。而CO2摩尔分数响应参数μ与已有研究结果的不同恰恰反映了非维管束植物结构的特殊性,暗示林下附生苔藓可以作为全球气候变化的生物指示器。当然,这只是基于本地一种优势附生苔藓研究得出的结果,直角双曲线修正模型的普适性还有待在其他附生植物(地衣、蕨类)上进一步验证。
致谢:感谢井冈山大学叶子飘教授在建模方面的指导及中科院哀牢山亚热带森林生态系统研究站罗鑫在实验中的协助!
[1]钱莲文,张新时,杨智杰,等.几种光合作用光响应典型模型的比较研究[J].武汉植物学研究,2009,27(2):197-203.
[2]Clark K L,Nadkarni N M,Gholz H L.Retention of inorganic nitrogen by epiphytic bryophytes in a tropical montane forest[J].Biotropica,2005,37(3):328-336.
[3]Heijmans M M,Arp WJ,ChapinⅢF S.Controls on moss evaporation in a boreal black spruce forest[J].Global Biogeochemical Cycles,2004,18(2):1524-1530.
[4]Gignac L D.Bryophytes as indicators of climate change[J].Bryologist,2001,104(3):410-420.
[5]Chow W S.Photoprotection and photoinhibitory damage[J].Advances in Molecular and Cell Biology,1994,10:151-196.
[6]Green T G A,Sancho L G,Pintado A.Ecophysiology of desiccation/rehydration cycles in mosses and lichens[M]//Lüttge U,Beck E,Bartels D.Plant desiccation tolerance.Berlin:Springer-Verlag,2011:89-120.
[7]马文章,刘文耀,宋亮.哀牢山中山湿性常绿阔叶林不同生长基质苔藓植物的组成与分布特征[J].植物分类与资源学报,2011,33(4):443-450.
[8]Romero C,Putz F E,Kitajima K.Ecophysiology in relation to exposure of pendant epiphytic bryophytes in the canopy of a tropical montane oak forest[J].Biotropica,2006,38(1):35-41.
[9]Williams T G,Flanagan L B.Measuring and modelling environmental influenceson photosynthetic gasexchange in Sphagnum and Pleurozium[J].Plant,Cell and Environment,1998,21(6):555-564.
[10]Zotz G,Büdel B,Meyer A,et al.Water relations and CO2exchange of tropical bryophytes in a lower montane rain forest in Panama[J].Botanica Acta,1997,110(1):9-17.
[11]de A Lobo F,de Barros M P,Dalmagro H J,et al.Fitting net photosynthetic light-response curves with Microsoft Excel:a critical look at the models[J].Photosynthetica,2013,51(3):445-456.
[12]Thornley J H M.Mathematical models in plant physiology[M].London:Academic Press,1976:86-110.
[13]Bassman J H,Zwier JC.Gas exchange characteristics of Populus trichocarpa,Populus deltoides and Populus trichocarpa×P.deltoides clones[J].Tree Physiology,1991,8(2):145-159.
[14]Kyei-Boahen S,Lada R,Astatkie T,et al.Photosynthetic response of carrots to varying irradiances[J].Photosynthetica,2003,41(2):301-305.
[15]高峻,孟平,吴斌,等.杏—丹参林药复合系统中丹参光合和蒸腾特性的研究[J].北京林业大学学报,2006,28(2):64-67.
[16]Osmond C B.What is photoinhibition?Some insights from comparisons of shade and sun plants[M]//Baker N R,Bowyer J R.Photoinhibition of photosynthesis from molecular mechanisms to the field.Oxford:Bios Scientific Publishers,1994.
[17]Ye Zipiao.A new model for relationship between irradiance and the rate of photosynthesis in Oryza sativa[J].Photosynthetica,2007,45(4):637-640.
[18]Bouman B A M,Kropff M J,Tuong T P,et al.ORYZA2000:modeling lowland rice[M].Manila:IRRI,2001:36-37.
[19]韩湘玲,曲曼丽.作物生态学[M].北京:气象出版社,1991:39-53.
[20]李明星,刘建栋,王馥棠,等.包含CO2因子的冬小麦叶片光合作用农业气象简化模型研究[J].中国农业气象,2007,28(1):54-56.
[21]王宏,李晓兵,李霞,等.中国北方草原对气候干旱的响应[J].生态学报,2008,28(1):172-182.
[22]Richardson A D,Berlyn G P.Changes in foliar spectral reflectance and chlorophyll fluorescence of four temperate species following branch cutting[J].Tree Physiology,2002,22(7):499-506.
[23]张中峰,黄玉清,莫凌,等.岩溶植物光合-光响应曲线的两种拟合模型比较[J].武汉植物学研究,2009,27(3):340-344.
[24]黄红英,窦新永,孙蓓育,等.两种不同生态型麻疯树夏季光合特性的比较[J].生态学报,2009,29(6):2861-2867.
[25]闫小红,胡文海,王宁,等.美洲商陆光合光响应曲线及其模型拟合[J].井冈山大学学报:自然科学版,2013,34(3):28-33.
[26]Proctor M C F.The physiological basis of bryophyte production[J].Botanical Journal of the Linnean Society,1990,104(1/3):61-77.
[27]刘璐,刘建栋,吕厚荃,等.华北平原冬小麦品种演化过程中叶片光合作用模型关键参数的变化分析[J].中国农业气象,2011,32(1):111-114.
[28]Michel P,Lee W G,During H J,et al.Species traits and their non-additive interactions control the water economy of bryophyte cushions[J].Journal of Ecology,2012,100(1):222-231.
[29]Vitt D H.Growth and production dynamics of boreal mosses over climatic,chemical and topographic gradients[J].Botanical Journal of the Linnean Society,1990,104(1/3):35-59.
