文冠果人工林根际土壤真菌和根系内生真菌群落多样性1)
2015-03-06朱琳黄建陈天阳周永斌
朱琳 黄建 陈天阳 周永斌
(沈阳农业大学,沈阳,110866) (西北农林科技大学) (沈阳农业大学)
责任编辑:程 红。
生物质能源开发是国家重要的战略任务。近年来生物质能源木本树种的栽培与育种工作逐步得到重视。文冠果(Xanthoceras sorbifolia Bunge)属无患子科文冠果属,落叶灌木或小乔木,文冠果种仁含油量高达55%~66%,是我国特有的珍稀木本油料树种,具有生物质能源开发潜力。文冠果广泛分布于我国北方各省[1-2],经营模式以纯林为主。近年来发现,辽西地区干旱的气候条件及纯林带来的土壤肥力退化等诸多问题制约了文冠果林的可持续发展。
土壤微生物在生态系统中有着重要作用,土壤微生物推动土壤有机质与土壤养分的转化和循环,间接影响植物的分布和变化进而影响到经济林地的产量效益[3-5]。其中,与植物根系共生的菌根真菌就与植物的生长有着密切的联系,在根际土壤中菌根真菌不但可以影响细菌群落分布、分解有机质、改良土壤结构、提高土壤肥力,而且可以有效控制植物病虫害、分解土壤中的有毒物质[6-9]。相关研究表明,在不同生境中菌根真菌对不同的植物有着特异的选择偏好性,甚至在同一生境也差异显著[10]。许多菌根真菌及根内真菌与特定范围内的宿主植物形成共生体系,进而导致森林群落动态的变化[11]。探究随林木的生长发育,植物和菌根形成的共生体系与真菌种群结构之间的变化关系,以及对其他生物群落遗传多样性的影响等。对了解相关林地真菌群落结构的组成及其群落多样性具有重要的生态学意义。
随着核酸测序的快速发展,尤其是下一代测序技术的出现,拓展了人们对环境微生物的认识,使其成为对难培养微生物或不可培养微生物群落研究的技术策略,能够让人们直接从环境中获取总DNA,并对其进行测序分析[12],从整体水平上尽可能揭示根际真菌的群落结构及多样性。本研究以辽宁省阜新市不同林龄文冠果人工林为研究对象,以Illumina MiSeq为测序平台,分析不同发育阶段的文冠果根际土壤/根系真菌群落结构,从群落角度研究文冠果根系内生真菌与根际土壤真菌群落结构的变化,全面了解真菌群落结构多样性与土壤养分变化之间的关系,为文冠果人工林可持续经营管理提供理论依据。
1 研究区概况
文冠果人工林样地位于辽宁省阜新市(东经121°01'~122°55',北纬41°41'~42°56'),属北温带大陆性季风气候区。年平均降水490 mm,主要集中在7—8月份,地面蒸发量达2 100 mm,属半干旱地区。年平均气温6.8℃,相对湿度50%~70%,年日照时数2850~2950 h,无霜期154 d;土壤类型以风沙土为主,部分为褐土,土层厚度为35~50 cm。
2 材料与方法
2.1 样地选择
选择立地条件、抚育管理基本一致的3个林龄阶段的文冠果人工林作为样地。样地基本概况见表1。

表1 辽宁省阜新市文冠果人工林样地基本概况
2.2 土样采集
2014年8—9月采集。按照蛇形采样法,在文冠果根际周围0~30 cm深土壤中采集样品30个,每个土样约200 mL;同时,采集带有完整毛细根系的根样各30个。采集的土壤样品过筛(>4 mm)去除杂物和石块[13],放于塑封袋内封口并编号置于-80℃保存。同时,将带回的土样取一半室内自然风干,研磨过100目筛后用于土壤理化分析。
2.3 土壤理化性质测定
土壤含水量采用烘干法测定[14]。土壤全效氮采用开氏消煮法测定[15]。碱解氮采用碱解扩散法测定[16]。全磷采用酸溶-钼锑抗比色法测定。速效磷采用碳酸氢钠法进行测定。有机质采用水合热重铬酸钾-硫酸比色法测定[17]。
2.4 DNA提取、PCR扩增及文库的构建
使用土壤DNA提取试剂盒(MEGA Soil DNA Kit,OmegaBiotekTM,USA)提取土壤的总DNA,将来自同一样地的6个DNA样品随机合并,得到5个土壤DNA混合样/样地,对样本进行编号(S1-S5)/S2、(T1-T5)/S5、(D1-D5)/S10。将来自同一样地的植物根系样品随机15个等量混合,得到2根系混合样品/样地,对样本进行编号(s1-s2)/S2、(t1-t2)/S5、(d1-d2)/S10,随后使用试剂盒(Plant Genomic DNA Kit,天根,中国)提取DNA样本。提取的DNA质量和浓度采用Spectrophotometry分光光度计(热电公司,美国)进行浓度及纯度检测,用0.8%琼脂糖凝胶电泳检测DNA样品的完整性,电压120 V,电泳时间约为20 min[18]。
针对真菌核糖体基因间隔区的第一区(ITS1),采用真菌特异引物对ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')/ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')进行PCR扩增。PCR扩增反应体系为1.5 mmol·L-1MgCl2,0.4 mL dNTPs,1U Taq DNA重组聚合酶(Q5 GC high Enhancer)。PCR反应在AB 9700热循环仪(Applied Biosystems Inc.,Foster City,CA,USA)内进行。扩增程序为:98℃预变性30 s;98℃变性30 s,57℃退火40 s,72℃延伸30 s,一共27次循环;最后72℃终延伸5 min结束。将PCR产物进行2%琼脂糖凝胶电泳检测,将目标条带进行割胶回收,使用凝胶提取试剂盒进行纯化。
利用BioTek酶标仪将纯化获得PCR产物进行定量,参照Illumina文库构建试剂盒(Illumina®TruSeqTMDNA Sample Preparation Kit)指南进行文库的构建,将建好的DNA文库均一化至10 nmol·L-1后等体积混合。将混合好的文库(10n http://www.vip.com/detail-372880-48367416.html)稀释定量至4~5 pmol·L-1,再在Illumina MiSeq(Illumina Inc.,San Diego,CA)平台进行测序。
2.5 原始数据整理、过滤及优质序列获取
首先对获得的原始测序数据进行质量控制,即对双端的序列做质量过滤(碱基平均质量≥Q20(即碱基准确率为99%),序列长度≥150 bp,且不容许有N),利用软件Flash(http://www.genomics.jhu.edu/software/FLASH/index.shtml)对通过质量过滤的序列进行连接,要求两端序列(read1和read2)的overlap≥10 bp,且不容许碱基错配。最后,根据序列标签提取每个样品的有效序列[18-19]。
因为高通量测序建库过程中的PCR扩增易产生嵌合体序列以及点突变等系统错误,所以需要对有效序列进行进一步过滤和去除嵌合体处理,本研究使用mothur(version 1.31.2,http://www.mothur.org/)软件中uchime的方法去除嵌合体序列。
2.6 统计分析
利用Qiime调用uclust德尔方法[20]对优质序列按相似度≥97%进行OTU的聚类,选取每个类最长的序列为代表序列。然后调用RDP-classifier[21]的方法,以RDP数据库的序列为训练集对OTU代表序列进行注释,最终得到每个OTU分类学信息。利用Qiime软件对所有序列进行随机抽样,以抽取到的序列数与它们所能代表OTU的数目构建稀释曲线。同时计算各个林龄文冠果林的真菌群落丰富度指数chao1[22]、多样性指数Simpson指数[23]和Shannon指数[24]。利用Qiime软件的unifrac分析不同样品间的距离矩阵,进行PCoA真菌群落主成分分析。方差分析等数据统计分析在SPSS软件中处理[23]。
3 结果与分析
3.1 不同林龄的文冠果林地土壤性质
由表2可以看出,该地区土壤养分含量普遍偏低。S2林地含水量较高。各样地根际土壤有效磷含量指标差异显著,随林木生长逐年降低,其中S2林地的有效磷(5.18 mg·kg-1)和全磷质量分数(0.23 g·kg-1)均最高。

表2 文冠果人工林样地根际土壤养分特征
3.2 测序结果
根据高通量测序结果对序列进行统计,测序共获得clean reads有238.8104万个(土壤209.2113万个,根系295.991 0万个),15个土壤样本共获得优质序列1 198 791条,6个植物样本共获得优质序列180 990条(表3)。样地内土壤和植物样本的优质序列长度分布见表4,其中碱基数大于250 bp的获得优质序列696 422条,碱基数在230~250 bp的共获得优质序列696 422条,S2、S5、S10样地内土壤和植物样本的优质序列分别为490 230、488 397、401 154条。

表3 文冠果人工林根系及土壤样品序列

表4 优质序列长度分布
基于97%的相似度水平,共获得1 115个OTUs。利用reads vs.OTUs稀释曲线来评估样本的测序数据量是否足够[25]。从稀释曲线(图1)可以看出,21个样本的稀释曲线均趋于平缓,说明测序趋于饱和,测得的数据可以反映土壤及植物根内真菌群落的真实情况。
3.3 土壤与根内共生真菌群落组成
所有样品中,共获得1115个OTU的代表序列705 990条。其中,在门水平上441 243条,占总数的62.5%;在纲水平上427 829条,占总数的60.6%;在目水平上398 178条,占总数的56.4%;在科水平上355 112条,占总数的50.3%。其中,在门水平上子,囊菌门(Ascomycota)占总数的56.2%,担子菌门(Basidiomycota)占总数的4.0%;在目水平上,肉座菌目(Hypocreales)占总数的19.7%,格孢菌目(Pleosporales)占总数的13.6%。文冠果根系及土壤样本具体目分类水平上真菌菌株OTUs可见表5。在科水平上,丛赤壳科(Nectriaceae)占总数的14.3%,发菌科(Trichocomaceae)占总数的8.6%。
文冠果根际土壤真菌(S2+S5+S10)共获得1 028个OTUs代表序列525 000条,子囊菌门占总数的45.3%、担子菌门占总数的21.8%、壶菌门(Chytridiomycota)占总数的3.50%、接合菌门(Zygomycota)占全部总数的2.72%。其中,子囊菌门内粪壳菌纲(Sordariomycetes)占总数的24.4%,座囊菌纲(Dothideomycetes)占总数的16.4%,散囊菌纲(Eurotiomycetes)占总数的8.7%,锤舌菌纲(Leotiomycetes)占总数的2.4%,盘菌纲(Pezizomycetes)占总数的0.3%,茶渍纲(Lecanoromycetes)占总数的0.2%。在担子菌门,银耳纲(Tremellomycetes)占总数的3.4%,伞菌纲(Agaricomycetes)占总数的0.4%,囊担子菌纲(Cystobasidiomycetes)占总数的0.1%,微球黑粉菌纲(Microbotryomycetes)占总数的0.1%。
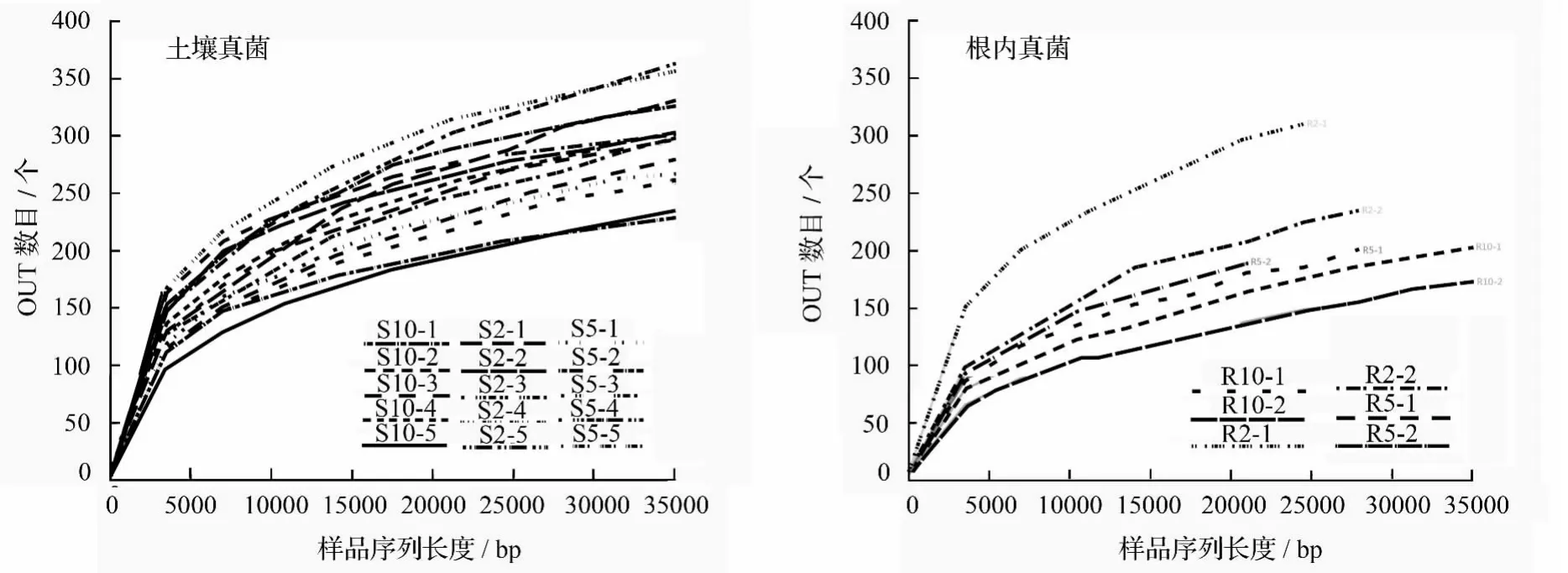
图1 文冠果人工林细根以及根际土壤真菌OTUs稀释曲线
对测序结果统计,根内真菌(R2+R5+R10)共获得514个OTUs,代表序列180 990条,子囊菌门占总数的27%、担子菌门占总数的7.5%、接合菌门占总数的0.1%等。在纲水平上,座囊菌纲占总数的26%、粪壳菌亚纲(Sordariomycetidae)占总数的16%、银耳纲占总数的7.2%、散囊菌纲(Eurotiales)占总数的2.8%等。在目水平上,格孢菌目占总数的26%、肉座菌目占总数的14%、散囊菌目占总数的2.7%、银耳目(Tremellales)占总数的0.6%。
菌根真菌有59个OTUs,其中外生菌根真菌获得56个OTUs,主要隶属于红菇科(Russulaceae)、硬皮马勃科(Sclerodermataceae)、锁瑚菌科(Clavulinaceae)、蜡壳耳科(Sebacinaceae)、革菌科(Thelephoraceae)等。丛植菌根真菌获得3个OTUs,主要隶属于球囊霉科(Glomeraceae)。
土壤真菌主要隶属于线黑粉菌科(Filobasidiaceae)、被孢霉科(Mortierellaceae)等。研究发现随文冠果林发育还出现一些特征菌,如枝孢菌属(Cladosporium)、镰刀菌属(Fusarium)、球座菌属(Guignardia)、壳多孢菌属(Stagonospora)、链格孢菌属(Alternaria)、葡萄座腔菌属(Botryosphaeria)、黑星菌属(Venturia)等。
维恩图(图2)所示,S2样地(S2+R2)共获得760个OTUs,土壤真菌(S)与根内共生真菌(R)共同有301个OTUs,S5样地(S5+R5)共获得632个OTUs,土壤真菌(S)与根内共生真菌(R)共同有227个OTUs,S10样地(S10+R10)共获得593个OTUs,土壤真菌(S10)与根内共生真菌(R10)共同有206个OTUs。
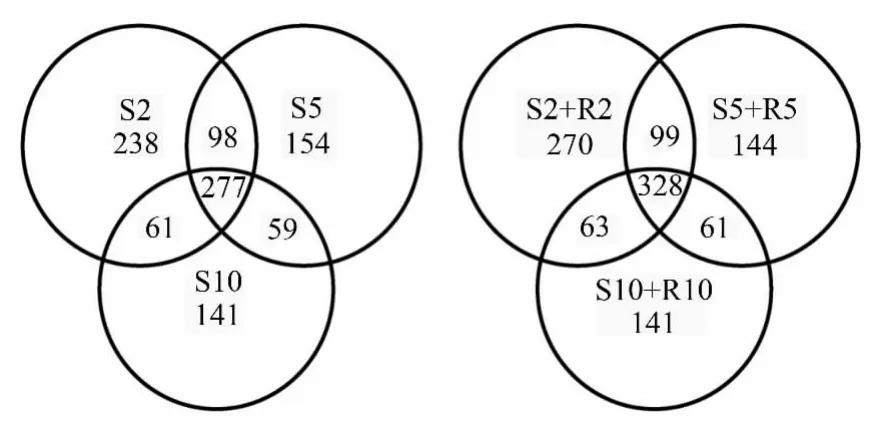
图2 文冠果人工林不同样地内真菌群落组成的维恩图
3.4 真菌群落的丰富度与多样性
利用α多样性分析真菌群落的丰富度。样本的丰富度指数Chao1、均匀度指数ACE和多样性指数Simpson/Shannon见表6。由表6可以看出,土壤与根内的真菌丰富度指数Chao1随林龄的增加均表现为略有减少的趋势,表明随文冠果林龄的增加土壤与植物根系的真菌物种数量可能减少。S2真菌群落Chao1数值明显较高,S5和S10的数值变化不大,表明文冠果10年生林根内的真菌物种数量相对稳定。ACE指数变化显示,随文冠果林龄增长,土壤与根内真菌群落均匀度先下降后上升。文冠果S2林未郁闭,林内光线充足,林下植被较为丰富,土壤真菌的丰富度也随之增加,S10林真菌群落结构趋于稳定。Simpson指数显示,根内真菌群落多样性S2林较高,而土壤真菌群落多样性S2林明显低于S10林。Shannon多样性指数逐年递减。

表5 文冠果人工林根系及土壤样本目分类水平上的真菌菌株OTUs
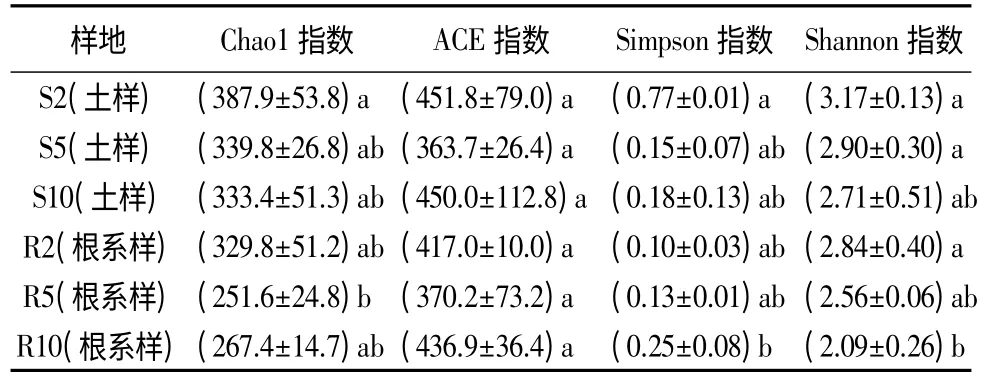
表6 文冠果根际土壤和根系真菌群落的丰富度和多样性
3.5 土壤养分与真菌群落多样性
通过SPSS对土壤理化性质与群落多样性进行相关分析。由表7可以看出,全氮与速效磷含量与Chao1指数间存在显著相关性。多样性指数Shannon与全氮、速效氮、全磷、速效磷质量分数成正相关。
3.6 不同林龄真菌群落间的关系
对各林龄文冠果林真菌群落进行主成分分析(图3),来自相同林龄样地的土壤真菌群落呈现一定的规律性,S2、S5、S10主要在PC1(贡献率为12.56%)上分离,表明不同林龄文冠果真菌群落结构组成差异较大。

表7 文冠果人工林土壤养分与真菌群落多样性指数的相关性

图3 真菌群落主成分(PCoA)分析
4 结论与讨论
运用第2代高通量测序技术,对文冠果人工林不同林龄根际真菌群落进行了分析,并研究了真菌群落与环境之间的关系。结果表明,受文冠果林木发育的影响,土壤养分含量,真菌群落结构、丰富度和多样性均发生变化。文冠果S2林地土壤理化性质、真菌群落丰富度指数、多样性指数优于S5及S10阶段。S5和S10林地真菌群落变化相对平稳,部分真菌形成优势种群。S10林地土壤肥力衰退,病原真菌群落增加。
PCoA分析结果显示,不同林龄文冠果真菌群落结构组成差异显著。在S10林地中特征菌属的出现可能与林地土壤质量和生产力下降有关。球座菌属、小光壳属(Leptosphaerulina)、球腔菌属(Mycosphaerella)包含许多危害严重的植物病原菌,其中M.aleuritidus是我国云南油桐黑斑病的致病菌。壳多孢菌部分病原真菌可造成植物叶斑病和根腐病[26]。高通量测序共计705 990条OTUs代表序列读数,其中,镰刀菌属、链格孢属、球腔菌属及青霉属(Penicillium)真菌一共得到239 300条,占总读数的33.9%。由此推测,文冠果人工林真菌群落多样性降低可能与植物致病真菌占优势地位有关。在根内真菌中有部分未鉴定真菌逐年递增,推测可能其与文冠果根系生长发育有密切联系,但因对植物内生菌知之甚少,所以需进一步进行生态和生理方面的研究。
土壤真菌群落结构多样性会受多种因素的影响,外因主要有植被类型、气候条件、土壤类型和人类活动等,内因主要有与土壤真菌生长密切相关的土壤有机质组成和土壤养分含量等[27]。本研究表明,土壤有机质质量分数S5林高于S2林,而真菌群落丰富度指数S2林明显高于S5林。原因可能在于:随林木生长,植被凋落物、地下凋落物、土壤微生物残体的分解与周转及人工管理影响土壤有机质含量[28],土壤有机质的积累促进异养微生物的生长,进而造成真菌群落丰富度的降低。另外,S2林未郁闭,林间光线充足,林下植被较为丰富,土壤真菌的丰富度也随之增加。S5林、S10林真菌群落丰富度变化不大,原因可能是纯林造成的土壤退化、容量增加等限制因素影响真菌群落的生长和代谢,从而导致真菌群落数量和丰度达到一定水平下的动态平衡。
通过相关性分析发现,土壤真菌丰富度指数和土壤中全氮和速效磷质量分数显著正相关。这一结果与何苑皞等[27]在杉木人工林土壤真菌遗传多样性中的研究结果一致,表明在土壤中可能存在某种真菌群落具有参与氮素与磷素周转的功能。因此,土壤中的氮、磷含量成为该地区土壤真菌群落的生长限制因子。许多研究证实,土壤中氮素含量对土壤微生物生物量和群落组成有直接影响[29]。此外,有研究表明,部分真菌具有解磷功能,如青霉菌、曲霉菌(Aspergillus)、根霉菌(Rhizopus)、镰刀菌和小菌核菌(Sclerotiumrolfsii)等[29]。此外,土地杆菌属(Pedobacter)的部分菌株能够产生植酸酶,可分解植物种子中的植酸磷,释放出肌醇和无机磷,增加土壤中有效磷含量[30-32]。试验结果显示,S2林真菌群落丰富度地明显高于S5和S10阶段,这一结果与土壤真菌样本所得结果一致。Simpson指数显示根内真菌多样性逐年降低,这与土样中真菌多样性呈现递增趋势正好相反。原因可能由于某种根内真菌与植物根系形成共生体系,这种共生体系有助于根内真菌的生长及繁殖,使其逐渐成为优势种群进而影响其他根内真菌群落的数量[33-35]。
本研究的对象是根际真菌的群落结构,同时包括土壤样本和植物根系样本。采用这种取样方式,可以更好地分析植物根系内生真菌与根际土壤真菌之间的群落变化关系。另外,试验还存在一些不足,由测序结果可知根内与土壤菌根真菌的OTU数量较少,原因可能与菌根PCR引物的特异性有关。试验仅关注环境对真菌群落结构的变化影响,忽视了细菌对其产生的作用。上述存在的问题还需要进一步分析。
[1]高述民,马凯,杜希华,等.文冠果(Xanthoceras sorbifolia)研究进展[J].植物学通报,2002,19(3):296-297.
[2]谢志玉,张文辉,刘新成.干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J].西北植物学报,2010,30(5):948-954.
[3]刘丽,徐明恺,汪思龙,等.杉木人工林土壤质量演变过程中土壤微生物群落结构变化[J].生态学报,2013,33(15):4692-4706.
[4]田地,马欣,李玉娥,等.利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J].环境科学,2013,34(10):4096-4104.
[5]Benayas J M R,Newton A C,Diaz A,et al.Enhancement of biodiversity and ecosystem services by ecological restoration:ameta-analysis[J].Science,2009,325:1121-1124.
[6]Doran J W,Zeiss M R.Soil health and sustainability:managing the biotic component of soil quality[J].Applied Soil Ecology,2000,15(1):3-11.
[7]Rillig M C.Arbuscularmycorrhizae and terrestrial ecosystem processes[J].Ecological Letters,2004,7(8):740-754.
[8]Celik I,Ortas I,Kilic S.Effects of compost,mycorrhiza,manure and fertilizer on some physical properties of a Chromoxerert soil[J].Soil&Tillage Research,2004,78(1):59-67.
[9]Kolb S E,Fermanich K J,Dornbush M E.Effect of charcoal quantity on microbial biomass and activity in temperate soils[J].Soil Science Society of America Journal,2009,73(4):1173-1181.
[10]杨玉海,陈亚宁,蔡柏岩,等.极端干旱区胡杨根围丛枝菌根真菌的分离与鉴定[J].干旱区地理,2012,35(2):260-266.
[11]职桂叶,陈欣,唐建军.丛枝菌根真菌(AMF)对植物群落调节的研究进展[J].菌物系统,2003,22(4):678-682.
[12]闫绍鹏,杨瑞华,冷淑娇,等.高通量测序技术及其在农业科学研究中的应用[J].中国农学通报,2012,28(30):171-176.
[13]陈祥伟,陈立新,刘伟琦.不同森林类型土壤氮矿化的研究[J].东北林业大学学报,1999,27(1):5-9.
[14]Fierer N,Jackson R B.The diversity and biogeography of soil bacterial communities[J].Proceedings of the National Academy of Sciences USA,2006,103(3):626-631.
[15]Lauber C L,Hamady M,Knight R,et al.Pyrosequcing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J].Applied&Environmental Microbiology,2009,75(15):5111-5120.
[16]Rousk J,Bååth E,Brookes P C,et al.Soil bacterial and fungal communities across a pH gradient in an arable soil[J].The ISME Journal,2010,4(10):1340-1351.
[17]刘光崧.中国生态系统研究网络观测与分析标准方法:土壤理化分析与剖面描述[M].北京:标准出版社,1996.
[18]吴敏娜,张惠文,李新宇,等.提取北方土壤真菌DNA的一种方法[J].生态学杂志,2007,26(4):611-616.
[19]Schloss P D,Westcott SL,Ryabin T,et al.Introducingmothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Appl Environ Microbiol,2009,75(23):7537-7541.
[20]Caron D A,Countway P D,Savai P,et al.Defining DNA-baesd operational taxonomic units for microbial-eukaryote ecology[J].Applied and Environment Microbiology,2009,75(18):5797-5808.
[21]Toju H1,Yamamoto S,Sato H,et al.Community composition of root-associated fungi in a Quercus-dominated temperate forest:“codominance”of mycorrhizal and root-endophytic fungi[J].Ecology and Evolution,2013,3(5):1281-1293.
[22]Chao A.Nonparametric estimating the number of classes in a population[J].Scandinavian Journal of Statistics,1984,11(4):265-270.
[23]Chao A,Lee S M.Estimating the number of classes via sample coverage[J].Journal of the American Statistic Association,1992,87:210-217.
[24]Li Xiaogang,Ding Changfeng,Zhang Taolin,et al.Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J].Soil Biology&Biochemistry,2014,72:11-18.
[25]Edgar R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[26]陈鹏,刘宏屏,王达明,等.云南油桐黑斑病危险性分析[J].林业调查规划,2006,31(2):116-118.
[27]何苑皞,周国英,王圣洁,等.杉木人工林土壤真菌遗传多样性[J].生态学报,2014,34(10):2725-2736.
[28]Frey SD,Knorr M,Parrent JL,et al.Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J].Forest Ecology and Management,2004,196(1):159-171.
[29]沈海龙,丁宝永,沈国舫,等.樟子松人工林下针阔叶凋落物分解动态[J].林业科学,1996,32(5):393-402.
[30]陈立新,陈祥伟,史桂香,等.提高落叶松人工林林地质量的研究[J].东北林业大学学报,1998,26(3):6-11.
[31]王桂君,Ohsowoski B,李玉,等.菌根菌剂及土壤改良剂对退化生态系统的修复潜能分析[J].生态经济,2014,30(7):179-184.
[32]谭艳,王邵军,阮宏华,等.不同林龄杨树人工林土壤动物群落结构特征[J].南京林业大学学报:自然科学版,2014,38(3):8-12.
[33]袁亮,李絮花,李润,等.设施栽培土壤磷酸酶活性及其与土壤养分的关系[J].山东农业科学,2007(3):80-83.
[34]段思蒙,申佩弘,潘莉莉,等.PCR-RFLP分析桉树人工林土壤微生物的群落结构[J].基因组学与应用生物学,2009,28(5):859-864.
[35]Schloss P D,Westcott T,Ryabin JR,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].App Environ Microbiol,2009,75(23):7537-7541.
