比索洛尔治疗稳定期慢性阻塞性肺疾病61例疗效评价
2015-03-06王贵臣
李 侠,王贵臣
(河北省廊坊市人民医院,河北 廊坊 065000)
比索洛尔治疗稳定期慢性阻塞性肺疾病61例疗效评价
李 侠,王贵臣
(河北省廊坊市人民医院,河北 廊坊 065000)
目的 观察高选择性1受体阻滞剂比索洛尔对稳定期慢性阻塞性肺疾病(COPD)患者的疗效。方法 将122例患者随机分为观察组和对照组,各61例。对照组应用羧甲司坦片治疗,观察组在对照组基础上加用比索洛尔治疗。结果 两组治疗后静息心率、BODE评分、血清淀粉样蛋白A(SAA)、C反应蛋白(CRP)水平均显著低于治疗前(P<0.05),第1秒用力呼气量(FEV1)显著高于治疗前(P<0.05)。观察组治疗后 BODE评分为(1.84±0.51)分,静息心率为(74.42±5.25)次/分,CRP为(17.34±5.25)mg/L,SAA为(41.67± 4.05) g/L,均明显低于对照组的(2.21±0.58)分、(77.06±5.48)次/分、(21.65±6.32)mg/L及(47.72±5.47) g/L;FEV1为(1.40±0.19)L,显著高于对照组的(1.32±0.22)L(P<0.05)。结论 比索洛尔可有效控制稳定期COPD患者的静息心率,提高运动耐量,降低全身炎症水平,提高生活质量。
比索洛尔;慢性阻塞性肺疾病;稳定期;运动耐量;静息心率;炎症水平
慢性阻塞性肺疾病(COPD)治疗上除抗炎、祛痰外,还应积极控制心率、降低心肌耗氧、提高运动耐量[1]。β1受体阻滞剂可降低机体对交感肾上腺素能神经的活性,从而减慢心率、降低心肌耗氧量、降低心肌收缩力,有效提高患者运动耐量,临床广泛用于心绞痛、高血压的治疗。比索洛尔无内在拟交感活性[2],对 β2受体亲和力很低,更适用于伴有心率加快的COPD患者。本研究中应用高选择性β1受体阻滞剂比索洛尔治疗稳定期COPD患者,现报道如下。
1 资料与方法
1.1 一般资料
选取我院呼吸内科2013年至 2014年 2月收治的稳定期COPD患者122例。纳入标准:治疗期间无COPD急性加重或其他疾病急性发作;对此研究及治疗知情同意。排除标准:支气管哮喘、活动性肺结核、肿瘤、肺间质纤维化、控制不良的糖尿病、心力衰竭、肾功能不全;血压低于110/70 mmHg;合并其他严重心肺疾病;治疗期间使用其他药物如激素类吸入剂,其他吸入性β受体阻滞剂。依据全球倡议的COPD诊断的金标准(GOLD)确诊,即吸入支气管舒张剂后第1秒用力呼气量(FEV1)<80%预计值且FEV1/用力肺活量(FVC)<70%预计值[3]。122例患者中,男 72例,女50例;年龄52~76岁,平均(63.7±7.8)岁;GOLD分级2 级74例,3级48例。按随机数字法分为观察组和对照组,各61例。两组患者一般资料比较,无显著性差异(P>0.05),具有可比性。详见表1。
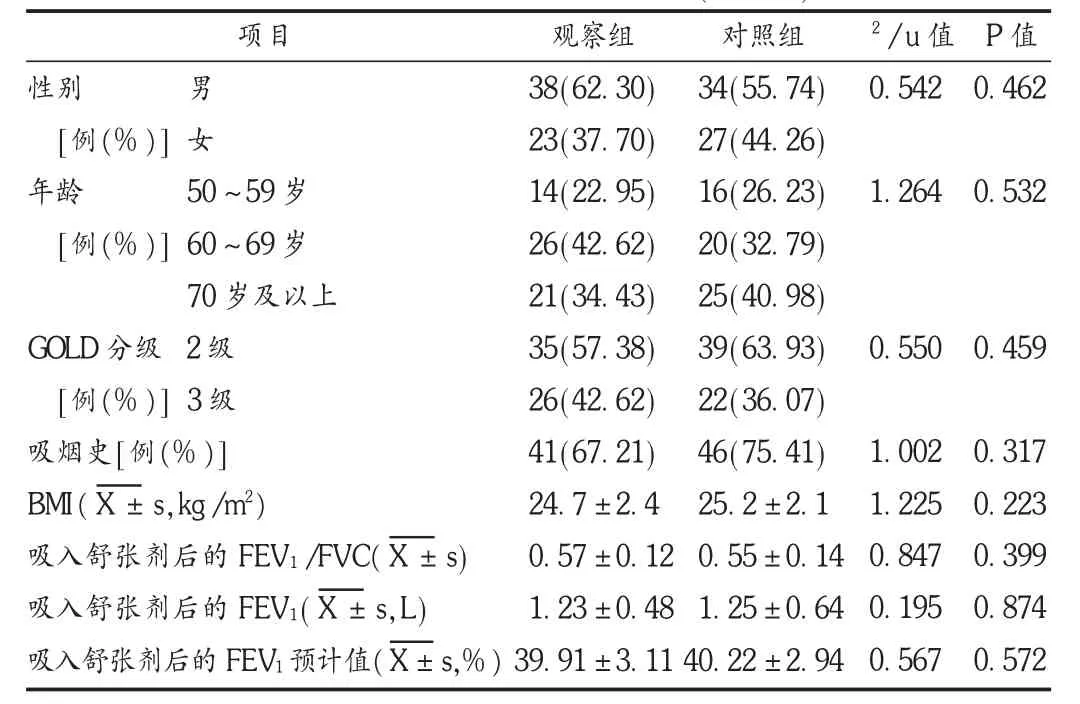
表1 两组患者一般资料比较(n=61)
1.2 方法
对照组口服羧甲司坦片(广州白云山制药有限公司广州白云山制药总厂,批号为1140011,规格为每片0.25 g)治疗,每次0.5 g,3次/日,15 d为1个疗程,连续服用2个疗程;观察组在此基础上加用富马酸比索洛尔片(德国默克公司,批号为139056,规格为每片5 mg),每次5 mg,1次/日,服药疗程同对照组。2个疗程后对比临床疗效。
1.3 观察指标
BODE评分:为4个维度评分之和,见表2。其中受试者在吸入短效β2受体激动剂沙丁胺醇气雾剂400 μg,15 min后测试气流阻塞程度,利用肺功能仪记录每例患者FEV1,FVC、FEV1%及FEV1/FVC;采用改良呼吸困难量表(MMRC)[4]评价呼吸困难程度,分数从0~4分,分值越高呼吸困难程度越明显;采用6分钟步行试验(6MWT)评价运动能力。

表2 BODE评分表
炎症指标检测:采用酶联免疫吸附试验(ELISA)法检测患者血清C反应蛋白(CRP)和血清淀粉样蛋白A(SAA)指标。
静息心率检测:指患者在清醒、不活动的安静状态下时测得的心率。
1.4 统计学处理
采用SPSS 19.0软件分析。定量数据用均数±标准差(±s)表示,行两样本 u检验;定性数据比较行 χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表3。
3 讨论
研究表明,COPD是以炎症为核心的多因素共同参与的疾病[5]。其病理生理过程中,单核细胞、中性粒细胞、淋巴细胞、巨噬细胞等移行至病灶处,释放炎性介质、氧自由基、蛋白激酶等因子,引起氧化/抗氧化失衡、蛋白酶 /抗蛋白酶失衡,最终导致水肿、黏膜充血、局部炎症、变性坏死等病理改变,使纤维组织增生、肉芽组织形成,导致气道管腔狭窄、气流受限[6]。COPD急性加重期患者表现为咳嗽、气短、咳痰、喘息加重,痰量增多,发热症状甚至呼吸衰竭,稳定期上述症状则明显好转,但慢性炎症依然存在。
表3 两组患者观察指标比较(±s,n=61)

表3 两组患者观察指标比较(±s,n=61)
观察指标BODE评分(分) u值6.631 2.732 P值<0.001 0.007静息心率(次/分)6.537 3.391 <0.001 0.001 FEV1(L)8.273 6.678 <0.001 <0.001 CRP(mg/L)8.893 7.009 <0.001 <0.001 SAA( g/L)组别观察组对照组u值P值观察组对照组u值P值观察组对照组u值P值观察组对照组u值P值观察组对照组u值P值治疗前2.61±0.75 2.52±0.67 0.699 0.486 81.42±6.51 80.54±5.85 0.785 0.434 1.15±0.14 1.18±0.20 0.960 0.339 28.60±8.38 30.41±7.44 1.262 0.209 52.42±4.91 53.35±5.14 1.022 0.309治疗后1.84±0.51 2.21±0.58 3.742 <0.001 74.42±5.25 77.06±5.48 2.717 0.008 1.40±0.19 1.32±0.22 2.149 0.034 17.34±5.25 21.65±6.32 4.097 <0.001 41.67±4.05 47.72±5.47 6.943 <0.001 13.191 5.858 <0.001 <0.001
C反应蛋白(CRP)是炎症标志物中最敏感的一种,健康人体内CRP含量较低,在急性炎症反应阶段含量可迅速增加1 000多倍。COPD患者无论是急性加重期还是稳定期,血清CRP水平均显著增加,且CRP的增加与不良预后正相关[7]。本研究结果显示,经比索洛尔治疗后,COPD患者血清CRP水平显著下降,提示比索洛尔不仅具有降低心率作用,还具有抗炎活性,与Madej等[8]的研究结果相似。SAA是组织淀粉样A蛋白的前体,感染性疾病尤其是病毒感染的患者体内可检测到,临床常用于急性炎症的监测。机体在各种炎症刺激时,SAA水平可在8~12 h达峰值,其半衰期短;当炎症控制后,SAA可迅速降至正常水平,提示SAA主要参与宿主的防御反应。在COPD急性发作期患者中,SAA是比CRP更敏感的炎症标记物。本研究结果也显示,经比索洛尔治疗后COPD患者血清SAA水平显著下降。
在COPD患者的疾病中、晚期,患者因缺氧及二氧化碳潴留,反射性刺激主动脉体及颈动脉窦,兴奋交感神经,促进儿茶酚胺分泌,导致心肌耗氧增加,心率加快,患者运动耐量下降,出现气短、胸闷等症状。静息心率升高是心血管事件的独立危险因子[9],控制静息心率,可降低患者心血管事件导致的死亡率,提高运动耐量,延长寿命,提高生活质量。比索洛尔是高选择性β1受体阻滞剂,通过对心脏β1受体的阻滞作用而抑制交感肾上腺素能的活性,引起心率减慢,心肌耗氧量、心肌收缩力下降,提高运动耐量;同时其对支配血管、支气管平滑肌的β2受体亲和力很低,故并不会导致COPD患者气道收缩、痉挛,临床应用安全[10]。比索洛尔可显著改善COPD患者肺功能[11],并显著降低患者静息心率。本研究结果也表明,观察组患者静息心率较治疗前显著下降,每分钟下降13次左右,提示比索洛尔可降低患者心肌耗氧量,提高患者生活质量。
COPD患者住院后均会进行肺功能检测,但单纯应用 FEV1和FVC来评价COPD存在一定的局限性,因此临床常采用BODE评分来系统评价 COPD患者的呼吸及全身各系统功能状态[12]。BODE量表主要用来测定患者气流阻塞程度、呼吸困难程度、运动能力等,对COPD危险事件的预测要强于FEV1。有学者对COPD各种评价方案进行综合分析后认为,BODE评分是判断COPD患者预后的理想指标之一[13]。本研究结果发现,COPD稳定期患者口服比索洛尔治疗后,BODE评分显著降低,FEV1水平显著升高,提示患者肺功能显著改善,生活质量显著提高。
综上所述,选用高选择性 β1受体阻滞剂比索洛尔治疗稳定期的COPD患者,可有效控制其静息心率,提高运动耐量,降低全身炎症水平,提高生活质量。
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].全科医学临床与教育,2013,11(6):603-607.
[2]熊亚琼,洪永青,王立新,等.比索洛尔治疗慢性阻塞性肺疾病合并肺部感染患者的疗效及作用机制[J].现代中西医结合杂志,2014,23(32):82-84.
[3]黄俊芳,王广发.慢性阻塞性肺病全球倡议慢性阻塞性肺病指南(2013更新版)解读[J].中国医学前沿杂志:电子版,2013,11(3):65-69.
[4]Kluve-Beckerman B,Hardwick J,Du L,et al.Antisense oligonucleotide suppression of serum amyloid A reduces amyloid deposition in mice with AA amyloidosis[J].Amyloid,2011,18(3):136-46.
[5]李小莉,黄 平,杜秀芳.慢性阻塞性肺疾病治疗期间呼出气冷凝液中8-异前列腺素、IL-6、IL-10的变化与气道炎症的相关性研究[J].中国呼吸与危重监护杂志,2014,87(6):79-80.
[6]李 宁,吴先龙.舒利迭与噻托溴铵预防慢性阻塞性肺疾病急性加重的疗效比较[J].中国药业,2013,22(11):24-25.
[7]Gao P,Zhang J,He X,et al.Sputum inflammatory cell-based classification of patients with acute exacerbation of chronic obstructive pulmonary disease[J].PLoS One,2013,8(5):e57 678.
[8]Madej A,Buldak L,Basiak M,et al.The effects of 1month antihypertensive treatment with perindopril,bisoprolol or both on the ex vivo ability ofmonocytes to secrete inflammatory cytokines[J].Int J Clin Pharmacol Ther,2009,47(11):686-694.
[9]李 婧,陈汉想,李 伟,等.心率与急性心肌梗死心源性休克发生率的关系[J].临床合理用药杂志,2014,7(1):19-20.
[10]Ageev FT,Makarova GV,Patrusheva IF,et al.The efficacy and safety of the combination of -blocker bisoprolol and if inhibitor I(f)ivabradine in patients with stable angina and chronic obstructive pulmonary disease[J].Kardiologiia,2010,50(10):22-26.
[11]Lainscak M,Podbregar M,Kovacic D,et al.Differences between bisoprolol and carvedilol in patients with chronic heart failure and chronic obstructive pulmonary disease:a randomized trial[J].Respir Med,2011,105(Suppl):S44-S49.
[12]尹平辉,陈 欣,吴文钦.BODE指数评估中度慢性阻塞性肺疾病稳定期肺康复治疗[J].临床肺科杂志,2009,14(8):46-48.
[13]王凤燕,赵海金,蔡绍曦.慢性阻塞性肺疾病急性加重住院患者的临床预后指标[J].中国呼吸与危重监护杂志,2014,17(4):21-22.
R969.4;R972+.2
A
1006-4931(2015)17-0050-02
2014-11-13)
