不同质子泵抑制剂对非ST段抬高型急性冠状动脉综合征患者氯吡格雷抗血小板疗效的影响
2015-03-06赖绍斌邓斌苏良献赵冬华郑晓丹任惠欢黄剑霞
赖绍斌 邓斌 苏良献 赵冬华 郑晓丹 任惠欢 黄剑霞
·临床研究·
不同质子泵抑制剂对非ST段抬高型急性冠状动脉综合征患者氯吡格雷抗血小板疗效的影响
赖绍斌 邓斌 苏良献 赵冬华 郑晓丹 任惠欢 黄剑霞
目的 探讨质子泵抑制剂对接受氯吡格雷抗血小板治疗的非ST段抬高型急性冠状动脉综合征(NSTE-ACS)患者疗效的影响。方法 采用前瞻性研究,共纳入2012年1月至2013年6月接受冠状动脉内药物洗脱支架置入的NSTE-ACS患者145例,采取密封信封抽样形式分为A和B两组,在标准药物治疗(氯吡格雷、阿司匹林、低分子肝素、硝酸酯类、调脂药以及其他常规治疗)基础上,A组合用泮托拉唑(72例)而B组合用奥美拉唑(73例)。观察1年内患者的消化道出血事件以及主要不良心血管事件,包括全因死亡、心原性死亡、卒中、因心绞痛或心力衰竭再住院、血运重建。结果 A和B两组心血管事件发生率差异无统计学意义(均为P>0.05),其中全因死亡(6.9%比5.5%)、心原性死亡(4.2%比5.5%)、因心绞痛或心力衰竭再住院(16.6%比15.0%)和血运重建(11.1%比12.3%),消化道出血发生率差异亦无统计学意义(5.6%比5.5%,P>0.05)。结论 本研究入选的NSTE-ACS患者中,两类质子泵抑制剂对氯吡格雷抗血小板疗效的影响无显著差异。
质子泵抑制剂; 血小板聚集抑制剂; 急性冠状动脉综合征; 氯吡格雷
急性冠状动脉综合征(acute coronary syndrome,ACS)严重危害人类健康,近年来经皮冠状动脉介入术(percutaneous coronary intervention,PCI)特别是冠状动脉内支架置入术为治疗ACS的最重要手段之一。大规模临床试验表明,药物支架置入后患者面临支架内晚期血栓形成的风险[1-3]。双联抗血小板(即合用阿司匹林与氯吡格雷)能有效降低这一风险,各指南均推荐置入药物支架后双联抗血小板12个月或以上[4]。但氯吡格雷和阿司匹林,无论单用或联用,均可增加出血事件特别是消化道溃疡出血的风险,据报道,两药联用使严重消化道出血风险增加7.4倍[5]。近年来多加用质子泵抑制剂(proton pump inhibitor,PPI)来预防PCI术后双联抗血小板人群的消化道出血,但其是否削弱氯吡格雷的抗血小板疗效一直备受关注。Gilard等[6]已观察到奥美拉唑有可能通过竞争抑制CYP2C19酶而降低氯吡格雷抗血小板疗效,导致ACS患者心血管事件发生率升高。而另一类PPI,如泮托拉唑、埃索美拉唑对CYP2C19影响很弱[7]。目前尚无PPI与氯吡格雷联用是否影响后者的抗血小板疗效的前瞻性研究报道,故我们进行了如下探讨。
1 对象和方法
1.1 入选和排除标准
排除标准:(1)年龄>75岁;(2)心绞痛症状稳定3个月以上;(3)心电图ST段抬高;(4)有出血倾向、血小板<100×109/L以及1个月内出血史等不适宜接受两联抗血小板治疗;(5)入选前已接受PPI或氯吡格雷治疗>1周;(6)心功能Killip分级Ⅲ/Ⅳ级或NYHA分级Ⅳ级;(7)肝肾功能不全[肌酐≥178 μmol/L和(或)丙氨酸氨基转移酶≥80 U/L];(8)不能严格遵嘱服药者。
1.2 入选患者资料
本研究入选2012年1月至2013年6月肇庆市第一人民医院符合上述标准的患者145例,采取密封信封抽取形式随机分为两组:A组合用泮托拉唑72例,其中男性40例,女性32例,年龄45~74岁,平均(57.3±11.3)岁;B组合用奥美拉唑73例,其中男性42例,女性31例,年龄46~74岁,平均(58.2±12.2)岁。
1.3 研究方法
收集患者心血管高危因素(包括吸烟、高血压、糖尿病、血脂异常等)以及消化系统既往病史等资料,入院后完善心电图、心肌损伤标志物、血常规、肝肾功能、血脂、氮末端脑钠肽前体、彩色超声心动等检查。评估患者心功能。收集患者冠状动脉造影所见冠状动脉病变情况以及置入支架情况。
所有患者均接受标准药物治疗,包括阿司匹林、氯吡格雷、硝酸酯类、低分子肝素、他汀类调脂药,根据病情加用β受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂和(或)钙离子拮抗剂。其中双联抗血小板用法为PCI治疗前接受3 d以上的氯吡格雷(75 mg/d)及阿司匹林(100 mg/d),急诊PCI治疗者术前1次口服氯吡格雷300 mg及阿司匹林300 mg;PCI术后每天服用氯吡格雷75 mg+阿司匹林100 mg共12个月。
人们在阐释文化的内涵与外延时,往往并未将“传播”纳入其研究视野。论及传播与文化的关系,复旦大学殷晓蓉教授认为:“尽管地球上自有人类而言,传播就开始了,尽管传播与人俱来,尽管传播是如此重要——它是人之现实存在的运动方式,无传播即无所谓人类,亦无所谓人类文化,可是,人们对传播这种文化方式多少有些漠然,传播学的晚成和不够成熟,就是一个例证。”[3]
PCI术后按照密封信封抽取法进入试验分组,A组同时服用泮托拉唑40 mg/d(72例),B组同时服用奥美拉唑40 mg/d(73例)。氯吡格雷为赛诺菲圣德拉堡集团公司产品,批号J20080090;泮托拉唑为德国安达制药有限公司产品,批号H20090933;奥美拉唑为阿斯利康制药有限公司产品,批号H20030412;阿司匹林为拜耳-先灵医药股份有限公司产品,批号J20080078。
随访1年,观察心血管事件和消化道出血事件。其中主要不良心血管事件包括全因死亡、心原性死亡、卒中、因心绞痛或心力衰竭再住院、血运重建。
1.4 统计学方法

2 结果
入选患者145例无失访。A和B组分别有2例和1例出院3个月后自行停服他汀类药物,这3例患者随诊1年均无不良事件发生;随诊1年中A和B组分别有6例和5例丙氨酸氨基转移酶轻度升高,但均<80 U/L,均未停用他汀类药物。
2.1 基线资料和治疗情况
入选人群糖尿病、高血压、吸烟及体质指数异常等冠心病高危因素比例高于普通人群,入院心电图ST段压低导联数接近5,最大压低幅度约为0.4 mV,罪犯血管主要为前降支及右冠状动脉,接近80%。PCI平均置入支架1.8枚,西罗莫司药物洗脱支架约占70%,紫杉醇药物洗脱支架约占30%。治疗药物主要为氯吡格雷、阿司匹林、低分子肝素、他汀类调脂药及硝酸酯类药物,其中β受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂使用率均>80%。A、B两组基线资料及住院期间药物治疗方案差异无统计学意义,见表1~2。
2.2 主要不良心脏事件
随访1年,A组患者因心血管原因再入院20例,接受再灌注治疗8例,随访期间5例死亡,其中心原性死亡3例;B组因心血管原因再入院20例,接受再灌注治疗9例,随访期间5例死亡,其中心原性死亡4例。A和B两组间主要不良心脏事件,包括全因死亡、心原性死亡、因心绞痛或心力衰竭再住院和血运重建的差异均无统计学意义(均为P>0.05),见表3。
2.3 消化道出血事件
随访1年,A和B两组发生消化道出血事件均为4例(5.6%比7.5%,P>0.05),两组患者发生消化道出血均表现为成形黑便,无呕血、血便及循环衰竭表现,查血红蛋白均>90 g/L,未行输血治疗。发生消化道出血后,均停用阿司匹林,保留氯吡格雷,PPI增量至2次/d,待大便潜血阴性后再加用阿司匹林,酌情减量PPI至1次/d,见表3。

表1 两组患者基线情况比较
注:BMI:体质指数;CK-MB:肌酸激酶同工酶;cTnT:肌钙蛋白T;LAD:前降支;LCX:左回旋支;RCA:右冠状动脉;ALT:丙氨酸氨基转移酶;NT-proBNP:氮末端脑钠肽前体;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇

表2 两组患者接受治疗情况比较
注:ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂;CCB:钙离子拮抗剂
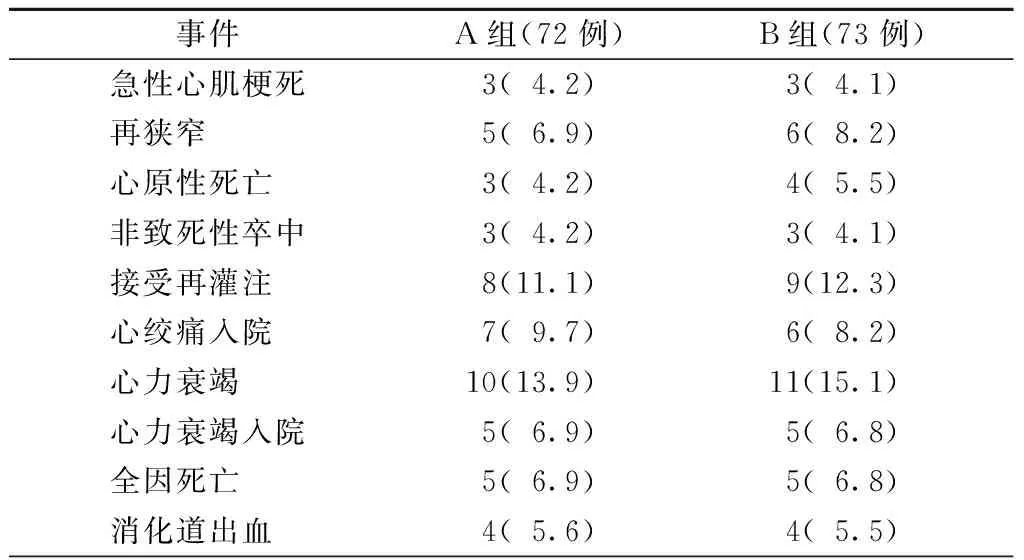
表3 随访1年两组的主要不良心脏事件>及消化道出血事件比较[例(%)]
3 讨论
对于NSTE-ACS危险性分层为重度危险的患者,PCI是重要的治疗方法。在接受药物支架置入后,双联抗血小板治疗对防止支架内晚期血栓及支架内再狭窄作用重大。2007年,欧洲心脏病学会NSTE-ACS治疗指南加强了双重抗血小板治疗(氯吡格雷+阿司匹林)的建议[8]。ACS共同的病理生理机制是在斑块破裂的基础上诱发急性血栓形成,且动脉血栓形成主要涉及血小板和凝血酶激活两个重要环节,所以抗血小板和抗凝血治疗是ACS的关键对策。抗血小板治疗也是动脉血栓疾病的常规标准治疗策略[9]。对于心血管高危患者,口服抗血小板药物能降低缺血事件危险,但可能增加出血并发症,以胃肠道出血最常见。高危出血风险的患者使用PPI可有效降低出血风险。美国心脏病学会基金会/美国胃肠病学会/美国心脏学会2008联合专家共识推荐,有胃肠道出血病史、溃疡病史(检查并根治幽门螺杆菌)、双联抗血小板治疗、同时应用华法林等抗凝药物、消化不良或有胃食管反流症状、年龄>60岁、使用皮质激素的患者加用PPI以减少胃肠出血危险[10]。
氯吡格雷是前体药,需通过细胞色素P450(CYP)同工酶CYP3A4和2C19[11]等的代谢,氧化水解才形成一种具有药理活性的代谢产物,该活性代谢产物不可逆地与血小板二磷酸腺苷受体P2Y12结合[12],最终抑制ADP受体活化,从而抑制血小板聚集。而PPI也主要通过CYP3A4和CYP2C19在肝脏代谢[7]。PPI与氯吡格雷合用时可能会因共同竞争CYP450同工酶的相同结合位点而发生药物的相互作用,其程度和结果取决于与CYP450同工酶相对亲和力的大小,高亲和力化合物将与酶结合并抑制低亲和力化合物的生化转化。Li等[7]研究表明,各种PPI与氯吡格雷的相互作用程度不同。奥美拉唑通过CYP2C19代谢为奥美拉唑羟基砜,母体化合物与CYP2C19的亲和力比CYP3A4的亲和力大10倍左右;兰索拉唑与奥美拉唑具有相同的代谢路径,对CYP2C19具有很强的抑制作用。雷贝拉唑的主要途径是经非酶降解,对CYP2C19和CYP3A4的影响较少,但其代谢产物雷贝拉唑硫醚对CYP2C19具有较强的抑制作用;埃索美拉唑、泮托拉唑对CYP2C19的抑制作用较低,特别是泮托拉唑,具有Ⅱ期代谢途径,当有其他药物在Ⅰ期代谢时,它可以通过Ⅱ期途径代谢,从而不易发生药物代谢酶的竞争性作用,减少体内药物间的相互作用。Gilard等[13]进行了124例PCI患者的前瞻性随机双盲研究表明,PPI(奥美拉唑)有可能通过抑制CYP2C19酶而降低氯吡格雷抗血小板药物的疗效。但也有学者认为PPI(泮托拉唑、埃索美拉唑)主要通过抑制CYP450 2C9,较少抑制CYP2C19,并不影响氯吡格雷的作用[14]。
本研究比较了对CYP2C19竞争性抑制较强(奥美拉唑)和较弱(泮托拉唑)的两大类PPI对入选NSTE-ACS患者接受药物洗脱支架置入后的1年心血管事件的影响,探讨其对氯吡格雷抗血小板疗效的影响。结果显示,两类PPI对入选人群与氯吡格雷抗血小板疗效密切相关的心血管事件的影响无显著差异;与未联用PPI的患者比较[15],本研究中的两组患者并未因加用PPI而降低与氯吡格雷的抗血小板疗效而致事件增加。本研究提示,对CYP2C19竞争性抑制作用较强或较弱的PPI对NSTE-ACS患者接受氯吡格雷抗血小板疗效的影响无显著差异,且未因联用PPI而增加不良心血管事件发生。但本研究未能完全排除样本量少及随访时间短的影响,不同PPI对不同人种,不同PPI对国人推荐剂量下的氯吡格雷的抗血小板疗效是否有显著影响尚待进一步大规模、多中心的前瞻性临床研究及基础研究予以明确。
[1] Kerner A, Gruberg L, Kapeliovich M, et al. Late stent thrombosis after implantation of a sirolimus-eluting stent[J]. Catheter Cardiovasc Interv, 2003, 60: 505-508.
[2] Ong AT, McFadden EP, Regar E, et al. Late angiographic stent thrombosis (LAST) events with drug-eluting stents[J]. J Am Coll Cardiol, 2005, 45: 2088-2092.
[3] Pfisterer M, Brunner-La Rocca HP, Buser PT, et al. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents: an observational study of drug-eluting versus bare-metal stents[J]. J Am Coll Cardiol, 2006, 48: 2584-2591.
[4] Smith SC Jr, Feldman TE, Hirshfeld JW Jr, et al. ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention-summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/SCAI Writing Committee to Update the 2001 Guidelines for Percutaneous Coronary Intervention) [J]. J Am Coll Cardiol, 2006, 113:e166-286.
[5] Hallas J, Dall M, Andries A, et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study[J]. BMJ, 2006, 333: 726.
[6] Gilard M, Arnaud B, Le Gal G, et al. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin[J]. J Thromb Haemost, 2006, 4: 2508-2509.
[7] Li XQ, Andersson TB, Ahlström M, et al. Comparison of inhibitory effects of the proton pump-inhibiting drugs omeprazole, esomeprazole, lansoprazole, pantoprazole, and rabeprazole on human cytochrome P450 activities[J]. Drug Metab Dispos, 2004, 32: 821-827.
[8] Task Force for Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of European Society of Cardiology, Bassand JP, Hamm CW, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes[J]. Eur Heart J, 2007, 28: 1598-1660.
[9] Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation[J]. Circulation, 2006, 113: e463-654.
[10] Bhatt DL, Scheiman J, Abraham NS, et al. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents[J]. J Am Coll Cardiol, 2008, 52: 1502-1517.
[11] Kim KA, Park PW, Hong SJ, et al. The effect of CYP2C19 polymorphism on the pharmacokinetics and pharmacodynamics of clopidogrel: a possible mechanism for clopidogrel resistance [J]. Clin Pharmacol Ther, 2008, 84: 236-242.
[12] Lau WC, Gurbel PA. The drug-drug interaction between proton pump inhibitors and clopidogrel[J]. CMAJ, 2009, 180: 699-700.
[13] Gilard M, Arnaud B, Cornily JC, et al. Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole CLopidogrel Aspirin) study[J]. J Am Coll Cardiol, 2008, 51: 256-260.
[14] Siller-Matula JM, Spiel AO, Lang IM, et al. Effects of pantoprazole and esomeprazole on platelet inhibition by clopidogrel[J]. Am Heart J, 2009, 157: 148.e1-5.
[15] Ho PM, Maddox TM, Wang L, et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome[J]. JAMA, 2009, 301: 937-944.
(本文编辑:谭潇)
·读者·作者·编者·
心血管专业指南网址
http://www.acc.org/qualityandscience/clinical/statements.htm[ACC指南全链接]
http:www.escardio.org/scinfo/guidelines.htm [欧洲心脏病学会(ESC)指南]
http://www.nhlbi.nih.gov/guidelines/index.htm [美国国家心肺和血液研究院(NHLBI)指南]
http://www.mja.com.au/public/guides/guides.html [澳大利亚医学杂志(MJA)指南大全]
http://www.sign.ac.uk/guidelines/published/ [苏格兰联合指南网(SIGN)]
http://www.vh.org/Providers/ClinGuide/CGType.html (虚拟医院指南)
http://www.hfsa.org/hf_guidelines.asp [美国心衰协会(HFSA)指南]
http://www.cdc.gov/nccdphp/dash/guidelines/ [美国疾病预防控制中心(CDC)指南]
Effect of different proton pump inhibitors on antiplatelet efficacy of clopidogrel in patients with non-ST segment elevation acute coronary syndrome
LaiShaobin,DengBin,SuLiangxian,ZhaoDonghua,ZhengXiaodan,RenHuihuan,HuangJianxia.
DepartmentofCardiology,CriticalCareUnit,theFirstPeople′sHospitalofZhaoqing,Zhaoqing526040,China
LaiShaobin,Email:doctorlaii@139.com
Objective The study sought to compare the effect of different proton pump inhibitors (PPI) on antiplatelet efficacy of clopidogrel in patients with non-ST segment elevation acute coronary syndrome (NSTEACS). Methods A prospective, randomized clinical trial was studied. One hundred and forty-five patients with NSTEACS after drug eluting stent implantation were recruited in the study. Patients were assigned into group A and B randomly, and given standard medical therapy (clopidogrel, aspirin, low molecular weight heparin, nitrates, statins and other routine treatments). Patients in group A (n=72) were treated with pantoprazole, while with omeprazole in group B (n=73). We examined the one-year incidences of gastrointestinal bleedings and major adverse cardiac events(MACE) including all cause mortality, cardiovascular death, stroke, hospitalization due to angina pectoris or heart failure, and revascularization. Results The rates of cardiovascular events between group A and B was of no significant difference (P>0.05): all cause mortality (6.9%vs. 5.5%); cardiovascular death (4.2%vs. 5.5%); hospitalization due to angina pectoris or heart failure (16.6%vs. 15.0%); revascularization (11.1%vs. 12.3% ). There was no significant difference between the two groups in gastrointestinal bleeding (5.6%vs. 5.5%,P>0.05). Conclusions The effect of two major kinds of PPI on antiplatelet efficacy of clopidogrel has no significantly different in patients with NSTEACS.
Proton pump inhibitors; Platelet aggregation inhibitors; Acute coronary syndrome;Clopidogrel
10.3969/j.issn.1007-5410.2015.03.002
526040 肇庆市第一人民医院心血管内科重症监护室
赖绍斌,电子信箱:doctorlaii@139.com
2014-10-08)