非心脏手术围术期患者心血管事件的危险因素分析
2015-03-06赵慧颖陈红安友仲任景怡宋俊贤赵秀娟朱凤雪
赵慧颖 陈红 安友仲 任景怡 宋俊贤 赵秀娟 朱凤雪
·临床研究·
非心脏手术围术期患者心血管事件的危险因素分析
赵慧颖 陈红 安友仲 任景怡 宋俊贤 赵秀娟 朱凤雪
目的 评估非心脏手术患者围术期主要心血管事件的独立危险因素。方法 连续观察2012年12月1日至2013年11月30日入住我院外科重症监护病房年龄>18岁的非心脏手术患者,观察终点为术后主要心血管事件,并根据此终点将患者分为事件组和无事件组。记录并比较两组患者的临床特征和手术相关指标。通过多因素回归分析总结出心血管不良事件的独立危险因素。结果 共入选1 286例患者,其中事件组63例(4.9%);相继对两组进行单因素比较和多因素回归分析后发现年龄(OR=1.030)、冠心病病史(OR=2.392)、心力衰竭病史(OR=7.333)、糖尿病病史(OR=1.995)、脑梗死病史(OR=2.230)、肾功能不全病史(OR=4.468)、高危手术(OR=10.716)、术中出血量(OR=1.022)和急诊手术(OR=2.583)为术后发生主要心血管事件的独立危险因素(均为P<0.05)。结论 非心脏手术围术期主要心血管事件的独立危险因素包括:年龄、冠心病病史、心力衰竭病史、糖尿病病史、脑梗死病史、肾功能不全病史、手术类型、术中出血量和急诊手术。
非心脏手术; 围术期; 心血管事件; 危险因素
心血管不良事件是非心脏手术围术期常见的并发症,并是导致死亡的主要因素之一[1]。因此,心血管风险评估对于围术期心血管并发症的预警及预防具有至关重要的作用。Lee等[2]提出的改良心脏风险指数(revised cardiac risk index,RCRI)是目前临床常用的评分,并被2009年欧洲心脏病学会(european society of cardiology,ESC)关于非心脏手术围术期心血管风险评估及处理的指南所推荐[3]。但该评分并不全面,近年来有一些研究对该评分的有效性提出了质疑[4-5]。因此,我们设计本研究,旨在评估非心脏手术患者围术期主要心血管事件的独立危险因素,以达到较准确地早期预警、及时干预和改善预后的目的。
1 对象和方法
1.1 研究对象
1.1.1 入选标准 连续入选2012年12月1日至2013年11月30日入住北京大学人民医院外科重症监护病房(intensive care unit,ICU)的非心脏手术患者。
1.1.2 排除标准 (1)年龄<18岁;(2)妊娠及妊娠相关手术;(3)资料不齐全者。
1.2 研究指标
从病历资料查阅中获得以下指标信息:
1.2.1 临床特征 年龄、性别、身高、体重、体质指数(body mass index,BMI)、冠状动脉粥样硬化性心脏病(冠心病)病史、心力衰竭病史、脑血管病病史(脑梗死和脑出血病史)、糖尿病病史、高血压病史和肾功能不全病史。
1.2.2 化验及检查指标 血浆肌钙蛋白I(troponin I,TnI)水平、肌酐清除率、心电图检查和超声心动图检查。
1.2.3 手术相关指标 手术类型、是否为急诊手术、美国麻醉医师协会(american society of anesthesiology,ASA)麻醉分级、手术时间、术中出血量。
1.3 研究终点
研究终点为围术期主要心血管事件,包括急性心肌梗死、急性心力衰竭、恶性心律失常(心室颤动、室性心动过速和非致命性心脏停搏)和心原性死亡,术后30 d内出现以上4项中的任意1项定义为出现心血管事件,并据此将患者分为两组:事件组和无事件组。
1.4 相关定义及解释
肾功能不全定义为肌酐清除率<60 ml/min[3,6]。肌酐清除率,采用Cockcroft-Gaultformula法计算,即血肌酐清除率=[(140-年龄)×体重(kg)]/[72×血肌酐(mg/dl)],女性×0.85,血肌酐取自术前最近1次血清肌酐水平。
手术类型:根据2009年欧洲ESC指南将手术类型分为低、中和高危3种类型[3]:(1)高危手术:指大血管手术和外周血管手术;(2)中危手术:包括血管外科其他手术、腹腔内手术、胸腔内手术、骨科大手术(包括脊柱、骨肿瘤、髋关节手术和膝关节置换术)、神经外科手术、头颈部手术和泌尿外科大手术(肾切除术、输尿管切除术、膀胱切除术、腹膜后肿物切除术、前列腺切除术);(3)低危手术:包括乳腺、眼科、妇科、骨科小手术、泌尿外科小手术和其他小手术。
ASA麻醉分级:1级:体格健康,发育营养良好,各器官功能正常;2级:除外科疾病外,有轻度并存病,功能代偿健全;3级:并存病情严重,体力活动受限,但尚能应付日常活动;4级:并存病严重,丧失日常活动能力,经常面临生命威胁;5级:无论手术与否,生命难以维持24 h的濒死患者。
急性心肌梗死定义为血清TnI水平升高且至少具备下列条件之一:(1)缺血性症状;(2)新出现或怀疑新出现的心电图明显ST-T改变或新出现的左束支传导阻滞;(3)心电图出现病理性Q 波;(4)影像学检查证实有新的存活心肌的丢失或新出现的局部室壁运动异常;(5)造影或尸检证实冠脉内血栓形成[7]。
心原性死亡定义为除外明确的非心原性因素所致的死亡[8]。
心力衰竭定义根据2013年美国心力衰竭管理指南[9]。
1.5 统计学方法

2 结果
2.1 患者基线资料
2012年12月1日至2013年11月30日入住北京大学人民医院外科ICU的非心脏手术患者共1358例,经排除标准除外患者72例,最终入选患者1286例。平均年龄(63.4±15.2)岁,男性患者661例(51.4%)。有冠心病病史、心力衰竭病史、脑血管病病史、糖尿病病史、肾功能不全病史和高血压病史的患者分别占13.1%、1.2%、9.3%、17.0%、4.0%和45.8%,见表1。
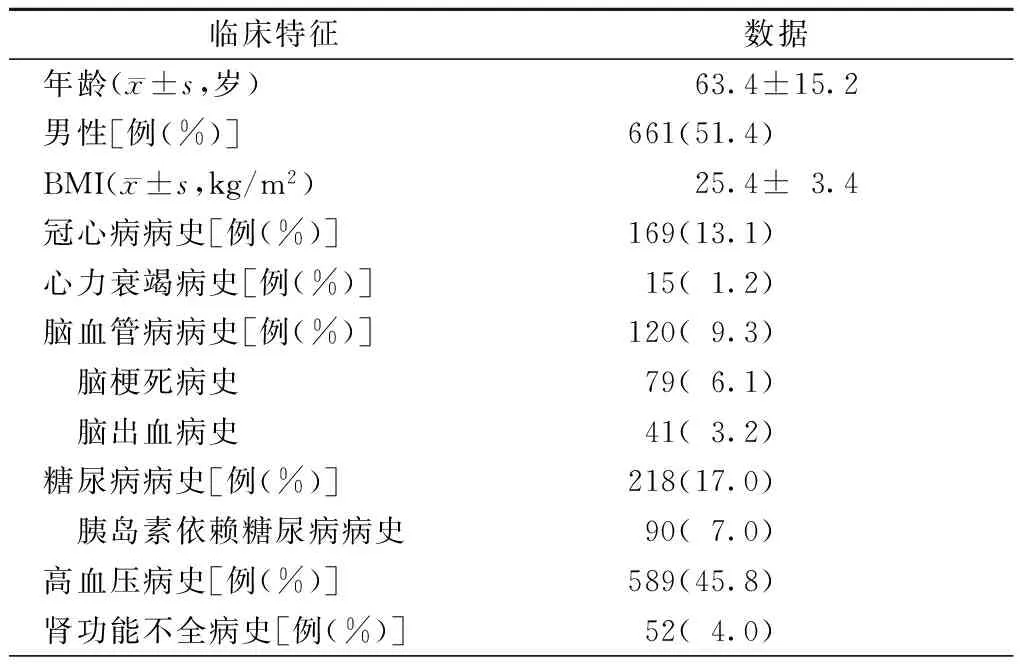
表1 患者临床特征
在所有手术类型中,腹腔内手术所占比例最高为42.4%,其次为骨科大手术占16.2%(表2),急诊手术所占比例为5.8%,中位出血量为400(200,1 000)ml,中位手术时间为5(4,6)h,ASA分级2级所占比例最多为74.4%(表3)。
2.2 终点事件发生率
共有63例(4.9%)患者术后发生了主要心血管事件(事件组),其中急性心肌梗死35例(55.6%),急性心力衰竭38例(60.3%),心室颤动5例(7.9%),室性心动过速3例(4.8%),非致命性心脏停搏2例(3.2%),心原性死亡16例(25.4%)。
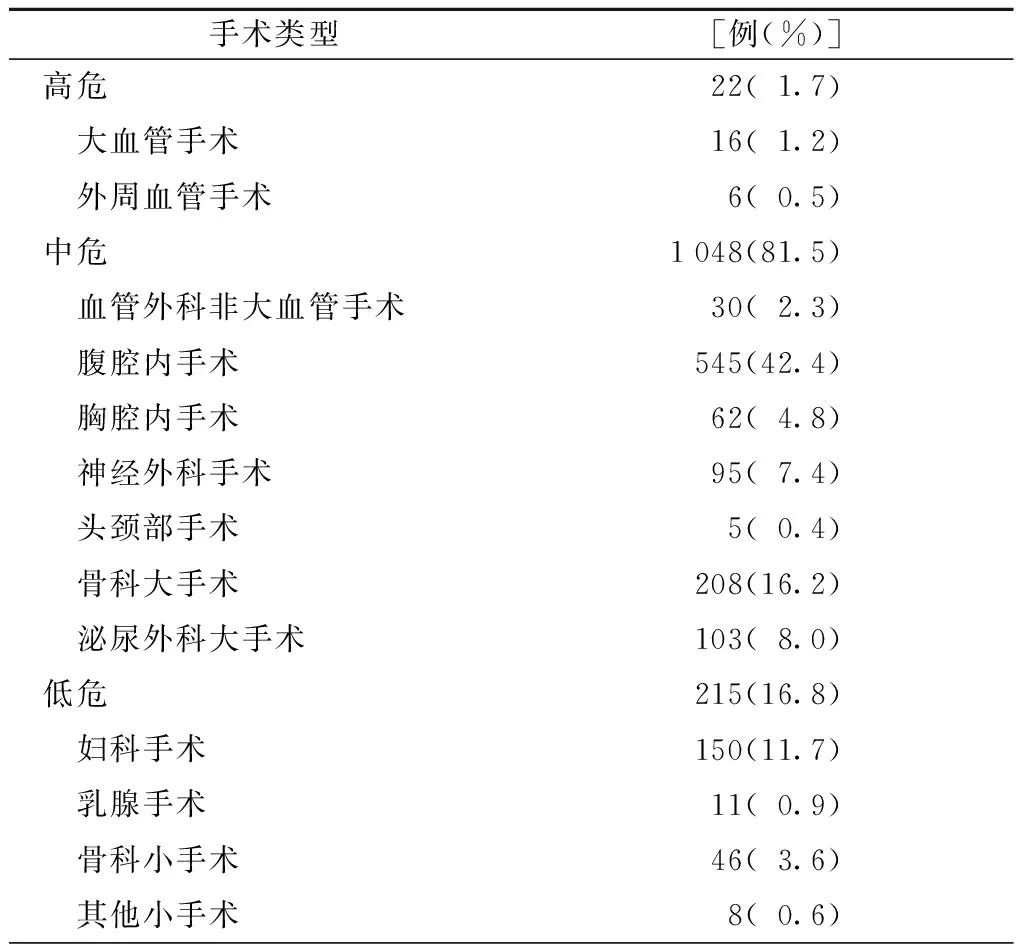
表2 患者手术类型

表3 患者其他手术相关指标
2.3 事件组和无事件组的各种危险因素的单因素比较
两组患者的年龄、冠心病病史、心力衰竭病史、糖尿病病史、胰岛素依赖的糖尿病病史、脑梗死病史、高血压病史和肾功能不全病史差异均有统计学意义(均为P<0.05),而性别、BMI、脑血管病病史和脑出血病史的差异无统计学意义。高危手术、ASA分级≥3级、术中出血量及急诊手术在两组间的差异具有统计学意义,而中危手术、低危手术和手术时间在两组间的差异无统计学意义(表4、5)。
2.4 多因素回归分析
将上述两组间差异有统计学意义的各危险因素进行Logistic回归分析,结果显示年龄、冠心病病史、心力衰竭病史、糖尿病病史、脑梗死病史、肾功能不全病史、高危手术、术中出血量和急诊手术为围术期发生主要心血管事件的独立危险因素(表6)。

表4 事件组和无事件组患者临床特征的单因素比较

表5 事件组和无事件组手术相关指标的单因素比较

表6 两组患者危险因素的Logistic回归分析结果
3 讨论
每年全世界范围内有超过2亿患者接受非心脏手术,尽管这些手术能为患者带来很多益处,但同样伴随着很多风险,甚至是死亡,据统计每年接受非心脏手术的患者术后30 d死亡的人数超过100万人[1, 10-11],心血管不良事件是非心脏手术围术期常见的并发症及死亡原因,以往文献报道发生率约为1%~3%[2-3, 12],本研究入选人群的发生率为4.9%,高于其他研究,分析原因可能与以下因素有关:(1)我们的患者为入住ICU的重症手术患者;(2)所有入选患者均进行了心电图及血浆TnI水平筛查,因此发现心血管并发症的几率更高。
心血管不良事件能显著影响患者的预后,评估非心脏手术围术期心血管风险具有非常重要的意义。目前应用较广泛的是RCRI评分,但近期的一些研究对该评分的预测价值提出了质疑,Boersma等[13]对非心脏手术患者的研究发现,RCRI评分预测心血管死亡的ROC曲线下面积为0.63,而当将手术分为低危、低中危、高中危和高危,再加上年龄因素后,ROC曲线下面积为0.85,明显优于RCRI评分。Ford等[14]的荟萃分析同样发现,RCRI评分对混合的非心脏手术围术期心血管并发症具有一定的预测价值,而对血管手术围术期心血管并发症和全因死亡的预测价值相对较差。本研究所得9项独立危险因素同样与RCRI评分不尽相同,其中冠心病病史和心力衰竭病史与RCRI评分中的2项相同,糖尿病病史、脑梗死病史、肾功能不全病史和高危手术(大血管和外周动脉血管手术)4项在RCRI评分中的胰岛素依赖的糖尿病病史、脑血管病史、术前血肌酐>2 mg/dl和高危手术(胸腔内、腹腔内和腹股沟以上的血管手术)4项基础上有所改进,另外,比RCRI评分多了年龄、术中出血量和急诊手术3项。
年龄在本研究中为心血管事件的独立危险因素,随着人口老龄化和人均寿命延长,接受手术的患者中老年人的比例在增加,并且老年人具有更高的心血管并发症和心血管危险因素发生率[15],因此年龄也是非心脏手术围术期心血管事件的危险因素之一。Polanczyk等[16]连续前瞻性观察了4 315例年龄≥50岁的接受非心脏大手术的患者,结果发现随着年龄的增加术后并发症的发生率、死亡率都在增加,且住院时间也明显延长。Kheterpal等[12]的研究也同样提出,年龄是非心脏手术围术期主要心血管并发症的独立危险因素。
关于手术风险的界定,RCRI评分定义的高危手术过于简单,随着手术和麻醉技术的飞速发展,该定义方式就显得不够精细,2009年[3]和2014年[17]ESC的指南将手术分为高、中和低危3组。关于急诊手术,虽然心血管风险评估的结果并不能影响手术的进行(不接受急诊手术会对患者有致命性损害),但同样需要进行术前心血管风险评估,是因为对于高风险的患者可以尽可能采取创伤小的手术方式及术后早期进行心血管方面的干预以改善预后。另一方面,急诊手术本身又是围术期心血管并发症的危险因素之一[5],因为急诊手术常伴有极其严重的循环不稳定、炎症反应、凝血功能紊乱等容易导致心血管并发症的因素。另外,围术期心血管风险还与术中循环状态、出血量和手术时间等因素有一定相关性。Kheterpal等[12]的研究就发现,急诊手术、手术时间≥3.8 h和术中输血≥1袋为围术期心脏不良事件的独立危险因素,并且发生心脏不良事件的患者更多出现术中低血压状态,我们的研究同样发现术中出血量为独立危险因素。因此我们认为,急诊手术、血管手术及术中出血量为评价手术风险的综合因素。
我们的结果还显示脑血管病史不是独立危险因素,对数据进行亚组分析后发现脑梗死为心血管事件的独立危险因素,而脑出血在两组之间差异无统计学意义,分析原因脑梗死多与动脉粥样硬化有关,而脑出血多因高血压、动脉畸形甚至脑动脉瘤所致,与全身的动脉粥样硬化相关性不大,因此我们认为脑梗死对心血管风险的预警作用要优于脑出血。
对于肾功能不全病史的评价,以往研究的诊断标准不尽相同,Lee等[2]的研究将肾脏功能不全定义为血肌酐水平大于2 mg/dl(177 μmol/L),也有研究将肾功能不全定义为血肌酐水平大于1.8 mg/dl。然而,对于肾功能的评价,肌酐清除率的准确性要明显高于血肌酐绝对值[18]。目前临床应用较广泛并且比较易于计算和测定的方法是Cockcroft-Gaultformula法,该方法除了血肌酐水平,还涵盖了年龄、体重和性别3个因素,我们的研究就应用该方法将术前肾功能不全病史定义为肌酐清除率<60 ml/min[6],结果同样发现肾功能不全病史为围术期心血管事件的独立危险因素。
总之,非心脏手术围术期风险评估对于心血管不良事件的预警具有至关重要的作用,本研究发现了9项独立危险因素。本研究的特点为所有研究对象均为术后入住ICU的患者,对并发症进行了更为密切的监测和记录,具有更高的准确性。因此,本研究所得独立危险因素对围术期心血管事件的评估预测具有更高的价值。但本研究的不足之处为单中心研究,未来还需要一些更大规模、多中心的研究来制定出对我国人群更有价值的风险评估系统。
[1] Pearse RM, Moreno RP, Bauer P, et al. Mortality after surgery in Europe: a 7 day cohort study[J]. Lancet, 2012, 380: 1059-1065.
[2] Lee TH, Marcantonio ER, Mangione CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery[J]. Circulation, 1999, 100: 1043-1049.
[3] Poldermans D, Bax JJ, Boersma E, et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery[J]. Eur Heart J, 2009, 30: 2769-2812.
[4] Bertges DJ, Goodney PP, Zhao Y, et al. The Vascular Study Group of New England Cardiac Risk Index (VSG-CRI) predicts cardiac complications more accurately than the Revised Cardiac Risk Index in vascular surgery patients[J]. J Vasc Surg, 2010, 52: 674-683.
[5] Rao JY, Yeriswamy MC, Santhosh MJ, et al. A look into Lee's score: peri-operative cardiovascular risk assessment in non-cardiac surgeries-usefulness of revised cardiac risk index[J]. Indian Heart J, 2012, 64: 134-138.
[6] Levey AS, Coresh J. Chronic kidney disease[J]. Lancet, 2012, 379: 165-180.
[7] Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction[J]. Circulation, 2012, 126: 2020-2035.
[8] Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions[J]. Circulation, 2007, 115: 2344-2351.
[9] Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines[J]. Circulation, 2013, 128: e240-e327.
[10] Weiser TG, Regenbogen SE, Thompson KD, et al. An estimation of the global volume of surgery: a modelling strategy based on available data[J]. Lancet, 2008, 372: 139-144.
[11] Devereaux PJ, Yang H, Yusuf S, et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial[J]. Lancet, 2008, 371: 1839-1847.
[12] Kheterpal S, O′Reilly M, Englesbe MJ, et al. Preoperative and intraoperative predictors of cardiac adverse events after general, vascular, and urological surgery[J]. Anesthesiology, 2009, 110: 58-66.
[13] Boersma E, Kertai MD, Schouten O, et al. Perioperative cardiovascular mortality in noncardiac surgery: validation of the Lee cardiac risk index[J]. Am J Med, 2005, 118: 1134-1141.
[14] Ford MK, Beattie WS, Wijeysundera DN. Systematic review: prediction of perioperative cardiac complications and mortality by the revised cardiac risk index[J]. Ann Intern Med, 2010, 152: 26-35.
[15] Carroll K, Majeed A, Firth C, et al. Prevalence and management of coronary heart disease in primary care: population-based cross-sectional study using a disease register[J]. J Public Health Med, 2003, 25: 29-35.
[16] Polanczyk CA, Marcantonio E, Goldman L, et al. Impact of age on perioperative complications and length of stay in patients undergoing noncardiac surgery[J]. Ann Intern Med, 2001, 134: 637-643.
[17] Kristensen SD, Knuuti J, Saraste A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA)[J]. Eur Heart J, 2014, 35: 2383-2431.
[18] Wijeysundera DN, Karkouti K, Beattie WS, et al. Improving the identification of patients at risk of postoperative renal failure after cardiac surgery[J]. Anesthesiology, 2006, 104: 65-72.
(本文编辑:谭潇)
Analysis of perioperative cardiovascular risk factors among non-cardiac surgical patients
ZhaoHuiying1,ChenHong2,AnYouzhong1,RenJingyi2,SongJunxian2,ZhaoXiujuan1,ZhuFengxue
1. 1DepartmentofIntensiveCareUnit,PekingUniversityPeople'sHospital,Beijing100044,China; 2DepartmentofCardiovascularMedicine
ChenHong,Email:chenhong0418@aliyun.com
Objective To evaluate the independent risk factors of perioperative major cardiovascular events among non-cardiac surgical patients. Methods A retrospective study in a surgical ICU in teaching hospital. Consecutive adult (above 18 years old) non-cardiac surgical patients from December 1, 2012 to November 30, 2013 were studied. The endpoint was the main postoperative cardiovascular events, and accordingly, the patients were divided into event group and non-event group. Clinical data and operative data were recorded and compared between the two groups. The independent risk factors of cardiovascular adverse events were summarized by regression analysis. Results The 1 286 patients, including 63 cases (4.9%) of event group were studied. Through the single factor comparative analysis and multi-factors regression analysis, we found that age (OR=1.030), the history of coronary heart disease (OR=2.392), heart failure (OR=7.333), diabetes (OR=1.995), cerebral infarction (OR=2.230), renal failure (OR=4.468), high risk operation (OR=10.716), blood loss during operation (OR=1.022) as well as emergency operation (OR=2.583) were the independent risk factors of major cardiovascular events (allP<0.05). The RCRI score was statistically different between two groups (P=0.000). Conclusions The independent risk factors of perioperative major cardiovascular events include age, the history of coronary heart disease, heart failure, diabetes, cerebral infarction, renal failure, high risk operation, blood loss during operation as well as emergency operation.
Non-cardiac surgery; Peri- operation; Cardiovascular events; Risk factors
10.3969/j.issn.1007-5410.2015.03.004
国家临床重点专科建设基金项目(2010)
100044 北京大学人民医院重症医学科(赵慧颖、安友仲、赵秀娟、朱凤雪),心血管内科(陈红、任景怡、宋俊贤)
陈红,电子信箱:chenhong0418@aliyun.com
2015-04-08)
ThisworkwassupportedbyagrantfromConstructionFundProjectofNationalClinicalMajorSpecialty.