原发性小肠肿瘤47例临床分析
2015-03-05王艳丽
王艳丽
(重庆市第三人民医院消化内科 400014)
小肠占胃肠道总长度的75%,拥有90%的吸收面积,但由于其为碱性环境,具有蠕动快、细菌含量低而IgA 水平高等生理学特征[1],原发性小肠肿瘤发病率低,仅占整个胃肠道肿瘤的1%~3%[2],临床中易被忽略,导致漏诊、误诊。目前国内对小肠肿瘤的临床分析研究不多见,为进一步提高对小肠肿瘤临床特征、诊断及预后的了解,收集本院2005年8月至2013年7月收治的47例原发性小肠肿瘤患者的临床资料,并进行分析、总结。
1 资料与方法
1.1 一般资料 47例小肠肿瘤均经病理学证实,且排除由腹腔其他肿瘤如胃癌、结肠癌、胰腺癌等转移或直接浸润小肠者。其中间质瘤8例(采用美国国立卫生署制定的侵袭危险度进行病理分级[3]),非间质瘤中良性肿瘤6例,恶性肿瘤33例。
1.2 方法
1.2.1 诊断 6例良性肿瘤中3例术前经胃十二指肠镜及肠镜得到病理标本,其余3例则通过CT 或消化道钡餐发现存在小肠占位性病变;恶性肿瘤术前得到病理学诊断者有13例(12例为十二指肠腺癌,1例为回肠淋巴瘤),13例通过影像学方式发现存在小肠占位性病变,余下7例则通过手术明确诊断,其中2例术前误诊(1例球部腺癌术前诊断为十二指肠球部溃疡伴梗阻,1例为空肠腺癌术前诊断为粘连性肠梗阻);间质瘤中5例术前发现小肠存在占位性病变(1例通过胃镜发现,1例通过胶囊内镜发现,其余3例通过CT 发现),3例术中明确(其中2例术前误诊为妇科肿瘤)。
1.2.2 治疗及随访 良性肿瘤者及间质瘤患者均行手术切除病灶,间质瘤患者中术后有3 名患者服用伊马替尼治疗。33例恶性肿瘤患者中29例行手术治疗(6例为姑息性手术)。随访时间3~75个月。
1.3 统计学处理 采用SPSS16.0软件进行分析。偏态分布资料采用中位数表示;计数资料用百分比表示;生存率及生存时间采用Kaplan-Meier法比较;检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 病理类型及部位 6例良性肿瘤中3例腺瘤(2例来源于十二指肠,1例来源于回肠);1例平滑肌瘤(来源于空肠);1例粘液囊肿(来源于十二指肠);1例脂肪瘤(来源于空肠)。33例恶性肿瘤中29例腺癌(22例来源于十二指肠,5例来源于空肠,2例来源于回肠);2例淋巴瘤(来源于回肠);1例平滑肌瘤(来源于回肠);1例类癌(来源于空肠)。间质瘤共8例,1例低度恶性(来源于空肠);3 例中度恶性(1 例来源于十二指肠,2例来源于空肠);4 例高度恶性(1 例来源于空肠,3 例来源于回肠)。
2.2 临床特点 47例原发性小肠肿瘤中男26例,女21例,男女比例1.24∶1.00,年龄40~84岁,中位年龄63岁。良性肿瘤及恶性肿瘤中男性患者多于女性患者,其中位发病年龄分别为54岁、67岁,间质瘤以女性患者为主,中位发病年龄为52岁。良性肿瘤的主要临床表现为腹痛、腹胀,恶性肿瘤的主要临床表现为贫血,贫血程度轻重不一,其次为腹痛、消化道梗阻及黄疸,而间质瘤的主要临床表现为腹痛及腹部包块。见表1。
2.3 诊断方法阳性发现率 47例原发性小肠肿瘤术前主要诊断方式包括胃镜、结肠镜、十二指肠镜、消化道钡餐及CT,不同病变部位检查方法阳性发现率见表2。研究中43例患者行CT 检查,术前阳性发现率为65.1%(28/43)。
2.4 随访 6例良性肿瘤随访16~75个月,1例因其他疾病死亡,其余5例均健在,其中1例回肠腺瘤患者于术后10个月检查发现结肠腺瘤。33例恶性肿瘤患者中1例淋巴瘤失访;另1例淋巴瘤死亡,生存期为7个月;1例类癌失访;1例平滑肌肉瘤术后随访29个月仍健在。29例小肠腺癌患者中3例失访,余下26例患者随访3~65个月,1、2、3、5年生存率分别为67.4%、42.4%、29.4%、22.8%,中位生存期为20.3个月,见图1。间质瘤患者中失访1例,余下7例中3例服用伊马替尼治疗,随访9~21个月,无复发及死亡,其他4例患者术后未服用药物治疗,随访8~42个月,2例术后复发,1例术后14个月死亡,1例至随访结束无死亡及复发。
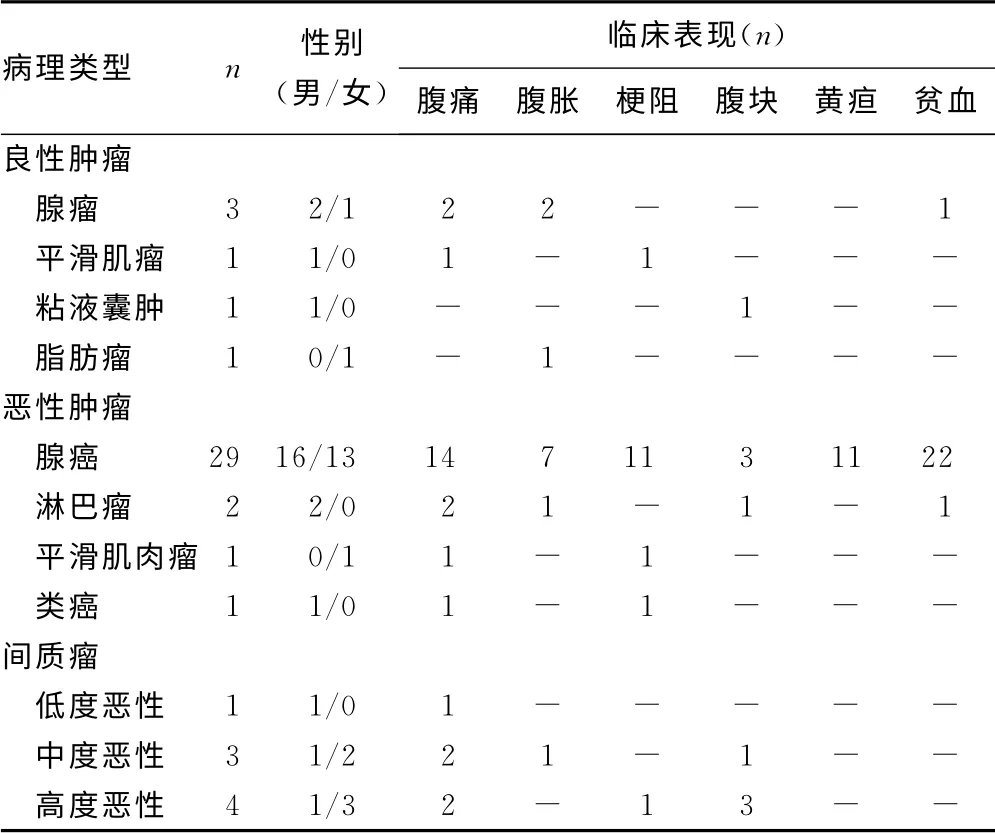
表1 47例原发性小肠肿瘤临床特点
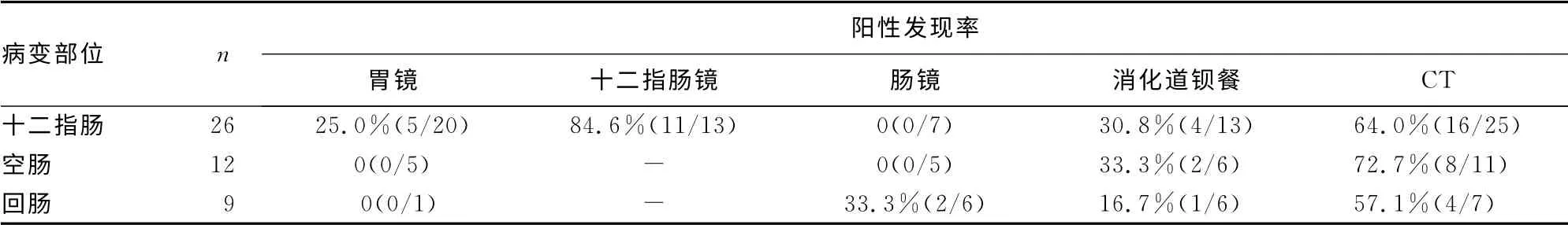
表2 主要检查方法阳性发现率
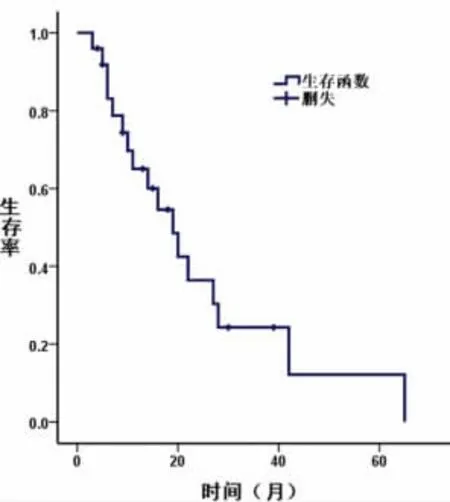
图1 26例小肠腺癌患者生存曲线
3 讨 论
本组47例原发性小肠肿瘤中55.4%(26/47)位于十二指肠,25.5%(12/47)位于空肠,19.1%(9/47)位于回肠。良性肿瘤占12.8%(6/47),病理以腺瘤为主(50.0%,3/6)。恶性肿瘤以腺癌为主(87.7%,29/33),不同于国外文献中以类癌为主的病理分类[4],考虑与地域、人种等因素相关。腺癌的好发部位为十二指肠,其次为空肠,回肠,与国内外文献相一致[5-7]。虽然原发性小肠肿瘤临床表现无特异性,但与小肠良性肿瘤比较,小肠恶性肿瘤以贫血为主要表现,说明对于原发性小肠肿瘤而言,贫血是临床考虑恶性病变的一条重要线索,而黄疸则多提示病变部位位于十二指肠乳头附近。鉴于间质瘤存在潜在恶性,且具有自身的病理分级和临床分期标准,故将间质瘤单独分组进行分析,这一点有别于国内其他文献[7]。47例小肠肿瘤中间质瘤占17%(8/47),有半数症状表现为腹部包块,其基本临床特点与国内外文献报道一致[8-9]。
研究中CT 检查术前阳性发现率为65.1%(28/43),虽低于十二指肠镜的阳性发现率(84.6%),但却有助于发现十二指肠水平段及空回肠等部位的病变,并有助于了解肿瘤与周围组织的情况,协助肿瘤分期,因此CT 是小肠肿瘤术前诊断的重要方式之一。Islam 等[10]研究也指出对于表现为肠道梗阻的小肠肿瘤疑诊患者,CT 应为首选检查方式。而对于存在消化道出血的疑诊患者可首选胶囊内镜。临床中,由于医师对小肠肿瘤认识不足,易出现误诊。本组研究中的4 例误诊病例说明;(1)反复发作的球部溃疡不能完全排除溃疡癌变;(2)内科保守治疗不佳的“粘连性肠梗阻”需警惕合并小肠肿瘤;(3)发现盆腔包块的女性患者有必要行腹部CT 协助明确包块来源。
手术切除是惟一可能治愈小肠肿瘤的方法。小肠良性肿瘤手术切除预后良好,本组6例小肠良性肿瘤患者除1例死于其他疾病外,其余均健康存活。而对于恶性肿瘤患者治疗首选根治性切除术及淋巴结区域清扫术,若无法根治性切除,则行姑息性手术以减少肿瘤负荷,提高患者生活质量[11]。恶性肿瘤的预后差,本研究中对26例小肠腺癌进行随访,5年生存率为22.8%,符合国外文献报道的14%~33%的5年生存率[12]。小肠腺癌的预后与其临床分期、淋巴结侵袭数目、病变位于十二指肠、男性及肿瘤分化程度等因素相关[13-14]。由于间质瘤很少发生淋巴结转移,故其标准治疗方案为根治性切除,而不需要进行常规淋巴结清扫[11]。其预后不良的因素包括肿瘤直径大于5cm,高危险程度,不完全切除或肿瘤破裂,核分裂大于5/50HPF,肿瘤出现凝固性坏死等。伊马替尼是选择性酪氨酸激酶受体抑制剂,推荐用于间质瘤术前或术后辅助治疗,同时还是复发转移或无法切除的间质瘤的一线用药[15]。在本组研究中,随访的7例小肠间质瘤患者中服用伊马替尼治疗者无复发及死亡,术后生存质量高于未服药者,但由于例数少,未能进一步行统计学分析。
原发性小肠肿瘤发病率低,临床表现无特异性,临床医师需引起重视。小肠肿瘤以恶性者为主,采取有效的检查手段尽早发现病灶并行手术切除是治疗的关键。靶向药物能有效改善间质瘤患者的预后,但其作为辅助治疗的确切剂量和确切期限等问题尚未解决,且其耐药问题亦逐渐显现,有待临床工作者的进一步探索。
[1] Anzidei M,Napoli A,Zini C,et al.Malignant tumours of the small intestine:a review of histopathology,multidetector CT and MRI aspects[J].Br J Radiol,2011,84(14):677-690.
[2] Cheung DY,Choi MG.Current advance in small bowel tumors[J].Clin Endosc,2011,44(1):13-21.
[3] Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[4] Bilimoria KY,Bentrem DJ,Wayne JD,et al.Small bowel cancer in the United States changes in epidemiology,treatment,and survival over the last 20years[J].Ann Surg,2009,249(1):63-71.
[5] Schottenfeld D,Beebe-Dimmer JL,Vigneau FD.The epidemiology and pathogenesis of neoplasia in the small intestine[J].Ann Epidemiol,2009,19(1):58-69.
[6] Mclaughlin PD,Maher MM.Primary malignant diseases of the small intestine[J].AJR Am J Roentgenol,2013,201(1):W9-14.
[7] 徐佶,李金明,来代莉,等.原发性小肠肿瘤51例临床分析[J].复旦学报:医学版,2011,38(1):51-53,59.
[8] Roy SD,Khan D,De KK,et al.Spontaneous perforation of jejunal gastrintestinal stromal tumour(gist).Case report and review of literature[J].World J Emerg Surg,2012,7(1):37.
[9] 葛晓明,孙晓光,梁正.72例胃肠道间质瘤治疗的回顾性研究[J].中国癌症杂志,2011,21(3):217-219.
[10] Islam RS,Leighton JA,Pasha SF.Evaluation and management of small-bowel tumors in the era of deep enteroscopy[J].Gastrointest Endosc,2014,79(5):732-740.
[11] Barreto SG,Shukla PJ,Shrikhande SV.Small intestinal tumours[J].J Coll Physicians Surg Pak,2009,19(7):459-463.
[12] Aparicio T,Zaanan A,Svrcek M,et al.Small bowel adenocarcinoma:epidemiology,risk factors,diagnosis andtreatment[J].Dig Liver Dis,2014,46(2):97-104.
[13] Overman MJ,Hu CY,Wolff RA,et al.Prognostic value of lymph node evaluationin small bowel adenocarcinoma:analysis of the surveillance,epidemiology,and end results database[J].Cancer,2010,116(23):5374-5382.
[14] Halfdanarson TR,Mcwilliams RR,Donohue JH,et al.A single-institution experience with 491cases of small bowel adenocarcinoma[J].Am J Surg,2010,199(6):797-803.
[15] 石兵,梅浙川,武鹏宇.胃肠道间质瘤诊治进展[J].重庆医学,2011,40(21):2157-2160.
