FOXP1蛋白在弥漫性大B细胞淋巴瘤中的表达及预后意义*
2015-03-05张亚楠刘汉锋
张亚楠,刘汉锋
(广西医科大学第一附属医院西院肿瘤内科,南宁530007)
弥漫性大B细胞淋巴瘤(DLBCL)是一组在形态学、遗传学及病理特征上都具有明显异质性的非霍奇金淋巴瘤,此外,其异质性还表现在对治疗的反应不同。叉头框转录蛋白1(forkhead box protein1,FOXP1)是一种翼型螺旋亚结构域转录因子,是FOXP亚家族FOXP1~4转录因子成员,广泛表达于各种正常细胞和肿瘤组织中[1-5]。近年来,众多研究显示FOXP1在DLBCL中的表达与其预后相关,但研究结果尚有一定争议[6-7]。本研究旨在探讨FOXP1在DLBCL的表达情况及其与临床病理特征和经R-CHOP方案治疗的患者预后的关系。
1 资料与方法
1.1 一般资料 收集2008年1月至2013年12月本院病理科和广西医科大学附属肿瘤医院病理科存档的40例DLBCL石蜡标本,取材时均未接受手术及放化疗,且病理诊断结果均经2名病理医师确认。其中男24 例,女16 例;年龄17~78岁,中位年龄49岁,<60岁者31例,>60岁者9例;TNM 分期:Ⅰ期3例,Ⅱ期12例,Ⅲ期10例,Ⅳ期15例;结外侵犯者21例。确诊后所有病例均采用R-CHOP 方案(美罗华375 mg/m2静脉滴注,第1天;环磷酰胺750mg/m2静脉滴注,第1天;表柔比星50mg/m2静滴,第1天;长春新碱1.4mg/m2静滴,第1天;泼尼松100mg口服,第1~5天),21d为一个周期,化疗6~8个周期。另以40例反应性增生淋巴结组织作为对照。
1.2 随访 自确诊之日起,全部病例采用门诊复查或电话随访进行数据收集。随访截止时间为2014年4月30日,其中2例失访而不具备完整资料,随访率为95%,失访病例以失访日期作为死亡日期。随访过程中患者死于其他疾病或意外、未能随访到患者或其家属、在随访截止日期尚生存的患者为截尾数据,统计学上按删失计算。
1.3 免疫组织化学Envision法 常规石蜡切片(4μm )、脱蜡、水化后置于EDTA(pH9.0)中,高压锅进行高温高压抗原修复3min,冷却后用PBS冲洗3min×3,再将3%过氧化氢滴于组织上以阻断内源性过氧化物酶,常温15min后PBS冲洗3min×3,滴加一抗4 ℃孵育过夜;取出后置于37 ℃恒温箱中复温45min,PBS冲洗5min×3,滴加二抗37 ℃孵育30min,PBS冲洗5min×3;DAB 显色,显微镜下控制反应时间,苏木素衬染。以0.01mmol/L PBS代替一抗作阴性对照。浓缩型兔抗人FOXP1单克隆抗体(稀释度1∶300)购自美国Epitomics公司;鼠抗人CD10、Bcl-6和MUM-1单克隆抗体(不需稀释)、二抗试剂盒及DAB显色剂均购自福州迈新生物技术开发有限公司。
1.4 结果判定 阳性染色均为棕黄或棕褐色。FOXP1定位于细胞核,染色结果评判标准为:0 级,<10%肿瘤细胞核染色;1级,10%~30%肿瘤细胞核染色;2级,31%~50%肿瘤细胞核染色;3级,>50%肿瘤细胞核染色。评分0和1级判定为阴性(0~30%),2 和3 级判定为阳性(>30%)[8]。MUM-1、BCL-6定位于细胞核,CD10定位于细胞膜,结果判定均为:阳性细胞大于30%计为阳性(+),阳性细胞小于30%计为阴性(-)[9]。根据CD10、MUM-1和BCL-6将DLBCL分为生发中心型(germinal center B cell like,GCB)和非生发中心型(non-germinal center B cell like,non-GCB)两种类型,其中CD10(+)或(-)、BCL-6(+)、MUM-1(-)为GCB 型,CD10(-)、BCL-6(+)、MUM-1(+),CD10(-)、BCL-6(-)、MUM-1(+)或(-)为non-GCB型[9]。完全缓解(CR)是指所有的瘤块以及肿瘤的临床表现完全消失且持续至少1个月;无病生存期(PFS)指从确诊到疾病进展或死亡的时间;总生存期(OS)指从确诊到死亡或末次随访之间的时间。
1.5 统计学处理 采用SPSS16.0软件进行统计分析。计数资料用率表示,比较用χ2检验法,生存曲线用Log-Rank检验,生存分析用Kaplan-Meier法,多因素分析采用COX风险比例模型。以P<0.05为差异有统计学意义。
2 结 果
2.1 FOXP1在DLBCL 中的表达 FOXP1主要定位于细胞核,40 例DLBCL 组织中FOXP1阳性表达率为50.0%(20/40),见图1;根据CD10、MUM-1和BCL-6 3个指标的表达情况分类,14例为GCB型,26例为non-GCB型,其中GCB 型FOXP1的阳性表达率为14.3%(2/14),non-GCB 型FOXP1的阳性表达率为69.2%(18/26),差异有统 计学意义(χ2=10.898,P=0.01),可见FOXP1主要表达在non-GCB型DLBCL中。另40例反应性增生淋巴结组织的FOXP1阳性表达率为17.5%(7/40),与DLBCL 组绢比较差异有统计学意义(χ2=9.488,P=0.002),见图1。

图1 FOXP1在DLBCL中的表达(免Envision法染×400)
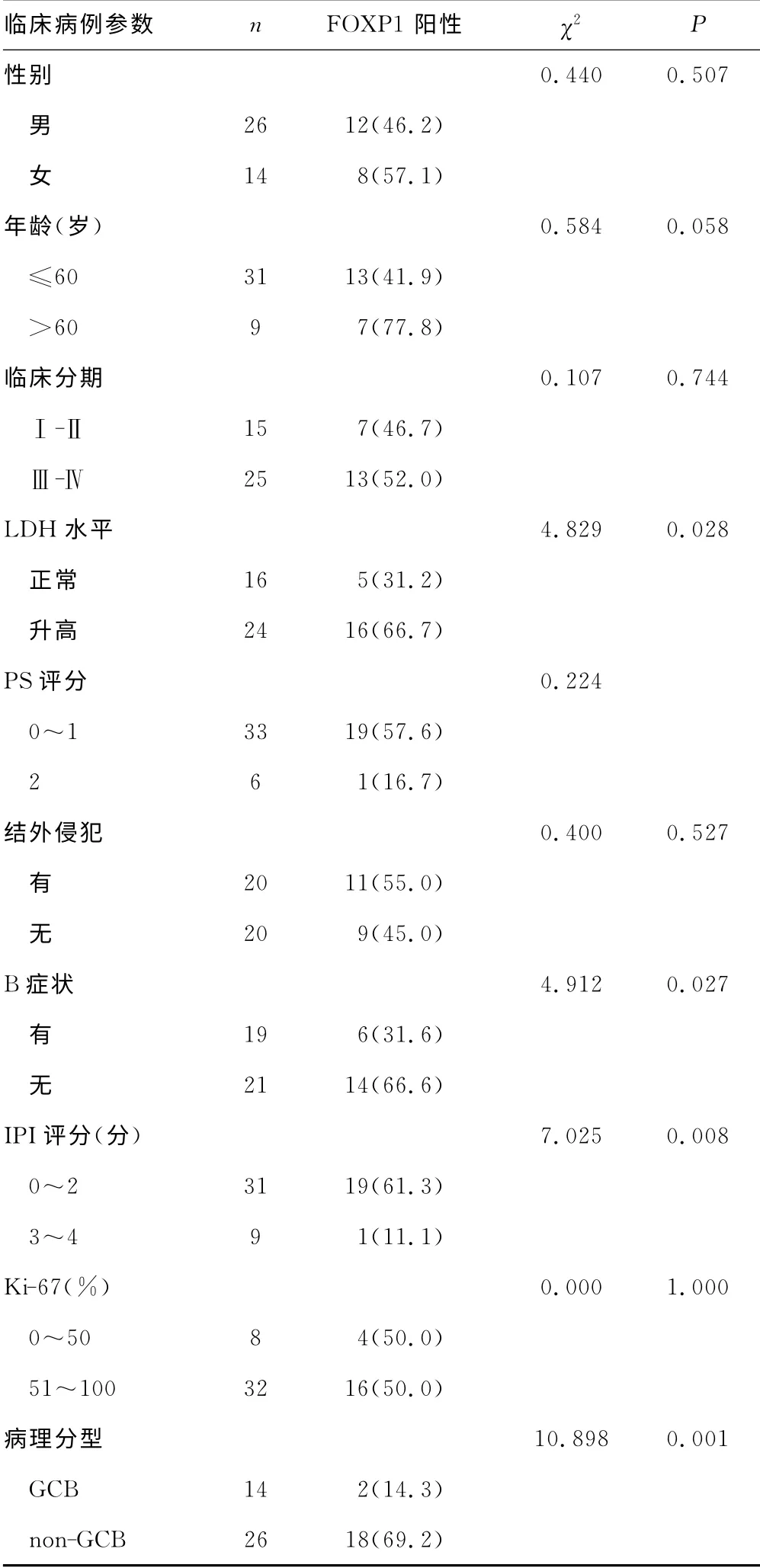
表1 FOXP1在DLBCL中的表达与临床病理 特征的关系[n(%)]
2.2 FOXP1在DLBCL 中的表达与临床病理特征的关系 FOXP1在DLBCL中的表达与乳酸脱氢酶(LDH)水平、B 症状、国际预后指数(IPI)评分、病理分型相关(P<0.05),与性别、年龄、临床分期、体力状况评分(PS)、结外侵犯及Ki-67无关(P>0.05),见表1。
2.3 FOXP1的表达与DLBCL的预后关系 40例DLBCL 患者的CR 为47.5%,2年PFS 为52.5%,2年OS 为82.5%。GCB型DLBCL的2年PFS明显优于non-GCB(χ2=4.579,P=0.032),而GCB与non-GCB的CR 与OS差异无统计学意义(P>0.05)。Kaplan-Meier分析显示FOXP1阳性表达者的生存期较阴性表达者短。FOXP1阳性表达者的中位无病生存期(PFS)和总生存期(OS)分别为19个月和28个月,而阴性表达者的PFS 和OS则分别为30个月和37个月,差异均有统计学意义(χ2=3.900,P=0.048;χ2=4.653,P=0.031)。单因素相关分析显示,临床分期、IPI评分、病理分型及FOXP1 的表达对患者的PFS和OS有显著影响(P<0.05);进一步将临床分期、IPI评分、病理分型及FOXP1 的表达纳入COX风险比例模型,结果表明临床分期[(RR=1.103,95%CI:0.002~2.740,P=0.001),(RR=0.984,95%CI:0.019~2.666,P=0.002)]和FOXP1 的 表 达[(RR=0.315,95%CI:0.035~0.965,P=0.042),(RR=0.385,95%CI:0.119~0.834,P=0.020)]是PFS和OS独立的预测因素,见图2。
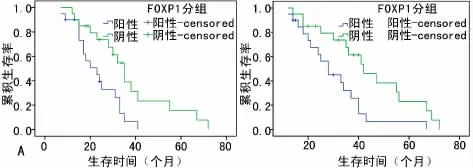
图2 FOXP1表达与PFS、OS的关系
3 讨 论
DLBCL是成人中最常见的非霍奇金淋巴瘤,在形态学、遗传学及免疫表型上都有明显的异质性,至今仍未确立明确的预后分子标记物和分子模型。近年来尽管在传统的以蒽环类为基础的CHOP方案中增加利妥昔单抗的应用使DLBCL 患者的预后得到明显的改善[10],但仍有部分患者难以CR 或复发后治疗效果有限,这就需要找到更加准确的治疗靶点和预后标记物,从而进一步的提高DLBCL患者的疗效和改善预后。
FOXP1蛋白是一种由677个氨基酸组成,相对分子质量约为75×103的翼型螺旋转录因子,隶属于FOXP亚家族。在B细胞的不同分化阶段的均有表达,但不表达于浆细胞,与B细胞发育和成熟、胚胎正常发育、心肌细胞发育、人类和禽类言语形成及运动神经元多样性和连接性相关[11-14]。研究显示,FOXP1蛋白的表达与DLBCL 患者的预后相关,FOXP1表达失调在DLBCL的发病机制中可能起着重要作用[14]。也有研究认为FOXP1的表达与DLBCL患者的预后无关。本研究结果显示,FOXP1 在40 例DLBCL 组织中的阳性表达率为50.0%,高于国外文献结果(18%~40%),其中,non-GCB 型DLBCL阳性表达率为69.2%。FOXP1主要表达于non-GCB型DLBCL,与国内外多数研究结果相同[7,15],但其表达的百分数却与其他研究结果一样参差不齐,造成这些差异的原因可能是准备组织的方法不同,或是样本自身差异所致,也可能是由于FOXP1表达阳性的评价标准不同。40例DLBCL患者2年PFS为52.5%,2年OS为82.5%,均优于胡成如等[15]对85例经CHOP方案治疗的DLBCL患者研究的生存期(2年PFS为46.5%,2年OS为68.8%),这可能与R-CHOP方案疗效优于CHOP方案有关。Kaplan-Meier分析显示FOXP1 阳性表达者的预后差于阴性表达者,FOXP1阳性提示预后不良。多因素回归分析显示,临床分期和FOXP1 的表达是DLBCL 的PFS和OS的独立预测因素。
本研究发现,FOXP1主要表达于non-GCB 型DLBCL,且FOXP1的表达与DLBCL的预后密切相关,可以作为其预后标记物,提示预后不良。这意味着可以针对性的以FOXP1蛋白作为靶点进行进一步研究,为治疗DLBCL 开辟新的治疗方法和思路,从而有望进一步提高患者的疗效和改善其预后。
[1] Wang HK,Geng JL,Wen XM,et al.The transcription factor Foxp1is a critical negative regulator of the differentiation of follicular helper T cells[J].Nat Immunol,2014,15(7):667-675.
[2] Takashi S,Nobuhiro I,Kazuhiro I,et al.FOXP1,an estrogen-inducible transcription factor,modulates cell proliferation in breast cancer cells and 5-year recurrence-free survival of patients with tamoxifen-treated breast cancer[J].Horm Cancer,2011,2(5):286-297.
[3] Li SR,Wang Y,Zhang YZ,et al.Foxp1/4control epithelial cell fate during lung development and regeneration through regulation of anterior gradient 2 [J].Development,2012,139(14):2500-2509.
[4] 沈琳,陈波斌,陈字,等.原发性中枢神经系统淋巴瘤FOXP1和Cyclin E 的表达及意义[J].中华血液学杂志,2012,33(8):648-652.
[5] 刘剑,尚鑫,沙素梅,等.转录因子FOXP1 在胃癌组织中的表达及意义[J].现代生物医学进展,2014,14(5):1673-6273.
[6] Hu CR,Wang JH,Wang R,et al.Both FOXP1and p65 expression are adverse risk factors in diffuse large B-cell lymphoma:a retrospective study in China[J].Acta Histochemica,2013,115(2):137-143.
[7] Yu BH,Zhou XY,Li BZ,et al.FOXP1expression and its clinicopathologic significance in nodal and extranodal diffuse large B-cell lymphoma[J].Ann Hematol,2011,90(6):701-708.
[8] 吕明芬,黄卡特,李秉煦,等.Foxpl及Ki-67在皮肤基底细胞癌的表达[J].中国麻风皮肤病杂志,2011,27(5):339-342.
[9] Hans CP,Weisenburger DD,Greiner TC,et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J].Blood,2004,103(1):275-282.
[10] 彭鹏,邹文蓉,王瑜,等.R-CHOP 与CHOP 方案治疗生发中心和非生发中心来源DLBCL 疗效评价[J].现代医药卫生,2013,29(16):1009-5519.
[11] Rao DS,O'Connell RM,Chaudhuri AA,et al.O'Connell,Aadel A.Chaudhuri1,et al.MicroRNA-34aperturbs B lymphocyte development by repressingthe Forkhead Box Transcription Factor Foxp1[J].Immunity,2010,33(1):48-59.
[12] Chang SW,Mislankar M,Misra C,et al.Genetic abnormalities in FOXP1are associated with congenital heart defects[J].Hum Mutat,2013,34(9):1226-1230.
[13] Zhang Y,Li S,Yuan L,et al.Foxp1coordinates cardiomyocyte proliferation through both cell-autonomous and nonautonomous mechanisms [J].Genes Dev,2010,24(16):1746-1757.
[14] Pariani MJ,Spencer A,Graham JM Jr,et al.A 785kb deletion of 3p14.1p13,including the FOXP1gene,associated with speech delay,contractures,hypertonia and blepharophimosis[J].Eur J Med Genet,2009,52(2/3):123-127.
[15] 胡成如,王靖华,耿怀成,等.叉头框转录蛋白1在弥漫性大B细胞淋巴瘤中的表达及预后意义[J].临床肿瘤学杂志,2012,17(4):399-342.
