利多卡因对AMI动物模型星状神经节内心交感神经元电活动的影响*
2015-03-05井发强谭金明张晓芳岳文胜
陈 卫,井发强,谭金明,张晓芳,岳文胜
(1.川北医学院病理生理教研室,四川南充637100;2.川北医学院机能实验中心,四川南充637100;3.川北医学院附属医院超声科,四川南充637100)
利多卡因是一种局部麻醉常用药物,也是临床心血管相关科室治疗室性心动过速首选药物。临床研究认为利多卡因能直接作用于心室肌和浦肯野纤维网,抑制Na+内流和促进K+外流,从而降低自律性,从而纠正急性心肌梗死(acute myocardial infarction,AMI)引起的室性心动过速[1]。但是近些年来有报道称利多卡因可能通过抑制心交感神经,降低心肌缺血患者交感神经张力,从而改善心肌缺血患者心率过快和心血管收缩状态,从而改善心肌缺血症状,也有人认为这是由于利多卡因可以直接作用于心血管内皮细胞,抑制Ca2+内流,抑制自由基的产生,从而保护心血管内皮[2]。然而利多卡因是如何影响心交感神经电活动的却一直缺乏直接的实验证据,本实验通过电生理技术记录星状神经节内心交感神经元放电活动,观察利多卡因在动物心肌缺血条件下对心交感神经元电活动的影响,为临床实践用药提供直接电生理依据。
表1 不同剂量利多卡因对星状神经节内心交感神经元放电频率的影响(n=8,±s,Hz)

表1 不同剂量利多卡因对星状神经节内心交感神经元放电频率的影响(n=8,±s,Hz)
组别0min 5min 10min 15min 20min 25min 30min A 组 14.4±3.82 14.6±4.29 14.2±3.41 14.6±3.89 14.1±3.47 14.3±2.71 14.5±3.59 B组 14.2±3.51 14.3±3.66 11.7±2.28 10.9±4.36 11.1±4.13 13.3±3.27 13.0±4.84 C组 24.3±5.52 24.5±6.21 23.4±5.78 22.1±6.29 22.5±6.33 21.2±5.87 20.4±6.68 D组 24.9±5.88 18.1±5.19 19.8±.6.52 19.5±5.63 19.6±5.79 19.5±6.41 19.9±6.81 E组 25.1±6.71 16.6±4.37 16.9±5.21 16.2±5.74 17.6±6.33 17.5±6.11 17.9±5.53 F组 25.0±0.44 16.3±5.34 12.4±4.48 11.8±4.26 11.5±4.47 12.1±5.39 12.3±5.72
1 材料与方法
1.1 实验动物、材料与仪器 新西兰大白兔87 只,体质量2.0~2.5kg,雌雄不拘,由川北医学院实验动物中心提供。成都泰盟公司BL-420生物信号信息采集系统,上海医用光学仪器厂SXE-1C手术显微镜;钨丝金属微电极、兔手术台、动物呼吸机、手术微电极推进器、结扎缝线;1%戊巴比妥钠、利多卡因、生理盐水等。
1.2 方法
1.2.1 AMI动物模型制作 由耳缘静脉注射1%戊巴比妥钠(3mL/kg)麻醉家兔,将其仰卧固定于兔台,打开BL-420生物信号采集系统心电监测项目栏,按右上肢(红)-左上肢(黄)-右下肢黑的顺序,将针形电极分别插入四肢皮下,于1通道上实时监测心电(Ⅱ导联)。颈部与胸前区剃毛备皮,沿颈部中线做一纵行长约4cm 切口,行气管插管,连接呼吸机并在左锁骨下动脉,颈动脉和第七颈椎后方颈深部找到与颈下神经节融合的星状神经节用石蜡油棉花保湿备用。另在剑突上2cm 正中做一纵行长约5cm 切口,切开胸骨,用开胸器轻轻撑开胸腔,剪开心包,找到冠状动脉前降支根部,穿线结扎左前降支,根据动物出现的呼吸急促,紫绀等症状,结合ECG 心肌梗死波形,判定心肌缺血模型成功,缝合胸腔。保温并由耳缘静脉缓慢滴入生理盐水(30~40滴/min)。
1.2.2 神经元放电记录 暴露颈部,在放大10倍的手术显微镜下小心游离星状神经节,石蜡油保湿,将金属微电极(电阻15Ω)插入星状神经节内,尾端连接微BL-420生物信息采集系统2通道,调整引导参数(G 200μV,T 0.001s,F 3kHz),并将微电极固定在微推进器,以1μm/s的速度向前推进,记录到神经元放电即刻停止进针。小心缝合颈部切口,防止水分蒸发。
1.3 实验分组及利多卡因麻醉 将实验动物分6组(n=10),A 组为正常假手术对照组(不结扎冠状动脉,不引起缺血,给予等体积生理盐水),B 组为正常假手术给药组(不结扎冠状动脉,不引起缺血,给予中等剂量利多卡因),C 组为模型对照组(生理盐水),D 组为低剂量给药组(AMI模型给予利多卡因1.0mg/kg)、E组为中等剂量给药组(AMI模型给予利多卡因1.5mg/kg)、F组为高剂量给药组(AMI模型给予利多卡因2.0mg/kg),每组记录8个心交感神经元放电,每组所记录的神经元放电作给药前后的自身对照。具体实验过程如下:各组建立AMI动物模型后,持续监测动物心电图和体征5min,待心电及体征平稳后,开始实验。通过微电极引导出颈上神经节内神经元放电,待放电平稳后,分别由兔耳缘静脉给予高剂量,中剂量、低剂量利多卡因,模型对照组则注射相同剂量的生理盐水。观察给药后,心电图及节内神经元放电的改变。
1.4 统计学处理 采用SPSS18.0统计软件进行分析,计量资料采用±s表示,组间均数比较采用单因素方差分析,给药前后则采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同组别的神经元放电改变 动物模型复制成功后,C组星状神经节内心交感神经元即刻放电频率较A 组比较显著增加[由(14.4±3.82)Hz增加到(24.3±5.52)Hz,P<0.05],而10min后开始降低,25min后神经元放电频率恢复到给药前水平(P>0.05),说明AMI后,心交感神经元的兴奋性增加,随着缺血时间的延长,交感神经出现了“适应”现象,兴奋性逐渐降低但仍高于正常。D、E、F 组5min时神经元放电频率较0 min 时显著下降,与C 组比较差异有统计学意义(P<0.05),30min后仍有明显差异(P<0.05)。随着给药剂量的加大,抑制作用加强(P<0.05),显示利多卡因对心交感神经元的抑制具有剂量依赖性。其放电频率见表1、图1。

图1 给药前后星状神经节内心交感神经元放电频率改变
2.2 不同组别的心电改变 实验对家兔的Ⅱ导联进行了观察比较发现,以ST 段偏移J点后0.08s处开始计算,动物模型复制成功后,C组较A 组心电改变ST 段明显上抬,上抬幅度大于或等于2.5 mm,心率加快[由(222.00±7.32)上升到(289.00±10.51)次/min]。而D、E、F组与C 组比较发现,给药后30min E、F组ST 段上升程度明显减轻,分别由(2.80±0.11)mm 降至(1.30±0.37)mm、(2.60±0.31)mm 降至(1.10±0.17)mm 和(2.70±0.16)mm 降至(1.10±0.44)mm,呈一定剂量依赖性。心率分别由(290.00±9.79)次/min下降至(251.00±10.33)次/min和(288.00±11.09)次/min下降至(242.00±11.14)次/min(P<0.05),而C 组则未见明显变化(P>0.05)。结果见表2、图2。
表2 不同剂量利多卡因对急性心肌梗死动物模型 心电的影响(±s,n=10)

表2 不同剂量利多卡因对急性心肌梗死动物模型 心电的影响(±s,n=10)
a:P<0.05,与C 组比较;b:P<0.05,与给药前比较;c:P<0.05,与给药后比较。
组别ST段上抬改变(mm)给药前 给药后HR(次/min)给药前 给药后A组 0.08±0.02a 0.00±0.03 222.00±7.32 221.00±8.11 B组 0.09±0.03a 0.01±0.05 223.00±9.22 192.00±12.18 C组 2.50±0.09 2.40±0.18 289.00±10.51c 286.00±9.32 D组 2.80±0.11 1.30±0.37b 286.00±8.26 265.00±6.19b E组 2.60±0.31 1.10±0.17b 290.00±9.79 251.00±10.33b F组 2.70±0.16 1.10±0.44b 288.00±11.09 242.00±11.14 b
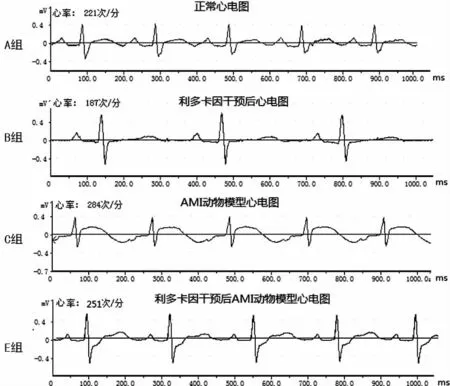
图2 利多卡因对AMI动物模型心电的影响
3 讨 论
近年临床研究表明,AMI患者在发病过程中都存在着交感神经过度兴奋,交感-肾上腺髓质系统异常亢进的现象,可能是造成心肌缺血持续加重,缺血症状持续不能缓解的重要原因[3],因此,对于AMI患者的治疗除了及时扩张冠状动脉血管,改善梗死症状的同时要抑制心交感神经的过度兴奋,防止心血管持续收缩和心率失常的发生,以降低病死率和复发率。星状神经节是交感神经支配心脏的重要中继站,其内仅含有心交感神经传出纤维,无传入纤维,因此,近些年来通过切除、阻滞和电刺激星状神经节的方法来研究交感神经过度兴奋在心肌梗死和心力衰竭发病过程中的作用[4-5]。有学者研究发现切除双侧星状神经节的犬不易被人工诱发房颤,而通过间接抑制星状神经节活动则可减低阵发性心动过速和房颤的概率,因而星状神经节的活动与心脏功能息息相关[6-7]。因此,本实验设计通过电生理技术记录了AMI动物模型星状神经节内心交感神经元放电情况,结果发现AMI时,星状神经节内心交感神经元放电频率明显增加,证实在AMI过程中,心交感神经兴奋呈正反馈调节,交感神经传出冲动增加,加剧心肌缺血的程度。而近年来的研究发现利多卡因可抑制神经元的过度放电,阻断Na+通道,稳定神经细胞膜电位,抑制动作电位的产生、中枢神经系统、应激反应,降低血中肾上腺素等儿茶酚胺的浓度,降低急性心肌缺血后细胞膜的损伤,稳定心肌细胞膜,从而限制梗死面积扩大[8-10]。另有人还发现通过向患者硬膜外注射利多卡因,阻断交感神经活动,去交感神经活化,可明显改变AMI后的临床症状并有效降低了AMI后的心电紊乱[11]。可见利多卡因在心交感神经的活动过程中起到了重要作用,本研究在记录星状神经节内神经元放电的同时观察给予不同剂量的利多卡因对其神经元放电的改变情况,结果发现静脉注射利多卡因能明显抑制AMI动物模型星状神经节内心交感神经元过度放电,并且呈一定的剂量依赖性,这表明利多卡因很可能直接作用于神经节内神经元或者直接作用于脊髓中枢神经元,产生突触前抑制,引起神经元放电减少,从而引起传出神经冲动减少,心脏交感神经张力下降,从而达到降低心率,减少心肌耗氧。由于当心前区心肌梗死时,心前区导联出现ST 段的改变是前壁缺血性损伤或非穿透性梗死的表现,具有较高的危险性[12],因此本研究选择了心电图Ⅱ导联同步观察,心电图显示心率下降,ST 上抬的幅度减少,这种效应可能来自于两个方面,一方面利多卡因作用于心交感节内神经元,抑制神经元放电,导致心交感纤维传出冲动减少,交感神经张力下降,心率减慢,心血管舒张,缺血得到改善;另一方面,利多卡因还可直接作用于心室肌和浦肯野纤维网,抑制Na+内流和促进K+外流,从而降低自律性。由此可见利多卡因对心脏的作用是双重的。然而作者也观察到,对于正常无心肌缺血的动物模型来说,利多卡因抑制心交感神经元放电的效果并不十分明显,持续的时间也短,这与以往临床资料有所不同,可能是由于正常条件下,交感神经的负反馈机制正常运转,部分抵消了利多卡因引起的交感神经张力下降的效应,而AMI时交感神经系统出现了紊乱,反馈条件机制被破坏,因而其抑制放电的作用也强,但目前仍缺少有力证据证实这点,因而需要进一步研究证明。
[1] Canyon SJ,Dobson GP.Pretreatment with an adenosine A1receptor agonist and lidocaine:apossible alternative to myocardial ischemic preconditioning[J].J Thora Cardiovasc Surg,2005,130(2):371-377.
[2] Nilsson MF,Ritchie H,Webster WS.The effect on rat embryonic heart rate of Na+,K+,and Ca2+channel blockers,and the human teratogen phenytoin,changes with gestational age[J].Birth Defects Res B Dev Reprod Toxicol,2013,98(5):416-427.
[3] Gangully PK,Dhalla KS,Shao Q,et al.Deferential changes in sympathetic activity in left and right ventricles in congestive heart failure myocardial infarction[J].Am Heart J,1997,133(3):340-345.
[4] Wood A,Docimo S,Eikowitz DE.Cardiovascular disease and its association with histological changes of the left stellate ganglion[J].Clin Med Insights Pathol,2010,3:19-24.
[5] Zhou SM,Jung BC,Tan AY,et al.Spontaneous stellate ganglion nerve activity and ventricular arrhythmia in a canine model of sudden death[J].Heart Rhythm,2008,5(1):131-139.
[6] Yu L,Scheriag BJ,Li S,et al.Low level vago-sympathetic nerve stimulation inhibits atrial fibrillation inducibility:direct evidence by neural recordings from intrinsic cardiac ganglia[J].J Cardiovasc Electrophysiol,2011,22(4):455-463.
[7] Jayachandran JV,Sih HJ,Winkle W,et al.Atrial fibrillation produced by prolonged rapid atrial pacing is associated with heterogeneous changes in atrial sympathetic innervation[J].Circulation,2000,101(10):1185-1191.
[8] Mitchell SJ,Merry AF,Frampton CA,et al.Cerebral protection by lidocaine during cardiac operations:a follow-up study[J].Annals of Thoracic Surgery,2009,87(3):820-825.
[9] 赵福平,王鹏飞,孟俊鹏.利多卡因对缺血再灌注离体大鼠心脏Bcl-2与Caspase-3表达的影响[J].中国现代药物应用,2010,4(9):33-34.
[10] Chahine M,Chen LQ,Barchi RL,et al.Lidocaine block of human heart sodium channels expressed in Zeenopus oocytes[J].J Mol Cardiol 1994,24:1231.
[11] 栾霁冬,韦南,刘金秀,等.硬膜外阻滞预防急性心肌梗死后心电紊乱的对比研究[J].黑龙江医学,2001,25(11):818.
[12] Hurst JW.Thoughts about the abnormalities in the electrocardiogram of patients with acute myocardial infarction with emphasis on a more accurate method of interpreting ST segment displacement:PartⅡ[J].Clin Cardiol,2007,30(9):443-449.
