血清25-羟维生素D与妊娠糖尿病相关性分析*
2015-03-05王凯航
王凯航,向 菲
(1.贵阳医学院研究生学院 550004;2.贵阳市第二人民医院内分泌代谢科 550081)
妊娠期维生素D 缺乏是非常普遍的[1]。Homles等[2]研究发生95%的妊娠妇女与非妊娠妇女均有维生素D 缺乏。Yu等[3]发现亚洲妊娠妇女(47%)有着较为严重的维生素D缺乏。国内贵阳地区妊娠妇女维生素D 缺乏发生率为83.6%[4]。一些观察性研究发现维生素D 缺乏可能增加母体妊娠糖尿病(GDM)发病风险,然而我国关于维生素D 与GDM相关分析较少,本研究旨在分析GDM 患者维生素D 水平,以及维生素D 与GDM 胰岛素抵抗、胰岛β细胞功能的关系。
1 资料与方法
1.1 一般资料 2013年7月至2014年1月在贵阳市第二人民医院进行产前检查的妊娠24~28周妇女,行两步法葡萄糖耐量试验(OGTT)诊断为GDM 30例(GDM 组),血糖正常孕妇30例(对照组)。GDM 诊断按照美国糖尿病学会(ADA)2011发布的诊断标准:75g OGTT 符合下列任何1项即可诊断为GDM:(1)空腹血糖大于或等于5.1mmol/L;(2)OGTT 1 h血糖大于或等于10.0mmol/L;(3)OGTT 2h血糖大于或等于8.5mmol/L。所有入组者均为单胎受孕且孕前健康的孕中期(孕24~28周)女性。本研究的程序符合本院人体试验委员会所制定的伦理学标准,按照自愿参加原则。
1.2 方法
表1 两组临床资料比较(±s)
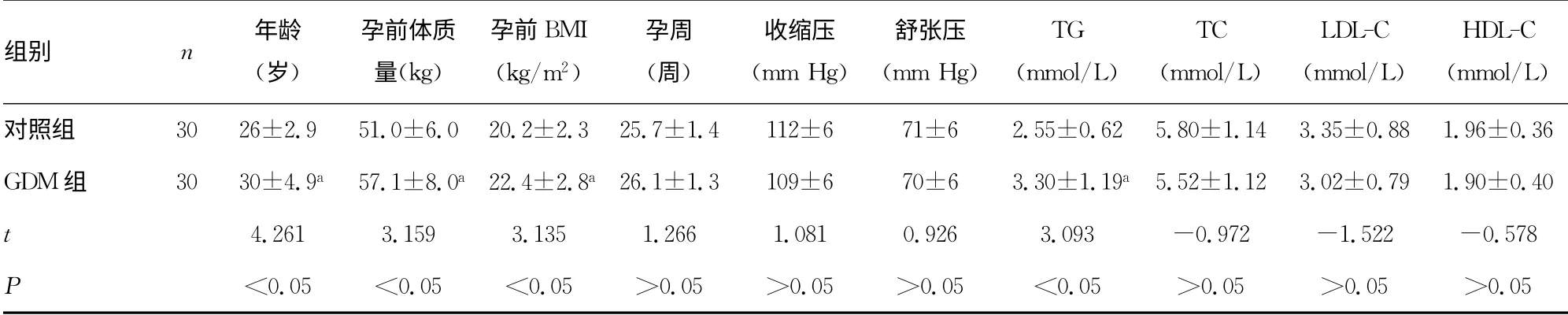
表1 两组临床资料比较(±s)
组别 n 年龄(岁)孕前体质量(kg)孕前BMI(kg/m2)孕周(周)收缩压(mm Hg)舒张压(mm Hg)TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)对照组 30 26±2.9 51.0±6.0 20.2±2.3 25.7±1.4 112±6 71±6 2.55±0.62 5.80±1.14 3.35±0.88 1.96±0.36 GDM 组 30 30±4.9a 57.1±8.0a 22.4±2.8a 26.1±1.3 109±6 70±6 3.30±1.19a 5.52±1.12 3.02±0.79 1.90±0.40 t 4.261 3.159 3.135 1.266 1.081 0.926 3.093 -0.972 -1.522 -0.578 P<0.05 <0.05 <0.05 >0.05 >0.05 >0.05 <0.05 >0.05 >0.05 >0.05
续表1 两组临床资料比较(±s)
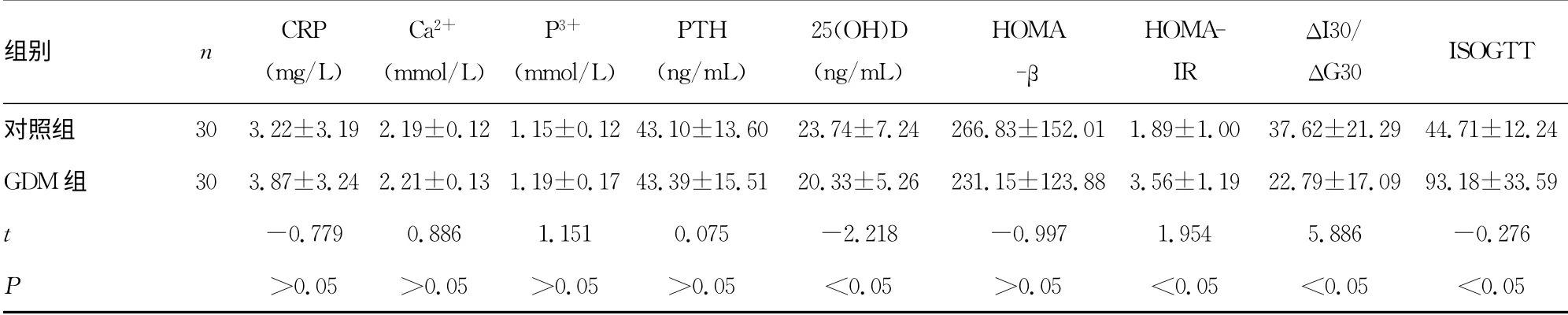
续表1 两组临床资料比较(±s)
组别 n CRP(mg/L)Ca2+(mmol/L)P3+(mmol/L)PTH(ng/mL)25(OH)D(ng/mL)HOMA-β HOMAIR ΔI30/ΔG30 ISOGTT对照组 30 3.22±3.19 2.19±0.12 1.15±0.12 43.10±13.60 23.74±7.24 266.83±152.01 1.89±1.00 37.62±21.29 44.71±12.24 GDM 组 30 3.87±3.24 2.21±0.13 1.19±0.17 43.39±15.51 20.33±5.26 231.15±123.88 3.56±1.19 22.79±17.09 93.18±33.59 t-0.779 0.886 1.151 0.075 -2.218 -0.997 1.954 5.886 -0.276 P>0.05 >0.05 >0.05 >0.05 <0.05 >0.05 <0.05 <0.05 <0.05
1.2.1 分组 对研究对象先行50g OGTT 进行初筛,服糖后1h血糖高于7.2 mmol/L 的110 名孕妇于3d后进行75g OGTT,抽取空腹、服糖后30、60、120、180 min各时相肘正中静脉全血,按上述诊断标准诊断GDM 30例为GDM 组,随机选取OGTT 血糖正常的孕妇30例为对照组。
1.2.2 实验室检查 血糖采用己糖激酶终点法检测,胰岛素和甲状腺旁腺素(PTH)采用电化学发光分析仪。三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、C反应蛋白(CRP)、钙离子(Ca2+)、磷离子(P3+)采用AU5400/AU2700 全自动生化分析仪测定。25(OH)D 采用高效液相色谱-串联质谱法(HPLC-MS/MS)进行检测;于采血当天测坐位血压、测量身高、体质量并记录孕前体质量,计算体质量指数(BMI)。
1.2.3 评价指标计算 以稳态模式胰岛素抵抗指数(HOMAIR)、胰岛素敏感指数(ISOGTT)评价胰岛素敏感性;计算公式为:HOME-IR=(FPG×FINS)/22.5,ISOGTT=10 000/sqrt[FPG×FINS×平均血糖×平均胰岛素]。以稳态模式胰岛β细胞分泌指数(HOMA-β)、早相胰岛素分泌指数(ΔI30/ΔG30)评价胰岛β细胞功能,计算公式为HOME-β=(FINS×20)/(FPG-3.5),ΔI30/ΔG30=(INS30-FINS)/(PG30-FPG),其中FPG、PG30、PG60、PG120、PG180 分 别 表 示OGTT 空 腹、0.5、1.0、2.0、3.0 h 血 糖,FINS、INS30、INS60、INS120、INS180分别表示OGTT 后空腹、0.5、1.0、2.0、3.0h胰岛素;平均血糖为糖负荷后各时间点血糖的平均值,平均胰岛素为糖负荷后各时间点胰岛素的平均值。根据2011年美国内分泌学会《维生素D 缺乏治疗和预防临床指南》,将血清25(OH)D<20ng/mL(50mmol/L)定义为维生素缺乏[5]。
1.3 统计学处理 采用SPSS17.0软件进行统计分析,计量资料用±s表示,两均数比较采用独立样本t检验。胰岛素抵抗、胰岛β细胞功能指标、临床一般资料与25(OH)D 相关性采用多元逐步回归分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料比较 与对照组比较,GDM 组年龄较大、孕前体质量较重、孕前BMI及TG 较高,差异有统计学意义(P<0.05);两组间年龄、孕周、HDL-C、LDL-C、Ca2+、P3+、PTH、收缩压、舒张压、CRP 比较,差异无统计学差异(均P>0.05);GDM 组HOME-IR、ISOGTT 较对照组高,差异有统计学意义(P<0.05),GDM 组ΔI30/ΔG30较对照组低,差异有统计学意义(P<0.05),两组HOMR-β比较,差异无统计学意义(P>0.05),见表1。
2.2 空腹血糖和25(OH)D 关系 与对照组比较,GDM 组25(OH)D水平较低,差异有统计学意义(P<0.05),按GDM诊断标准的3个不同时间点血糖值,将受试者重新分布,结果显示空腹血糖升高的孕妇25(OH)D 水平低于空腹血糖正常者,差异有统计学意义(P<0.05);以空腹血糖为因变量,年龄、孕周、TG、TC、孕前BMI、收缩压、CRP、Ca2+、P3+、PTH、25(OH)D为自变量行多元逐步回归分析,结果显示空腹血糖与25(OH)D、TG、孕前BMI独立相关(标准系数β分别-0.283、0.282、0.267,P<0.05)。见表2。
表2 25(OH)D 与各点血糖值的关系(±s,ng/mL)
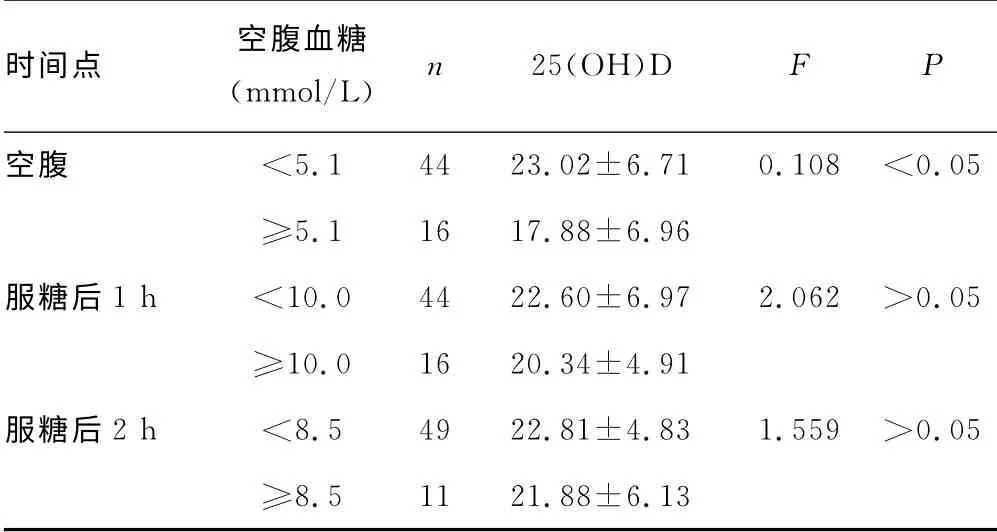
表2 25(OH)D 与各点血糖值的关系(±s,ng/mL)
时间点 空腹血糖(mmol/L) n 25(OH)D F P空腹 <5.1 44 23.02±6.71 0.108 <0.05≥5.1 16 17.88±6.96服糖后1h <10.0 44 22.60±6.97 2.062 >0.05≥10.0 16 20.34±4.91服糖后2h <8.5 49 22.81±4.83 1.559 >0.05≥8.5 11 21.88±6.13
2.3 25 (OH)D 与妊娠妇女胰岛素抵抗、胰岛β细胞功能的相关性 以所有受试者为对象,以ISOGTT 为因变量,年龄、孕周、TG、TC、孕前BMI、收缩压、CRP、Ca、P、PTH、25(OH)D 为自变量行多元逐步回归分析,结果显示ISOGTT 与25(OH)D、孕前BMI、TG独立相关(标准系数β分别为0.245、-0.267、-0.319,P<0.05)。多元逐步回归分析显示,HOME-IR与TG、孕前BMI、CRP独立相关(标准系数β分别为0.295、0.327、0.225,P<0.05)。而25(OH)D 与ΔI30/ΔG30、HOMA-β无明显相关。
3 讨 论
目前GDM 的发病机制尚不完全清楚,多数观点认为GDM 患者可能存在两种胰岛素抵抗,一种为妊娠期间胎盘分泌的甾体类激素所致生理性胰岛素抵抗,另一种为妊娠前期已存在的慢性胰岛素抵抗。随着对GDM 发病机制的不断探讨,目前认为基因异常及遗传易感性、营养因素、炎性因子、脂肪细胞因子、氧化应激、线粒体活性下降、维生素D 缺乏等共同参与了GDM 的发生。本研究中GDM 组在年龄、孕前体质量、孕前BMI、TG、HOME-IR、ISOGTT、ΔI30/ΔG30、25(OH)D 与对照组比较差异均有统计学意义(P<0.05),与以往报道一致,认为GDM 是一种多种因素所致的疾病。
本研究对维生素D 水平与GDM 的关系做初步的探讨,维生素D 在体内经肝、肾羟化后代谢为1,25-二羟维生素D,从而发挥其生物学效应,其前体25(OH)D 在血液循环中相对稳定,是评估血液维生素D 状态的主要标志物[6]。有研究报道了低水平的25(OH)D 与GDM 发生有关:来自伊朗的病例对照研究[7],患GDM 妊娠期妇女25(OH)D 水平明显低于糖耐量正常的妊娠期妇女。Zhang 等[1]则报道美国人群中,25(OH)D 浓度每降低12.5nmol/L,妊娠期糖尿病风险即增加29%。本研究中GDM 组的25(OH)D 的水平低于对照组,差异有统计学意义(P<0.05)。空腹血糖升高者25(OH)D 水平较空腹血糖正常者低,差异有统计学意义(P<0.05),且多元逐步回归分析也显示,空腹血糖和25(OH)D 水平独立相关,这与来自澳大利亚一项研究结果相符[8];此外,早在多年前就有长期外源性补充维生素D 后空腹血糖和胰岛素抵抗显著下降的报道[9]。
维生素D 影响糖代谢具体机制值得进一步探讨,基于2型糖尿病的观察研究以及动物实验指出活化的维生素D 能够激活、保护胰岛β细胞[10]。吴冕等[11]研究中指出25(OH)D水平与1型糖尿病患者中胰岛β细胞功能相关。此外,有研究表明维生素D 缺乏导致脂肪组织在该组织内沉积使得胰岛素抵抗增加。Chiu等[12]发现血清25(OH)D 与胰岛素敏感性呈正相关,维生素D 缺乏者有更高的胰岛素抵抗和2型糖尿病危险。
以上研究均基于2型或1型糖尿病,然而关于维生素D 影响GDM 患者糖代谢的研究较少,本研究对25(OH)D 与GDM患者胰岛素抵抗、胰岛β细胞功能的相关性作初步探讨,发现25(OH)D 水平与ISOGTT 相关,ISOGTT 反映葡萄糖的肝输出及外周组织利用葡萄糖时的胰岛素敏感度,其值越低,表明机体对胰岛素越不敏感。HOME-IR 与TG、孕前BMI、CRP独立相关,支持肥胖、血脂异常、炎性因素参与、维生素D 缺乏共同参与妊娠期妇女胰岛素抵抗的观点。
本研究未发现25(OH)D 与ΔI30/ΔG30、HOMA-β相关,与上述关于2型或1型糖尿病研究结论不同,考虑GDM 作为糖尿病一类独立亚型,确有不同之处。此外,本研究样本含量少,为横断面研究,且评价胰岛素抵抗及胰岛β细胞功能的指标也有其局限性,尚不能明确妊娠期间维生素D 水平与GDM发病之间相关程度以及补充维生素D 是否有助于防止GDM的发生,今后尚需进一步开展追踪观察以及干预性前瞻研究进一步明确维生素D 缺乏与妊娠糖尿病的关系。
[1] Zhang C,Qiu C,Hu FB,et al.Maternal plasma 25-hydroxyvitamin D concentrations and the risk for gestational diabetes mellitus[J].PLoS One,2008,3(10):e3753.
[2] Homles VA,Barnes MS,Alexander HD,et al.Vitamin Ddeficiency and insufficiency in pregnant women:a longitudinal study[J].Br J Nutr,2009,12(6):876-881.
[3] Yu CK,Sykes L,Sethi M,et al.Vitamin D deficiency and supplementation during pregnancy[J].Clin Endocrinol,2009,70(5):685-690.
[4] Xiang F,Jiang J,Li H,et al.High prevalence of vitamin D insufficiency in pregnant women working indoors and residing in Guiyang,China[J].J Endocrinol Invest,2013,36(7):503-507.
[5] Holick MF,Binkley NC,Bischoff-Ferrari HA,et al.Evaluation,treatment,and prevention of vitamin D deficiency:an Endocrine Society clinical practice guideline[J].J Clin Endocrinol Metab,2011,96(7):1-20.
[6] 胡杰妤,陈朝彦,覃桦,等.危重患者维生素缺乏及其对预后的影响.[J].中华内分泌代谢杂志,2013,29(10):827-831.
[7] Soheilykhah S,Mojibian M,Rashidi M,et al.Maternal vitamin D status in gestational diabetes mellitus[J].Nutr Clin Pract,2010,25(5):524-527.
[8] Clinfton-Bligh RJ,McElduff P,McELduff A.Maternal vitamin D deficiency,ethnicity and gestational diabetes[J].Diabet Med,2008,25(6):678-684.
[9] Pittas AG,Harris SS,Stark PC,et al.The effects of calcium and vitamin D supplementation on blood glucose and markers of inflammation in non-diabetic adults[J].Diabetes Care,2007,30(5):980-986.
[10] Cheng Q,Li YC,Boucher BJ,et al.A novel role for vitamin D:modulation of expression and function of the local renin-angiotensin system in mouse pancreatic islets[J].Diabetologia,2011,54(8):2077-2081.
[11] 吴冕,陆俊茜,黄凯,等.维生素D 与1型糖尿病患者β细胞功能的相关性分析.[J].中华内分泌代谢杂志,2013,29(10):832-835.
[12] Chiu KC,Chu A,Go VL,et al.Hypovitaminosis D is associated with insulin resistance andβcell dysfunction[J].Am J ClinNutr,2004,79(5):820-825.
