基于半导体测序的人乳头瘤病毒核酸分型检测技术性能评估
2015-03-05李必生欧日晶曲守方
万 敏 李必生 邹 婧 欧日晶 侯 强 曲守方 黄 杰,*
1.华北石油管理局总医院检验科(任丘,062550);2.深圳华大基因研究院;3.中国食品药品检定研究院
人乳头瘤病毒(HPV)属双链闭环的小DNA病毒,包含约8000个碱基对[1]。HPV根据编码衣壳蛋白L1基因的开放读码框(ORF)序列不同进行分型[2]。高危型HPV持续感染是宫颈癌发生的主要因素[3-4],在99.7%的宫颈癌患者病变组织中可发现高危型的 HPV感染[5]。目前还缺乏针对 HPV公认的有效治疗手段,因此高危型HPV早发现、早预防是阻断癌变的关键。截止2014年,国内已经获得国家食品药品监督管理总局批准上市的HPV核酸检测试剂盒共有50多种[6],涉及的检测方法包括PCR-荧光探针法,PCR-反向斑点杂交法、基因芯片法、PCR-表面等离子谐振法、杂交捕获-化学发光法等。由于方法学的限制,分型检测多个HPV型别需要数个反应才能完成,检测通量大幅下降,成本也将提高。因此大部分HPV核酸检测试剂盒仅检测少数型别,或只定性检测而不进行HPV分型。近年来,新一代高通量测序技术发展迅速,涌现了多种先进的测序方法[7-9],这些技术已经在胎儿染色体非整倍体检测、单基因遗传病检测、遗传性肿瘤基因检测等临床检测中得到了应用[10-12]。目前半导体测序技术已经应用于HPV核酸分型检测中,通过对HPV的L1区基因保守序列进行测序及序列差异分析,实现了单个反应可对16种HPV型别(HPV6、11、16、18、31、33、35、39、45、51、52、56、58、59、66、68)同时分型检测,极大提高了检测的通量并降低了成本。本研究采用中国食品药品检定研究院体外诊断试剂一室研制的HPV L1基因分型国家参考品及HPV全基因组分型国家参考品对半导体测序法HPV核酸分型检测技术进行准确性、特异性、重复性及最低检测限等分析性能评估。同时采用已上市的HPV核酸检测试剂盒作为对照试剂盒,评估该技术检测临床样本的阳性符合率、阴性符合率、总体符合率及一致性系数(Kappa)值,评价该技术与临床检测方法的等效性。
1 材料与方法
1.1 样本来源
HPV L1基因分型国家参考品包括30种HPV型别质粒,其中14种高危型 HPV(16、18、31、33、35、39、45、51、52、56、58、59、68、73),3种中等危险型(26、53、66)和13种低危型 HPV(6、11、40、42、43、44、54、61、70、72、81、83、CP8304);HPV 全基因组分型国家参考品包括20种HPV型别质粒及5个阴性参考品,去除与HPV L1区分型参考品重复的型别,从中选取 HPV 67、69、71、82型质粒以及阴性参考品N1-N5用于性能评估试验,以上国家参考品均由中国食品药品检定研究院提供。选取华北石油管理局总医院提供的500例检测剩余的宫颈脱落细胞DNA样本用于临床检测性能评估,所有样本均已使用HPV基因分型(23型)检测试剂盒(PCR-反向点杂交法,亚能生物技术(深圳)有限公司,注册证号:国食药监械(准)字2014第3401228号)进行HPV核酸分型检测,总计200例阴性样本、300例阳性样本,阳性样本HPV型别均已知。
1.2 主要仪器与试剂
9700PCR仪购置于ABI公司;生物分析仪2100购置于安捷伦公司;Ion One TouchTM制备仪及Ion One TouchTMES纯化仪购置于 Life Technologies公司;基因测序仪(BGISEQ-100)购置于武汉华大基因生物医学工程有限公司。PCR及测序文库构建采用华大基因研究院研制的HPV(16种型别)核酸分型检测试剂盒(半导体测序法);半导体测序采用华大生物科技(武汉)有限公司生产的BGISEQ-100测序反应通用试剂盒(注册证号:鄂汉食药监械(准)字2014第1400030号)。
1.3 基于半导体测序法的HPV核酸分型检测技术
1.3.1 多重PCR反应 使用HPV(16种型别)核酸分型检测试剂盒(半导体测序法)中的PCR试剂扩增样本中的HPV DNA。多重PCR扩增引物根据HPV编码晚期蛋白的L1区基因保守序列设计,保证16种HPV型别均可有效扩增,同时上下游引物的5’端均加入了10bp的样本标签序列,用于数据分析中的样本序列识别。
1.3.2 文库构建 将带有不同样本标签序列的96个样本的PCR产物等比例混合成为一个文库样本。使用HPV(16种型别)核酸分型检测试剂盒(半导体测序法)中的建库试剂对文库样本进行磁珠纯化、末端修复反应及接头连接反应,使每个文库样本中的DNA序列两端均加上用于测序及文库识别的接头序列。经过生物分析仪2100检测后,将多个文库样本按等物质的量比例混合为一个测序样本。
1.3.3 DNA测序 将测序样本稀释,使用BGISEQ-100测序反应通用试剂盒对测序样本进行油包水PCR反应,使每个DNA分子仅与单个测序微珠相连并在微珠表面扩增,以放大测序信号。反应完成后将微珠富集并清洗,再加入测序引物退火,使测序引物与微珠表面的DNA中的接头退火结合,最后将产物加入测序芯片中,采用基因测序仪(BGISEQ-100)对测序样本DNA进行序列信息读取。半导体测序法采用边合成边测序的技术,通过成熟的半导体技术检测DNA链在合成过程中的pH值改变,并将这种变化转化为电子信号,实时记录反应过程中的电子信号有无及强度,从而获得DNA链中的碱基序列。
1.3.4 数据分析 使用HPV核酸分型分析软件对测序数据进行分析,每一条DNA的测序结果经过文库接头序列及样本标签序列的比对拆分后将被精确定位到每一个样本中。将每个样本的DNA测序结果与标准数据库中的各种HPV型别序列进行比对分析,统计每个样本比对到16种HPV型别的序列数量,若某样本的某一HPV型别的序列数高于该HPV型别的阈值,判断该样本为该HPV型别阳性,若低于阈值判断为该HPV型别阴性。
1.4 性能评估
技术性能评估试验设计参考了YY/T 1226-2014《HPV核酸(分型)检测试剂(盒)》医疗器械行业标准的技术要求及试验方法。由于标准中没有针对于基因测序方法进行HPV分型检测的相关要求,因此综合了所有方法的要求设计了评估试验。
1.4.1 准确性 使用2ng/μl人基因组TE溶液将HPV 6、11、16、18、31、33、35、39、45、51、52、56、58、59、66、68型的L1基因分型国家参考品(1000拷贝/μl)稀释至100拷贝/μl的溶液。检测以上稀释液,要求检测结果应为对应HPV型别阳性。
1.4.2 特异性 使用2ng/μl人基因组TE溶液将HPV 26、40、42、43、44、53、54、61、66、70、72、81、83、CP8304型的L1基因分型国家参考品及HPV 67、69、71、82型的全基因组分型国家参考品(1000拷贝/μL)稀释至100拷贝/μl的溶液。检测以上稀释液及阴性参考品N1~N5,要求检验结果应均为阴性。
1.4.3 重复性 采用2ng/μl人基因组TE溶液将HPV11、16型的L1基因分型国家参考品(1000拷贝/μl)稀释至100拷贝/μl的溶液。重复检测以上稀释液各10次,要求10次的检测结果均一致且为对应HPV型别阳性。
1.4.4 最低检测限 采用2ng/μl人基因组TE溶液将 HPV 6、11、16、18、31、33、35、39、45、51、52、56、58、59、66、68 型的 L1基因分型国家参考品(1000拷贝/μl)梯度稀释至100拷贝/μl、10拷贝/μl、1拷贝/μl的溶液。重复检测以上梯度稀释液各3次,确定最低检测限。要求<104拷贝/反应。
1.5 临床检测等效性评估方法
使用半导体测序法检测500例临床宫颈脱落细胞DNA样本,按照本方法检测范围内的16种HPV型别将试验对象分为16类。以HPV16型分型检测结果分析为例,已知结果为HPV16型的受试者样本作为阳性样本组,已知结果为非HPV16型感染或HPV感染阴性的受试者样本作为阴性样本组。按照表1分别将16组数据进行统计记录。
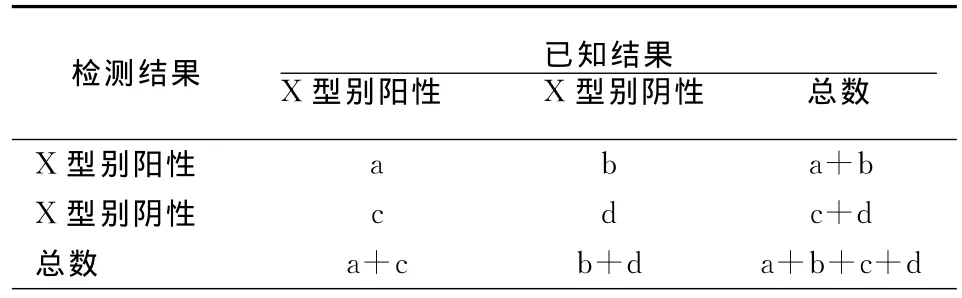
表1 检测数据统计表
按照以下公式计算检测结果与已知结果的阳性符合率、阴性符合率、总符合率、一致性系数(Kappa)值及各值的95%置信区间。
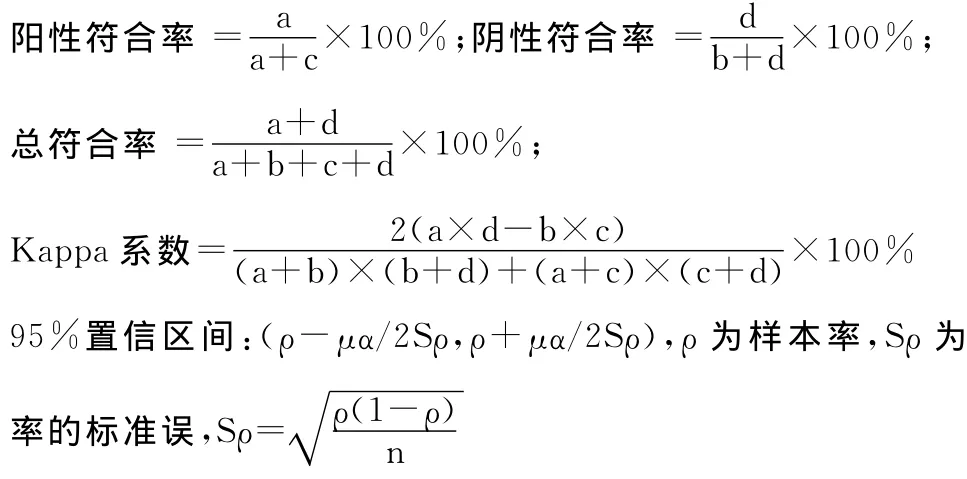
2 结果
2.1 分析性能评估
2.1.1 准确性 采用基于半导体测序法的HPV核酸分型技术检测100拷贝/μl的 HPV 6、11、16、18、31、33、35、39、45、51、52、56、58、59、66、68型 L1基因分型国家参考品稀释液,检测结果均为对应HPV型别阳性,准确率为100%。结果表明该技术可以准确检测16种HPV型别,具有很好的检测准确性。
2.1.2 特异性 检测100拷贝/μl的 HPV26、40、42、43、44、53、54、61、66、70、72、81、83、CP8304 型L1基因分型国家参考品稀释液及100拷贝/μl的HPV67、69、71、82型的全基因组分型国家参考品稀释液,检测结果均为HPV阴性。检测N1~N5共5例阴性参考品,检测结果均为HPV阴性。结果表明该方法与检测范围以外的其他HPV型别无交叉反应,与人基因组DNA也无交叉反应,具有较好的检测特异性。
2.1.3 重复性 重复检测100拷贝/μl的 HPV11及HPV16型L1基因分型国家参考品稀释液各10次,10次的检测结果均一致且为对应HPV型别阳性,重复率为100%。结果表明该技术具有较好的检测重复性。
2.1.4 最低检测限 结果显示,浓度为100拷贝/μl及10拷贝/μl的16种HPV型别国家参考品稀释液的3次结果均一致且为对应HPV型别阳性,检出率均为100%,而浓度为1拷贝/μl的国家参考品稀释液仅HPV16型检出一次阳性。因此确定该技术的最低检测限为10拷贝/μl(即50拷贝/反应),符合行业标准要求。
2.2 临床检测等效性评估
500例样本的测序检测统计结果显示,半导体测序法与已知结果的总体阳性符合率为99.33%(298/300),阴性符合率为100%(200/200),总符合率为99.60%(498/500),Kappa值为0.99,两种检测方法具有较高的一致性。按照16种HPV型别进行分组统计阳性符合率、阴性符合率、总符合率以及Kappa值。HPV52、56、58型的阳性符合率分别为98.25%(56/57)、94.74%(18/19),97.56%(40/41),其他 HPV型别的阳性符合率均为100%;HPV11、16、52、59、68 型的阴性符合 率 分别 为99.79% (484/485)、99.55% (444/446)、99.55%(441/443)、99.80%(487/488)、99.38%(482/485),其他HPV型别的阴性符合率均为100%;HPV11、16、52、56、58、59、68型的总符合率分别为99.80%(499/500)、99.60%(498/500)、99.40%(497/500)、99.80% (499/500)、99.80% (499/500)、99.80%(499/500)、99.40%(497/500),其他 HPV 型别的总符合率均为100%;16种HPV型别的Kappa值均>0.95,表明半导体测序法在检测16种HPV型别方面与临床检测技术具有较高的一致性。12例不一致样本的检测结果与已知结果的比较见表2。结果显示,前10例样本的两种检测方法结果均为HPV阳性,仅为HPV型别的差异,其中9例半导体测序法检出了更多的HPV型别,包括了HPV11、HPV16、HPV52、HPV59、HPV68型;其中1例半导体测序法未检出HPV56型。后2例样本的半导体测序法检测结果为阴性,而已知结果分别为HPV52、HPV58型。

表2 不一致样本的检测结果与已知结果比较
3 讨论
本研究采用了HPV分型国家参考品进行半导体测序法的技术性能评估,测试的范围涵盖了34种临床常见的高危型及低危型HPV型别。结果显示基于半导体测序法的HPV核酸分型检测技术可准确分型检测16种 HPV型别(HPV6、11、16、18、31、33、35、39、45、51、52、56、58、59、66、68),检测范围内的16种HPV型别之间无交叉反应,与其他HPV型别及人类基因组DNA亦无交叉反应,最低检测限为10拷贝/μl(即50拷贝/反应),具有很好的检测准确性、特异性及重复性,符合国家食品药品监督管理总局发布的 YY/T 1226-2014《HPV核酸(分型)检测试剂(盒)》医疗器械行业标准要求。
本研究同时采用了500例临床宫颈脱落细胞样本进行临床检测性能的研究。结果显示半导体测序法在检测临床样本方面与临床检测技术具有较高的一致性。12例结果不一致的样本涉及的型别包括HPV11、16、52、56、58、59、68型。分析半导体测序数据,样本1~6中不一致的HPV型别的检测数值与检测阈值的比值大部分为1~2,即检测值较接近阈值,分析可能导致这6例样本不符合的原因为:在多重感染的情况下,容易出现PCR引物竞争性抑制的情况,而不一致的HPV型别拷贝数较低,扩增效率较低,导致探针反向杂交显色时未检出低拷贝型别。样本7~9的不一致型别均为HPV68型且比值均为10,说明HPV68型拷贝数较高,导致已知结果中未检测HPV68型的原因可能为:这3例样本中的HPV68型序列在探针结合部分存在碱基突变,导致探针无法结合或结合不佳,而半导体测序法直接检测所有序列后通过与标准序列比对判断具体HPV型别,因此不受个别碱基突变的影响。样本10~12的不一致HPV型别的比值均为0,说明半导体测序法未扩增出对应的HPV型别序列,可能的原因为样本保存不当导致DNA降解,也可能为引物结合部分序列突变导致PCR扩增失败。
HPV核酸分型检测技术具有准确性高、重复性高、漏检率低的特点,而且可根据感染的HPV类型预测受检者的宫颈癌患病风险度。美国癌症协会等在2012年发布的关于宫颈癌预防及早期诊断的筛查指南中推荐,在>30岁的女性中使用HPV检测以及细胞学方法联合进行筛查[12]。由于在高级别宫颈上皮内瘤变中HPV16及HPV18型感染率较高[13],为了提高筛查效率,有研究建议根据HPV分型检测结果,HPV16和(或)HPV18阳性患者直接分流进行阴道镜检测,其他高危型HPV阳性患者进行细胞学检查,以降低筛查成本及阳性复查和干预人数[14]。HPV核酸分型检测技术还可用于意义不明的非典型鳞状上皮细胞(ASCUS)病例的分流、宫颈病变患者手术后随访,为区域性HPV流行病学调查提供可靠的依据[15]。
基于半导体测序法的HPV核酸分型检测技术分型准确,检测通量高,通过96套样本标签及50套文库标签协同标记不同样本,单次可同时检测4800份样本,极大提高了检测通量,同时降低了检测成本,为区域性人群宫颈癌筛查及HPV流行病学调查提供强有力的检测手段。该技术可以直接进行HPV分型,对于HPV16、HPV18等致癌性更强亚型感染者的临床干预进行分流,相当于在初筛的同时完成了二次筛查,具有较高的临床应用价值。今后的研究将进一步针对该技术在宫颈癌筛查方面的性能进行。
[1] IARC.Human papillomaviruses[J].IARC Monogr Eval Car-cinog Risks Hum,2007,90:1-636.
[2] de Villiers EM,Fauquet C,zur Hausen H,et al.Classification of papillomaviruses[J].Virology,2004,324(1):17-27.
[3] Bekkers RL,Massuger LF,Buhen J,et al.Epidemiological and clinical aspects of human papillomavirus detection in the prevention of cervical cancer[J].Rev Med Virol,2004,14:95-105.
[4] Zur Hausen H.Papillomaviruses causing cancer:evasion from host cell control in early events in carcinogenesis[J].J Natl Cancer Inst,2000,92:690-698.
[5] Walboomers JM,Jacobs MV,Manos MM,et al.Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J].J Pathol,1999,189:12-19.
[6] 国家食品药品监督管理总局.国产医疗器械数据查询[DB/OL].[2015-03-20].http://app1.sfda.gov.cn/datasearch/face3/base.jsp?tableId=26&tableName=TABLE26&title=国产器械&bcId=118103058617027083838706701567.
[7] Loman NJ,Misra RV,Dallman TJ,et al.Performance comparison of benchtop high-throughput sequencing platforms[J].Nat Biotechnol,2012,30:434-439.
[8] Jiang B,Song K,Ren J,et al.Comparison of next-generation sequencing systems[J].J Biomed Biotechnol,2012:251-364.
[9] Quail MA,Smith M,Coupland P,et al.A tale of three next generation sequencing platforms:comparison of Ion Torrent,Pacific Biosciences and Illumina MiSeq sequencers[J].BMC Genomics,2012,13:341.
[10] Huang X,Zheng J,Chen M,et al.Noninvasive prenatal testing of trisomies 21and 18by massively parallel sequencing of maternal plasma DNA in twin pregnancies [J].Prenat Diagn,2014,34(4):335-340.
[11] Wei X,Dai Y,Yu P,et al.Targeted next-generation sequencing as a comprehensive test for patients with and female carriers of DMD/BMD:a multi-population diagnostic study[J].Eur J Hum Genet,2014,22(1):110-118.
[12] Chong HK,Wang T,Lu HM,et al.The validation and clinical implementation of BRCAplus:a comprehensive high-risk breast cancer diagnostic assay[J].PLoS One,2014,9(5):e97408.
[13] Khan MJ,Castle PE,Lorincz AT,et al.The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus(HPV)type 16or 18and the possible utility of type-specific HPV testing in clinical practice[J].J Natl Cancer Inst,2005,97(14):1072-1079.
[14] 吴瑞芳,杜辉,易鑫.HPV检测作为宫颈癌初筛大样本人群筛查模型的建立及推广[J].中国科技成果,2013,20:90.
[15] Jing L,Zhong X,Zhong Z,et al.Prevalence of human papillomavirus infection in Guangdong Province,China:apopulation-based survey of 78,355women [J].Sex Transm Dis,2014,41(12):732-738.
