孕酮对反复自然流产小鼠白介素8表达的调节作用
2015-03-05冯若鹏赵紫薇陈小艳
宋 芳 冯若鹏 赵紫薇 陈 晶 贺 帅 陈小艳
1.包头医学院组织学与胚胎学教研室(014010);2.包头医学院形态学实验室
妊娠期母体产生大量的雌激素、孕激素等,它们能抑制辅助性T细胞(Th)1亚群反应,促进Th2细胞亚群 反 应[1-2]。Fotiadou 等[3]和 Piccinni等[4]发现孕酮可以促进Th2型细胞亚群分泌的细胞因子,如白介素(IL)-4和IL-5的高水平表达,参与免疫调节,减少流产发生。因此,有望通过调整孕酮水平对Th1/Th2型细胞因子间的平衡进行调节,有效地降低流产率。IL-8为Th1型细胞因子,表现为免疫杀伤作用,可引发自然流产,本实验通过比较孕酮干预的 CBA/J×DBA/2 小鼠流产模型和 CBA/J×BALB/c小鼠正常妊娠模型IL-8及其mRNA的变化,探讨孕酮对自然流产小鼠IL-8的调节作用。
1 材料与方法
1.1 主要试剂
兔抗人IL-8多克隆抗体为Santa Cruz公司产品;孕酮和IL-8酶联免疫吸附测定(ELISA)检测试剂盒、PV-6001试剂盒购于北京中杉金桥生物技术有限公司;RNA抽提试剂RNArose Reagent购于上海华舜生物工程有限公司;通用逆转录多聚酶链反应(RT-PCR)试剂盒购于北京博大泰克生物基因技术有限责任公司。
1.2 建立小鼠自然流产模型
将雌性CBA/J小鼠分别与雄性DBA/2或BALB/c小鼠合笼交配,次日晨检出阴栓者记为妊娠1d,分别建立自然流产模型与正常妊娠模型。于妊娠14d处死孕鼠,计算胚胎吸收率(R),以评价模型成功与否。R=Re/(Re+F)(Re为吸收胚胎数,F为存活胚胎数)。
1.3 实验分组
将自然流产小鼠分为两组:孕酮组和模型组,孕酮组于妊娠5d腹腔注射黄体酮溶液(2mg/kg),每日1次,维持至妊娠14d;模型组同步注射等量的生理盐水;正常妊娠小鼠不做任何处理。每组10只小鼠。
1.4 ELISA 检 测
3组孕鼠均于妊娠14d采用眼球摘除术收集血样,2000rpm/min离心10min,取血清,用 ELISA试剂盒检测孕酮及IL-8水平。以标准品2500、1250、625、312.5、156.25、78.125、39.06、0pg/ml所对应的浓度作为纵坐标,OD值作为横坐标在半对数纸上作图,画出标准曲线。所有OD值均减去空白管值后再计算。根据样品OD值在该标准曲线图上查出相应样品中孕酮、IL-8的含量。
1.5 免疫组织化学染色
将符合实验条件的各组小鼠绒毛、蜕膜组织制备成石蜡切片,常规脱蜡至水;0.3%H2O2·甲醇室温孵育30min,封闭内源性过氧化物酶;滴加兔抗人IL-8抗体工作液(1∶200),4℃过夜;滴加羊抗兔IgG抗体-辣根过氧化物酶(HRP)多聚体,室温孵育30min。二氨基联苯胺(DAB)-H2O2室温显色,Mayer苏木精复染细胞核,脱水、透明、封片。阴性对照用PBS代替一抗,其余步骤相同。用捷达801图像分析系统分别测定各组绒毛、蜕膜组织IL-8蛋白表达的相对含量。
1.6 RT-PCR
各组小鼠绒毛、蜕膜组织,生理盐水洗净后分别投入液氮到组织硬化,然后冻存于-80℃冰箱,以供提取RNA用。按通用RT-PCR试剂盒所示步骤,将mRNA反转录为cDNA,用所得cDNA进行PCR反应,PCR产物在2.0%琼脂糖凝胶上电泳,采用JeDa 801凝胶成像分析系统对DNA条带进行灰度扫描。
将同一标本IL-8DNA条带的灰度值/β-actin DNA条带的灰度值=IL-8mRNA的相对含量
IL-8引物序列:上游引物5'-GACAAGAGCCAGGAAGAAAC-3',下游引物5'-CTACAACAGACCCACACAATAC-3',扩增片段长度459bp;βactin引物序列:上游引物5'-CGGGAAATCGTGCGTGACAT-3',下游引物5'-GAACTTTGGGGGATGCTCGC-3',扩增片段长度712bp。
1.7 统计学处理
所有数据采用SPSS 11.5软件分析处理,用均值±标准差()表示,经方差齐性检验后,用单因素方差分析(one-way ANOVA)中的LSD法处理,并进行组间两两比较,P<0.05有统计学意义。
2 结果
2.1 ELISA 检 测
孕酮组血清孕酮水平高于模型组,而IL-8水平低于模型组,差异均有统计学意义(P<0.01)。孕酮组血清孕酮、IL-8水平与正常组比较均无统计学意义(P均>0.05)。见表1。
表1 各组血清孕酮、IL-8水平比较()

表1 各组血清孕酮、IL-8水平比较()
*与孕酮组比较P<0.01
组别 孕酮(ng/ml) IL-8(pg/ml)孕酮组 84.91±10.05 615.23±213.62模型组 41.83±9.77* 1653.14±321.25*正常组 91.27±10.91 653.87±183.43
2.2 免疫组织化学染色
在绒毛和蜕膜组织中,各组IL-8的蛋白表达主要定位在绒毛上皮细胞、蜕膜细胞及腺上皮细胞的细胞质内,呈棕黄色颗粒,阳性反应强弱不等(图1)。

图1 IL-8蛋白在各组绒毛和蜕膜组织中的表达(HRP,200×)
图像分析结果显示:孕酮组IL-8的蛋白相对含量在绒毛组织、蜕膜组织的蜕膜细胞和腺上皮细胞中均低于模型组,差异有统计学意义(P均<0.05),与正常组比较均无统计学意义(P均>0.05)。见表2。
表2 各组IL-8在绒毛、蜕膜组织中的蛋白相对含量比较()
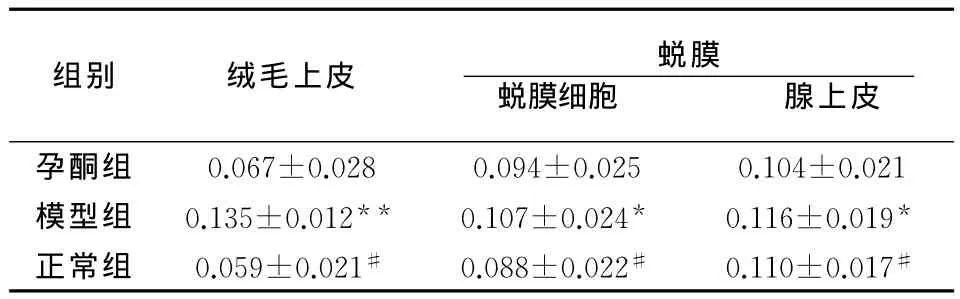
表2 各组IL-8在绒毛、蜕膜组织中的蛋白相对含量比较()
与孕酮组比较*P<0.05 **P<0.01 #P>0.05
组别 绒毛上皮 蜕膜蜕膜细胞 腺上皮孕 酮 组 0.067±0.028 0.094±0.025 0.104±0.021模型 组 0.135±0.012** 0.107±0.024* 0.116±0.019*正常 组 0.059±0.021# 0.088±0.022# 0.110±0.017#
2.3 RT-PCR实验
2.3.1 扩增产物的定性分析 IL-8mRNA在各组绒毛、蜕膜组织中均有表达,IL-8和β-actin的RTPCR产物与理论长度一致见图2。

图2 IL-8mRNA在各组绒毛、蜕膜组织表达的RT-PCR分析
2.3.2 扩增产物的半定量分析 在绒毛组织和蜕膜组织中,孕酮组IL-8mRNA的表达均低于模型组,差异有统计学意义(P均<0.01),与正常组比较无统计学意义(P均>0.05)。见表3。
表3 各组IL-8mRNA在绒毛、蜕膜组织相对含量比较()

表3 各组IL-8mRNA在绒毛、蜕膜组织相对含量比较()
与孕酮组比较*P<0.05 **P<0.01 #P>0.05
组别 绒毛组织 蜕膜组织孕酮组 61.28±4.13 72.14±3.04模型组 85.72±2.63** 82.23±4.11*正常组 58.33±2.87# 70.55±3.66#
3 讨论
目前,不明原因的自然流产已被公认为与机体的免疫因素有关,且Th1/Th2细胞因子平衡对正常妊娠是十分重要的。正常妊娠是以Th2型细胞因子为主的生理现象,当发生向Th1型细胞因子的偏离时,可能会导致自然流产[5-7]。IL是由多种细胞分泌的在免疫调节过程中起重要作用的细胞因子,国内外已有学者研究了自然流产患者血清或组织中IL-2、IL-4、IL-5、IL-6、IL-8、IL-10等的变化,但关于IL-8与自然流产的相关性研究的文献报道较少,Madhappan等[8]、Koumantaki等[9]以 及 国 内 学 者齐卫红[10]和黄江宁等[11]均是采用ELISA法检测反复自然流产患者血清IL-8的含量,且得出结论不一致。我们在前期工作中采用RT-PCR、Western blot和免疫组织化学染色技术在自然流产母胎界面进行研究,发现并报道:反复自然流产患者绒毛、蜕膜组织中IL-8mRNA和蛋白表达水平明显高于正常妊娠妇女,提示IL-8参与反复自然流产的病理过程。然而引发自然流产的免疫机制相当复杂,Th1/Th2型细胞因子间的平衡受多种因素的调控,如何调节正常的免疫平衡,维持正常妊娠的进行,减少流产的发生是关键,因此,有必要进一步研究引发自然流产的调节机制。
众所周知,蜕膜的正常生长和发育对妊娠的维持起着相当重要的作用,而孕酮是维持早孕期蜕膜正常形态和功能的必要激素。由于临床研究受到患者遗传背景、生活习惯、工作环境等诸多复杂因素的影响,而采用近交系小鼠可以排除混杂因素,CBA/J和DBA/2是较为常用的近交品系小鼠。CBA/J×DBA/2小鼠具有反复自然流产的特点,胚胎吸收率恒定于30%~45%,而CBA/J×BALB/c小鼠的胚胎吸收率仅为5%~10%。目前普遍认为,免疫因素是这一动物模型发生自然流产的主要原因,因此它们是用于研究母胎免疫调节机制较为理想的动物模型[12-13]。
ELISA实验结果表明:外源性给予黄体酮的自然流产小鼠,其血清孕酮水平明显升高,而IL-8水平明显降低,且血清孕酮、IL-8水平与正常组比较差异均无统计学意义。由此可见,孕酮对IL-8产生抑制作用,从而减少中性粒细胞侵入蜕膜组织,可以保证妊娠的顺利进行。同时,免疫组化染色和RTPCR结果显示:在绒毛组织中,外源性给予黄体酮的自然流产小鼠IL-8的蛋白和mRNA相对含量明显降低,与正常孕鼠比较无显著性差异;在蜕膜组织中,外源性给予黄体酮的自然流产小鼠IL-8蛋白和mRNA相对含量也降低,并接近正常孕鼠的水平。
因此推测,孕酮通过下调IL-8表达来减少自然流产的发生和发展,此研究可为防治反复自然流产提供一定的理论依据。
[1] Sereshki N,Gharagozloo M,Ostadi V,et al.Variations in T-helper 17and Regulatory T Cells during The Menstrual Cycle in Peripheral Blood of Women with Recurrent Spontaneous A-bortion[J].Int J Fertil Steril,2014,8(1):59-66.
[2] 廖义鸿,李红发.孕酮调节复发性流产患者淋巴细胞产生Th1、Th2因子及机制[J].中国优生与遗传杂志,2009,17(11)47-48.
[3] Fotiadou C,LazaridouE,Sotiriou E,et al.Spontaneous abortion during ustekinumab therapy[J].J Dermatol Case Rep,2012,6(4):105-107.
[4] Piccinni MP,Maggi E,Romagnani S.Role of hormone-controlled T-cell cytokines in the maintenance of pregnancy[J].Biochem Soc Trans,2000 ,28(2):212-215.
[5] Wang Y,Xu B,Li M,et al.IL-22secreted by decidual stromal cells and NK cells promotes the survival of human trophoblasts[J].Int J Clin Exp Pathol,2013,6(9):1781-1790.
[6] Liu F,Luo SP.Effect of Chinese herbal treatment on Th1-and Th2-type cytokines,progesterone and beta-human chorionic gonadotropin in early pregnant women of threatened abortion[J].Chin J Integr Med,2009 ,15(5):353-358.
[7] 郭畅,韩宝生,陆冬梅,等.IL-2受体和IL-6在复发性自然流产患者胚胎组织中的表达[J].中国妇幼保健,2009,24(27):3873-3874.
[8] Madhappan B,Kempuraj D,Christodoulou S,et al.High levels of intrauterine corticotropin-releasing hormone,urocortin,tryptase,and interleukin-8in spontaneous abortions[J].Endocrinol,2003,144(6):2285-90.
[9] Koumantaki Y,Matalliotakis I,Sifakis S,et al.Detection of interleukin-6,interleukin-8,and interleukin-11in plasma from women with spontaneous abortion[J].Eur J Obstet Gynecol Reprod Biol,2001,98(1):66-71.
[10] 齐卫红.反复自然流产患者外周血及母胎界面中白细胞介素10、8及肿瘤坏死因子-α的表达[J].生殖医学杂志,2007,16(1):52-53.
[11] 黄江宁,赵期菊,刘琼芬,等.孕妇IL-8、IL-10血清学水平与早期自然流产的相关性研究[J].中国优生与遗传杂志,2009,17(10):76-77.
[12] Clark DA,Chaouat G,Arck PC,et al.Cytokine-dependent abortion in CBA×DBA/2mice is mediated by the procoagulant fgl2prothrombinase[J].J Immunol,1998,160(2):545-549.
[13] Jiang PJ,Zhao AM,Bao SM,et al.Expression of chemokine receptors CCR3,CCR5and CXCR3on CD4(+)T cells in CBA/J×DBA/2mouse model,selectively induced by IL-4 and IL-10,regulates the embryo resorption rate[J].Chin Med J.2009,122(16):1917-1921.
