Ndrg1基因缺失对腰椎到骶椎结构转换的影响
2015-03-04陈慧慧郭熙志
陈慧慧 朱 煌 郭熙志
脊椎在整个躯干和头部支撑中扮演着非常重要的角色,且可为脊髓提供保护作用,并在前后轴方向上展示出区域性形态特征[1]。脊椎发育可分为早、晚期阶段,即前原节中胚层体节分割和脊椎特化[2]。前原节中胚层周期性分割信号转导通路包括成纤维细胞生长因子(FGF)、Wnt和 Notch信号转导通路[2-3],同时体节模式和形态变化也受Hox基因调控[4]。Hox基因由13个旁系同源基因线性排列组合而成,形成了体节特性的组合密码[4-7],其功能性缺失和功能获得性突变通常导致椎体同源转变缺陷[4,8]。
N-Myc下游调控基因家族(Ndrg1~4)属于α/β水解酶家族,其具有高度保守性[9]。人类Ndrg基因家族成员氨基酸序列具有53%~65%的相似性[10-11],但 Ndrg1和 Ndrg2蛋白因缺少水解酶催化位点而不具有水解酶催化活性[11]。研究报道,Ndrg1是肿瘤转移抑制基因,涉及胰腺癌、结肠癌、乳腺癌、子宫颈癌、卵巢癌和前列腺癌等发生[9,12-14],而 Ndrg2 是 一 种 肿 瘤 抑 制基因[10-11]。我们的前期研究表明,Ndrg2是体节分化过程中的一种新型脊椎特化调控因子[3],但Ndrg1基因在脊椎特化中的作用目前尚不清楚。本研究将重点分析Ndrg1-/-鼠的脊椎特性和结构,观察Ndrg1敲除对椎体同源转换的作用并探讨其发生机制,同时与Ndrg2在骨骼发育中的功能进行对照研究。
1 资料与方法
1.1 研究材料
Ndrg1fl/fl制备:采用靶向载体电转R1胚胎干细胞,转染过程使用G418抗生素,筛选具有G418抗性的胚胎干细胞克隆,并通过Sourthern免疫印迹确定正确靶向克隆;将经筛选的胚胎干细胞注射到囊胚中获得老鼠嵌合体,此即为 Ndrg1fl/fl鼠[3]。
将条件性敲除鼠与Actin-Cre鼠杂交以获得Ndrg1-/-、Ndrg2-/-鼠。Ndrg1等位基因缺失鉴定引物 为 P1(5’-AGCAGGCTCTTAAAGCGGCTCC-3’)、P2(5’-CCGCCTCTGTCAAATTAGTAGCTG-3’)、P3(5’-GGGAGAGCTGAAGGCTGTTCTAGG-3’),Ndrg2等位基因缺失鉴定引物为 P4(5’AAAAGCTCTCCGTGTGTCTTGGCGT-3’)、P5(5’GTCATTTGGGAGAATGGAGGAGGCA-3’)。所有小鼠均为C57BL/6小鼠。实验过程中严格遵照上海交通大学实验动物伦理法规。
1.2 实验方法
RNA原位杂交:采用地高辛标记的FGF-8基因探针[15-16]。自主合成 Ndrg1、Hoxc8、Hoxc11基因探针,Ndrg1、Hoxc8、Hoxc11 cNDA 模板引物分别为 (F)5’AGTCTACTAGGCTCACTTGAAG-GAA、(R)5’CACGGTAGGAGTTGGCAGGAA,(F)5’TCTTCACGGTGCTTCTCTGGTAT、(R)5’GGCTAGGCAGTCTCAGTTGTTG,(F)5’GGCCTGGAACCGTCCGGGAAGTG、(R)5’TT-GGTCGCCGAGTGGGAAGAACC。其余基因探针完全以 Hoxc9(BC050838)、Hoxc10(BC053405)cDNA克隆为模板。
实时定量聚合酶链式反应(qRT-PCR):收集10.5 d的 Ndrg1-/- 鼠胚胎及其同窝小鼠,10.5 d时应用一步法从后面体节到第12块体节抽提总RNA,采用qRT-PCR技术检测相关基因表达情况。Ndrg1 引 物 为 (F)5’GGTGAAGCCTCTGGTG-GAAAAAG、(R)5’GTGAGGATGACAGGACG-GTTGC,Hoxc8引物为(F)5’GTCCATGCCTTC-CTTGCCTTG、(R)5’ATGGTGACTTCTGAG-CACAAACA,Hoxc9 引 物 为 (F)5’TGTAG-CGATTTTCCGTCCTGTAG、(R)5’CCGTA-AGGGTGATAGACCACAGA,Hoxc10 引 物 为(F)5’GGGCCAAGACCGCAGACT、(R)5’GC-CAATTTCCTGTGGTGTTTTC,Hoxc11引物为(F)5’GCGGCCGACGAGCTTATG、(R)5’TTTTTCATGAGGATCTCAGTGACTGT。基因组DNA来源于野生型小鼠鼠尾。
骨架染色:出生后6 d的 Ndrg1-/-和Ndrg1/2-/-鼠窒息处死后,去除皮肤、内脏及结缔组织,进行阿尔新蓝和茜素红染色[17]。
2 结果
2.1 Ndrg1在不同体节中的表达
为了检测Ndrg1在体节发生过程中的表达情况,我们通过使用地高辛标记的Ndrg1、Ndrg2和FGF-8探针对10.5 d的胚胎进行整体原位杂交实验,结果表明胚胎期10.5 d Ndrg1在颈椎和胸椎体节处显著表达,在腰椎和骶椎体节处表达较弱(图1a),而Ndrg2则在腰椎和骶椎体节处表达较强,在颈椎和胸椎体节处表达较弱(图1b)。在该阶段,Ndrg1并未在肢芽由FGF-8标记的前原节中胚层中出现(图1c)。总体上,在体节中Ndrg1表达部分与Ndrg2叠加,但又与Ndrg2表达有明显区别。
2.2 Ndrg1缺失对腰椎至骶椎同源转换的影响
为了获得Ndrg1-/-鼠,我们引进了携带条件性等位基因Ndrg1fl/fl的小鼠。该等位基因在第1个外显子两边插入Loxp片段及pGKneo筛选基因(图2a)。我们将携带条件性等位基因Ndrg1fl/fl的小鼠与Actin-Cre转基因小鼠杂交。经过几个步骤的回交,得到Ndrg1-/-鼠(图2b)。杂合子和基因敲除小鼠可以通过引物P1/P2/P3进行基因型鉴定(图2c)。通过qRT-PCR测试,Ndrg1基因敲除率达到90%左右(图2d)。Ndrg1-/-鼠是可育的,且无明显生长缺陷。然而,Ndrg1-/-鼠在腰椎至骶椎的过渡区域出现同源转换(下页图3)。在野生型鼠中,中轴骨常由7块颈椎(C1~C7)、13块胸椎(T1~T13)、6块腰椎(L1~L6)、4块骶椎(S1~S4)和一定数量的尾椎组成。Ndrg1-/-鼠颈椎、胸椎和尾椎的数量和组织排列与野生型鼠相同,但其L6形态与野生型鼠S1部分相似,出现不同程度的L6~S1同源转换(下页图3)。
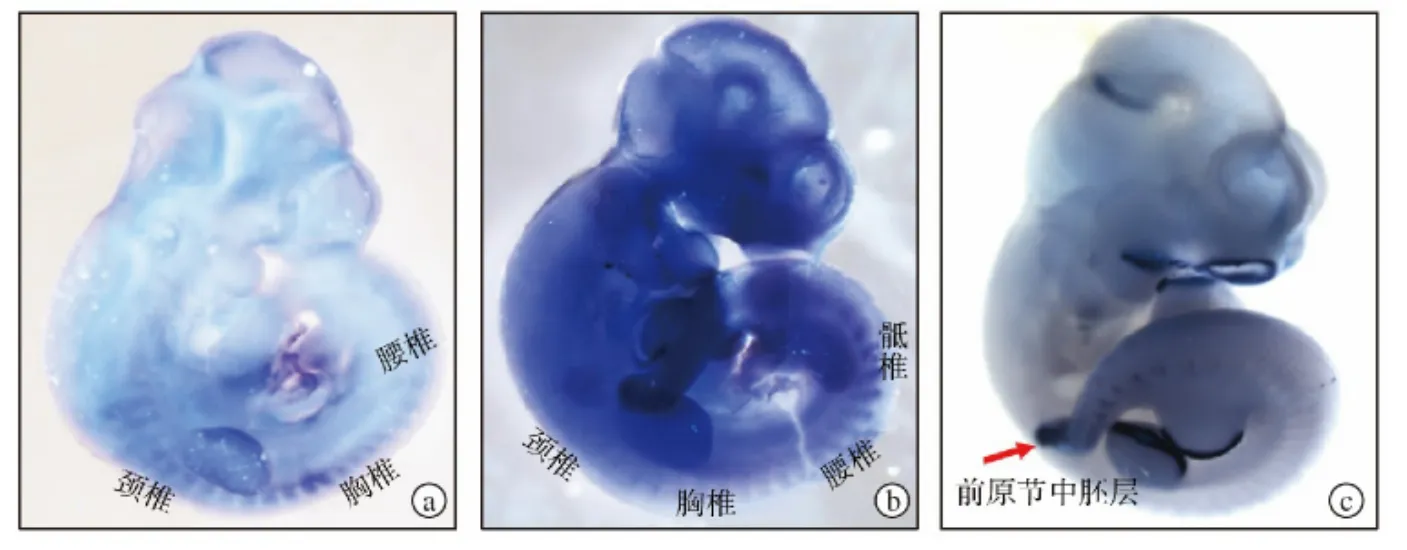
图1 胚胎期10.5 d Ndrg1、Ndrg2在分化体节中的表达 a.Ndrg1在颈椎和胸椎体节处表达水平较高 b.Ndrg2在腰椎和骶椎体节处表达水平较高 c.由FGF-8标记的前原节中胚层
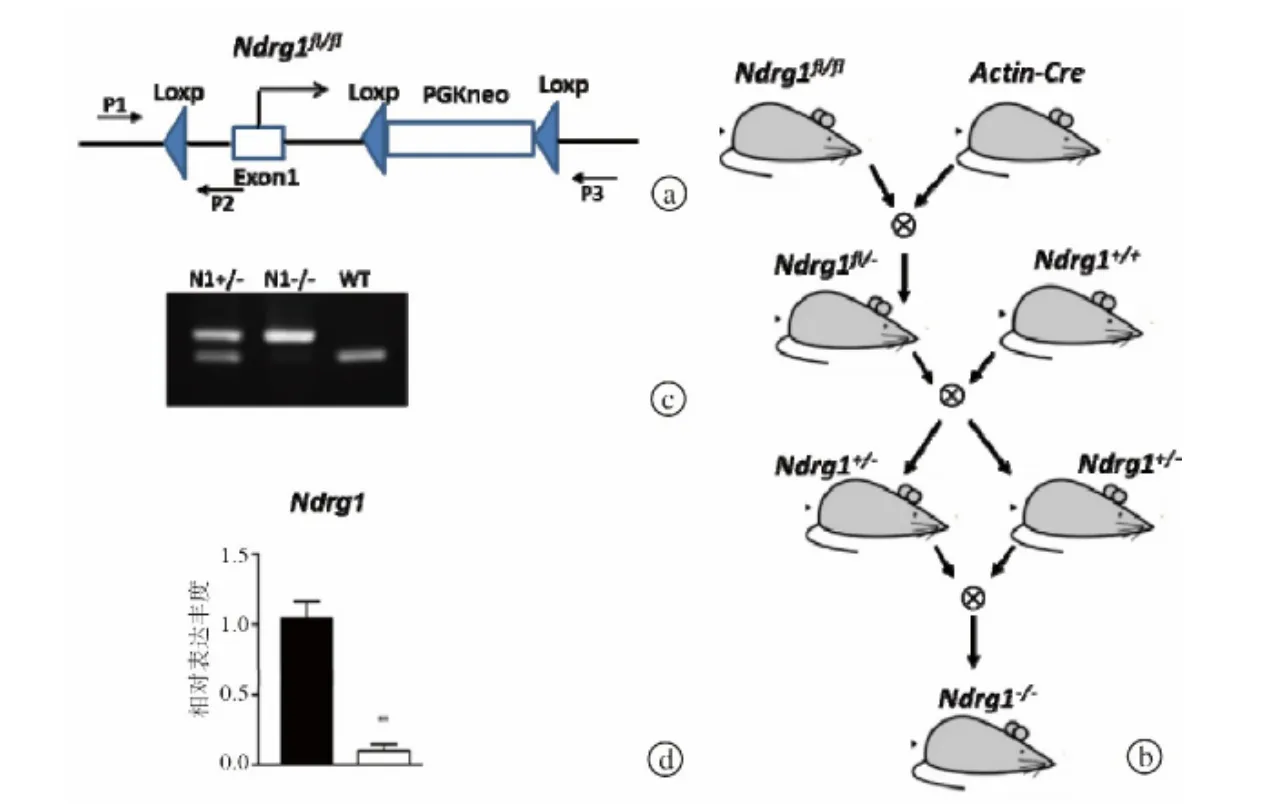
图2 Ndrg1-/-鼠制备和基因型鉴定 a.Ndrg1fl/fl等位基因结构,Loxp位点被插入第1外显子Ndrg1启动子上游和转录起始位点下游 b.Ndrg1-/-鼠由Ndrg1fl/fl鼠于Actin-Cre鼠杂交获得 c.野生型鼠和Ndrg1-/-鼠基因型鉴定 d.采用qRT-PCR分析Ndrg1基因敲除率
我们的前期研究显示,Ndrg2-/-鼠也出现与Ndrg1-/-鼠类似的 L6~S1同源转换。此外,Ndrg2-/-鼠在T9~T10、T13~L1和S4~C1过渡区域也发生椎体同源转换。为了检测Ndrg1和Ndrg2在体节特化过程中是否有叠加作用,我们比较了 Ndrg1/2-/- 鼠和 Ndrg1-/- 鼠的椎体结构,结果显示在Ndrg1/2-/-鼠L6~S1存在相似的椎体同源 转 换,但 Ndrg1/2-/- 鼠 与 Ndrg1-/- 鼠、Ndrg2-/-鼠相比并无额外的缺陷(图2),或者说,Ndrg1/2-/-鼠除 L6~S1椎体同源转换外,Ndrg1缺失反而弥补了Ndrg2缺失引起的T13~L1和S4~C1区域椎体同源转变。
2.3 Ndrg1缺失与 Hoxc8-11基因表达

图3 Ndrg1-/-、Ndrg1/2-/-鼠椎体同源转换 a~d1.腰椎和骶椎背视图,包括野生型鼠腰椎(a)和骶椎 (a1)、中度突变Ndrg1-/-鼠腰椎(b)和骶椎 (b1)、严重突变 Ndrg1-/-鼠腰椎(c)和骶椎 (c1)、Ndrg1/2-/-鼠腰椎(d)和骶椎 (d1) e.L1~S2椎体背视图,其中*表示发生转变的椎体,在Ndrg1-/-、Ndrg1/2-/-鼠中L6的结构与S1的结构相似(红色箭头指示),所有骨架均于出生后6 d收集(其中 Ndrg1-/-鼠10只,Ndrg1/2-/- 鼠6只)
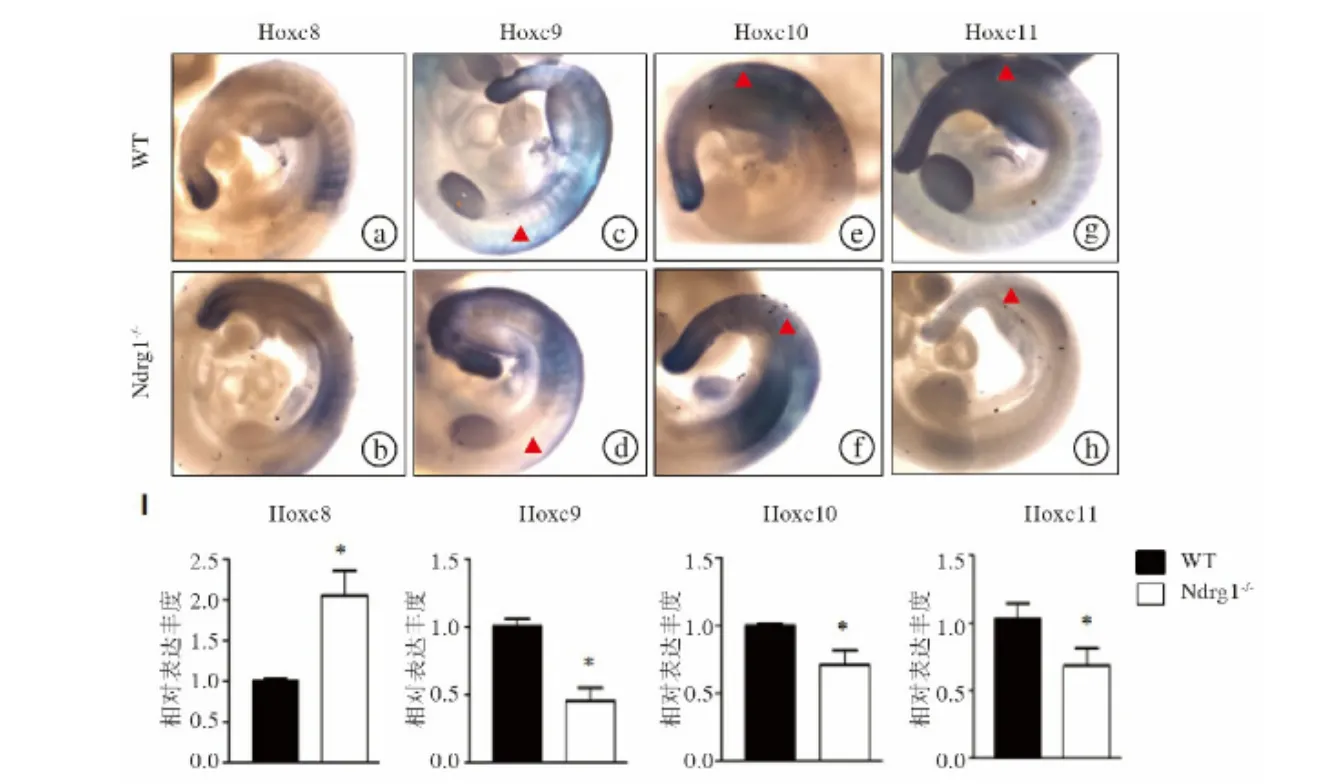
图4 Ndrg1-/-鼠胚胎中Hoxc8~11基因表达情况 a~h.应用整体原位杂交技术检测胚胎期10.5 d Ndrg1-/-鼠Hoxc8~11基因表达,其中△表示体节处基因表达明显改变(n=3) i.经qRT-PCR技术检测显示,与对照组相比,胚胎期10.5 d Ndrg1-/-鼠后面体节Hoxc8表达水平下降,而Hoxc9~11基因表达水平上升 (n=3)(平均值±标准差,以β-actin基因为内参范围)
为了探索Ndrg1-/-鼠中椎体同源转换的分子机制,我们应用整体胚胎原位杂交和qRT-PCR技术检测胚胎期10.5 d Ndrg1-/-鼠 Hoxc8、Hoxc9、Hoxc10和Hoxc11表达模式,结果显示10.5 d的胚胎从颈椎至尾椎体节经历着成骨、成软骨分化,与对照组相比,Ndrg1-/-鼠Hoxc8表达水平增加,而Hoxc9、Hoxc10和Hoxc11表达水平却有所下降(图4),表明Ndrg1至少部分通过调节Hoxc8~11基因表达水平来调控椎体特化。
3 讨论
Ndrg1是肿瘤转移抑制基因,涉及多种癌症发生发展[9,12-14]。在 临 床 上,目前尚 无 关 于 Ndrg1 基因表达缺陷与脊柱疾病等方面的报道。
在此项研究中,我们通过使用Ndrg1-/-鼠来研究Ndrg1基因在调控椎体特化过程中的功能,Ndrg1和Ndrg2的表达在分化体节中部分重叠,但与Ndrg2相比,Ndrg1在前部体节中表达水平较高;Ndrg1-/-鼠和 Ndrg2-/-鼠均出现腰椎与胸椎过渡区域L6~S1椎体同源缺陷;在脊椎发育过程中,Ndrg1-/-鼠的缺陷表型不及 Ndrg2-/-鼠明显,Ndrg1/2-/-鼠椎体特化缺陷与 Ndrg1-/-鼠一致,Ndrg2-/-鼠其他椎体缺陷如T13~L1和S3~S4过渡区域椎体同源转变在Ndrg1/2-/-鼠中并未发现,也可以说,Ndrg1的缺失部分挽救了Ndrg2-/-鼠表型。总的来说,虽然Ndrg1的表达谱及功能与Ndrg2部分相似,但两者的作用不具有冗余性。
研究[18]报道,Hox基因簇的重要标志之一是它们在染色体上的线性排列与其在早期发育中的表达时间点和前后轴边界直接相关。椎体同源转换通常与Hox基因表达边界改变有关。Ndrg1-/-鼠椎体同源转换与Hoxc8~11基因表达水平改变有关。与对照组相比,Ndrg1-/-鼠胚胎体节中 Hoxc8表达水平升高,而Hoxc9~11表达水平下降。而体节中Hoxc8或Hoxc9基因的缺失会导致L1~T13及T10~T13过渡区域椎体同源转换[8,19],但这些表型均未在 Ndrg1-/-鼠中观察到。然而,Hoxc10、Hoxc11缺失鼠表现出与Ndrg1-/-鼠和Ndrg2-/-鼠一些相似的椎体同源转换[20-21]。值得注意的是,在Ndrg1-/-鼠体节中检测到的是Hoxc8~11转录水平的改变,而非表达边界的改变。Hox基因表达边界大多先于体 节分割[4,22-23]。因此,我们推测Hox基因表达水平的组合改变即使不是唯一,也能部分解释Ndrg1-/-鼠中的椎体同源转换。
总之,这些结果表明Ndrg1基因部分通过调节Hoxc8~11基因表达水平调控腰椎和胸椎过渡区域椎体同源转换。值得注意的是,Ndrg1基因在前部体节中表达较高,但其功能却在后部体节如腰、骶椎中更显著。这提示,在椎体分化早期阶段,Ndrg1可能与其他调控子一起发挥作用。在脊椎发育过程中,Ndrg基因家族其他成员如Ndrg3、Ndrg4也在体节和尾牙处有表达[24]。然而,目前还没有关于Ndrg3-/-、Ndrg4-/-小鼠在脊椎发育过程中相关功能的报道,关于Ndrg1、Ndrg3、Ndrg4在椎体特化过程中是否相互作用,仍需进一步研究。
[1] Burke AC,Nelson CE,Morgan BA,et al.Hox genes and the evolution of vertebrate axial morphology [J].Development,1995,121(2):333-346.
[2] Baker RE,Schnell S,Maini PK.A clock and wavefront mechanism for somite formation[J].Dev Biol,2006,293(1):116-126.
[3] Zhu H,Zhao J,Zhou W,et al.Ndrg2 regulates vertebral specification in differentiating somites[J].Dev Biol,2012,369(2):308-318.
[4] Alexander T, Nolte C,Krumlauf R. Hox genes and segmentation of the hindbrain and axial skeleton[J].Annu Rev Cell Dev Biol,2009,25:431-456.
[5] Lee JY,Min H,Wang X,et al.Chromatin organization and transcriptional activation of Hox genes[J].Anat Cell Biol,2010,43(1):78-85.
[6] Kong KA,Yoon H,Kim MH.Akt1 as a putative regulator of Hox genes[J].Gene,2013,513(2):287-291.
[7] Kong KA,Lee JY,Oh JH,et al.Akt1 mediates the posterior Hoxc gene expression through epigenetic modifications in mouse embryonic fibroblasts[J].Biochim Biophys Acta,2014,1839(9):793-799.
[8] Wellik DM.Hox patterning of the vertebrate axial skeleton[J].Dev Dyn,2007,236(9):2454-2463.
[9] Kovacevic Z,Richardson DR.The metastasis suppressor,Ndrg-1:a new ally in the fight against cancer[J].Carcinogenesis,2006,27(12):2355-2366.
[10] Yao L,Zhang J,Liu X.NDRG2:a Myc-repressed gene involved in cancer and cell stress[J].Acta Biochim Biophys Sin(Shanghai),2008,40(7):625-635.
[11] Hwang J,Kim Y,Kang HB,et al.Crystal structure of the human N-Myc downstream-regulated gene 2 protein provides insight into its role as a tumor suppressor[J].J Biol Chem,2011,286(14):12450-12460.
[12] Ellen TP,Ke Q,Zhang P,et al.NDRG1,agrowth and cancer related gene:regulation of gene expression and function in normal and disease states[J].Carcinogenesis,2008,29(1):2-8.
[13] Fotovati A,Abu-Ali S,Sugita Y,et al.Expression of N-myc downstream regulated gene 1 (NDRG1)in central neurocytoma[J].J Clin Neurosci,2011,18(10):1383-1385.
[14] Fang BA,Kovacevic Z,Park KC,et al.Molecular functions of the iron-regulated metastasis suppressor,NDRG1,and its potential as a molecular target for cancer therapy[J].Biochim Biophys Acta,2014,1845(1):1-19.
[15] Guo X,Day TF,Jiang X,et al.Wnt/beta-catenin signaling is sufficient and necessary for synovial joint formation[J].Genes Dev,2004,18(19):2404-2417.
[16] Liu W,Xing F,Iiizumi-Gairani M,et al.N-myc downstream regulated gene 1 modulates Wnt-beta-catenin signalling and pleiotropically suppresses metastasis[J].EMBO Mol Med,2012,4(2):93-108.
[17] Zhu X,Zhu H,Zhang L,et al. Wls-mediated Wnts differentially regulate distal limb patterning and tissue morphogenesis[J].Dev Biol,2012,365(2):328-338.
[18] Ikeya M, Takada S. Wnt-3a is required for somite specification along the anteroposterior axis of the mouse embryo and for regulation of cdx-1 expression[J].Mech Dev,2001,103(1-2):27-33.
[19] Suemori H,Takahashi N,Noguchi S.Hoxc-9 mutant mice show anterior transformation of the vertebrae and malformation of the sternum and ribs[J].Mech Dev,1995,51(2-3):265-273.
[20] Hostikka SL, Gong J, Carpenter EM. Axial and appendicular skeletal transformations,ligament alterations,and motor neuron loss in Hoxc10 mutants[J].Int J Biol Sci,2009,5(5):397-410.
[21] Wellik DM,Capecchi MR.Hox10 and Hox11 genes are required to globally pattern the mammalian skeleton[J].Science,2003,301(5631):363-367.
[22] Forlani S,Lawson KA,Deschamps J.Acquisition of Hox codes during gastrulation and axial elongation in the mouse embryo[J].Development,2003,130(16):3807-3819.
[23] Iimura T,Pourquie O.Collinear activation of Hoxb genes during gastrulation is linked to mesoderm cell ingression[J].Nature,2006,442(7102):568-571.
[24] Okuda T,Kondoh H.Identification of new genes ndr2 and ndr3 which are related to Ndr1/RTP/Drg1 but show distinct tissue specificity and response to N-myc[J].Biochem Biophys Res Commun,1999,266(1):208-215.
