H2O2、LPS和TNF-α诱导人类脐静脉内皮细胞损伤的实验研究
2015-03-27娄振凯罗旺李兴国赵学凌王兵
娄振凯 罗旺 李兴国 赵学凌 王兵
H2O2、LPS和TNF-α诱导人类脐静脉内皮细胞损伤的实验研究
娄振凯 罗旺 李兴国 赵学凌 王兵
目的 探讨人类脐静脉内皮细胞损伤模型建立方法,为体外研究血管内皮细胞提供实验基础。方法 分离培养人类脐静脉内皮细胞,分别采用不同浓度的过氧化氢(H2O2)、脂多糖(LPS)、肿瘤坏死因子(TNF)-α刺激细胞,孵育不同时间后,采用四甲基偶氮唑盐(MTT)法检测细胞活力(OD值)。结果 各浓度H2O2损伤组较对照组OD值显著降低(P<0.01),不同浓度H2O2损伤组间OD值无统计学差异(P>0.05)。0.1 μg/mL LPS损伤组与对照组OD值无统计学差异(P>0.05);其余各浓度LPS损伤组较对照组OD值显著降低(P<0.05),且LPS浓度在一定范围内,OD值随LPS浓度的增加及作用时间的延长而降低,具有一定的浓度与时间依赖性。各浓度TNF-α损伤组较对照组OD值显著降低(P<0.01),且TNF-α浓度在一定范围内,OD值随TNF-α浓度的增加及作用时间的延长而降低,具有一定的浓度与时间依赖性。结论 H2O2、LPS和TNF-α能体外损伤人类脐静脉内皮细胞,成功建立人类脐静脉内皮细胞损伤模型,且在一定浓度范围内各损伤因子对人类脐静脉内皮细胞损伤程度呈浓度和时间依赖性。
过氧化氢;脂多糖;肿瘤坏死因子-α;人类脐静脉内皮细胞
深静脉血栓(DVT)是血液在深静脉内不正常凝结引起的静脉回流障碍性疾病,多发生于下肢[1]。血栓脱落可引起肺动脉栓塞(PE),是骨科围手术期死亡的主要原因之一,也是医院内非预期死亡的重要原因[2]。氧化应激、脂质过氧化及炎症反应是诱导静脉内皮细胞损伤、活化、黏附,促使凝血与抗凝、纤溶与抗纤动态失衡,从而促进DVT形成的重要原因。但其具体信号转导及分子调控机制尚不完全清楚,缺乏可靠、稳定的体外研究模型是主要原因之一。为此,本研究采用过氧化氢(H2O2)、脂多糖(LPS)和肿瘤坏死因子(TNF)-α诱导人类脐静脉内皮细胞损伤以建立静脉内皮细胞损伤模型,旨在为体外研究静脉内皮细胞结构和功能变化提供实验依据。
1 材料与方法
1.1 实验细胞及试剂
人类脐静脉内皮细胞由江阴齐式生物技术有限公司提供。实验试剂包括0.25%的乙二胺四乙酸(EDTA)-胰酶(Hyclone公司)、高糖Dulbecco改良的Eagle培养基(DMEM)(Hyclone公司)、四甲基偶氮唑盐(MTT)溶液。
1.2 实验方法
1.2.1 细胞传代培养
弃去培养液,用0.25% EDTA-胰酶对人类脐静脉内皮细胞在37℃下消化1 min,小心吸出胰酶,加入新鲜的高糖DMEM培养基终止胰酶反应并反复吹打直至细胞脱落分散,将细胞悬液分别接种于3个培养瓶中,补充培养基至每瓶4 ml,37℃、5% CO2培养箱中静置培养。
1.2.2 建立人类脐静脉内皮细胞损伤模型
将培养的人类脐静脉内皮细胞浓度调至2×104个/mL,接种于3个96孔培养板上,每孔100 μL,第1个培养板随机分成8组,每组取3个孔,即0 μmol/L H2O2组(对照组)、20 μmol/L H2O2损伤组、40 μmol/L H2O2损伤组、60 μmol/L H2O2损伤组、80 μmol/L H2O2损伤组、200 μmol/L H2O2损伤组、400 μmol/L H2O2损伤组、1 000 μmol/L H2O2损伤组,孵育4、12、24 h后,采用MTT法检测各组细胞活性。用上述同样方法,第2个培养板随机分成7组,每组取3个孔,即0 μg/mL LPS组(对照组)、0.1 μg/mL LPS损伤组、1 μg/mL LPS损伤组、5 μg/mL LPS损伤组、10 μg/mL LPS损伤组、20 μg/mL LPS损伤组、50 μg/mL LPS损伤组,孵育4、12、24 h后,采用MTT法检测各组细胞活性。用上述同样方法,第3个培养板随机分成8组,每组取3个孔,即0 ng/mL TNF-α组(对照组)、5 ng/mL TNF-α损伤组、10 ng/mL TNF-α损伤组、20 ng/mL TNF-α损伤组、40 ng/mL TNF-α损伤组、60 ng/mL TNF-α损伤组、80 ng/mL TNF-α损伤组、100 ng/mL TNF-α损伤组,孵育4、12、24 h后,采用MTT法检测各组细胞活性。
1.2.3 MTT检测
采用5 mL MTT溶剂溶解25 mg MTT,配制成MTT溶液5 mg/mL。每孔加入10 μL MTT溶液,在细胞培养箱内继续孵育4 h。每孔加入100 μL Formanzan溶解液,在细胞培养箱内继续孵育,直至在普通光学显微镜下观察发现Formazan溶解液全部溶解。在酶联免疫检测仪OD 490 nm处测量各孔吸光值(OD值)。
1.3 统计学方法
采用SPSS 17.0软件进行统计学分析,实验数据以均值±标准差表示,采用方差分析及SNK法进行统计学处理。P<0.05为差异有统计学意义。
2 结果
2.1 H2O2对人类脐静脉内皮细胞活力的影响
各浓度H2O2损伤组OD值较对照组明显降低(P<0.01),各浓度H2O2损伤组不同作用时间点OD值无统计学差异(P>0.05)(图1)。

图1 不同浓度H2O2在不同作用时间点对人类脐静脉内皮细胞活力的影响
2.2 LPS对人类脐静脉内皮细胞活力的影响
除0.1 μg/mL LPS损伤组与对照组OD值无统计学差异(P>0.05)外,其余各浓度LPS损伤组OD值较对照组显著降低(P<0.05);LPS浓度为1~10 μg/mL时,随着LPS浓度的增加OD值呈降低趋势(P<0.05);作用时间为4~12 h时,随着作用时间的延长,各浓度LPS损伤组OD值呈降低趋势(P<0.05)(图2)。因此,在一定范围内,LPS对人类脐静脉内皮细胞损伤呈浓度与时间依赖性。
2.3 TNF-α对人类脐静脉内皮细胞活力的影响
各浓度TNF-α损伤组较对照组OD值明显降低(P<0.01)。TNF-α浓度为5~60 ng/mL时,随着TNF-α浓度的增加,OD值呈降低趋势(P<0.05);作用时间为12~24 h时,随着作用时间的延长,各浓度TNF-α损伤组OD值呈降低趋势(P<0.05)(图3)。因此,在一定范围内,TNF-α对人类脐静脉内皮细胞损伤呈浓度与时间依赖性。

图2 不同浓度LPS在不同作用时间点对人类脐静脉内皮细胞活力的影响
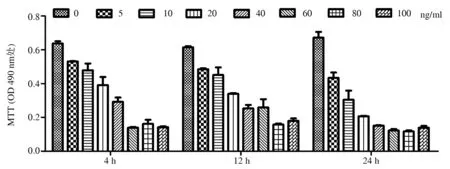
图3 不同浓度TNF-α在不同作用时间点对人类脐静脉内皮细胞活力的影响
3 讨论
DVT是骨科最常见的并发症,美国每年DVT和PE患病率约为35万~60万,我国每年约为1 000万[3]。创伤或骨科大手术后DVT发生率高达40%~85%,其中髋关节置换术后DVT发生率约为42%~57%,膝关节置换术后DVT发生率约为41%~85%,髋部骨折手术后DVT发生率约为46%~60%[4]。全球每年因DVT死亡的人数超过1 500万,我国约为100万[3],死亡原因主要为PE。然而,目前DVT的诊断主要依靠临床症状、体征、影像学检查和实验室检查相结合,待血栓形成才能明确诊断,无法早期预测诊断,难以及时有效防治。究其原因,DVT形成受多因素、复杂机制调控, 具体分子机制仍不完全清楚,其机制可能包括致病基因(基因缺陷),基因突变及基因间相互影响、炎症反应中细胞因子相互作用,凝血(抗凝)、纤溶(抗纤)、血小板、血管内皮细胞功能异常等,其中氧化应激、脂质过氧化和炎症反应等假说是目前研究的热点,而血管内皮细胞在DVT形成过程中起至关重要的作用。因此,建立稳定、可靠的血管内皮细胞损伤模型是体外研究DVT形成分子机制的先决条件。目前主要有3种建立静脉内皮细胞损伤模型的方法,即分别采用不同浓度的H2O2、LPS、TNF-α刺激内皮细胞,根据实验要求选用最合适的模型[5-7]。本实验分别采用不同浓度梯度的H2O2、LPS、TNF-α分别与人类脐静脉内皮细胞作用不同时间以建立静脉内皮细胞损伤模型,为体外研究静脉内皮细胞在DVT发病机制中的作用提供实验依据。
本实验结果显示各浓度H2O2损伤组人类脐静脉内皮细胞活力较对照组明显降低,且H2O2与人类脐静脉内皮细胞活力无浓度和作用时间依赖性。刘立新等[8]研究显示,H2O2能诱导人类脐静脉内皮细胞损伤,且随着H2O2浓度的增加,内皮细胞凋亡率也增加,在一定范围内呈量-效关系。该研究结果与本实验研究结果有差异,这可能与实验试剂、方法及所用的实验仪器有关。本实验所采用的H2O2浓度为20~400 μmol/L,作用时间为4、12、24 h,与Uberti等[9]的研究(H2O2浓度为200 μmol/L)有共同之处,但与Chen等[10](H2O2浓度为500 μmol/L)、Wang等[11](H2O2浓度为2 mmol/L)的研究有所差别。而本研究证实,静脉内皮细胞损伤程度与H2O2无浓度和作用时间依赖性。
本实验结果显示,在一定范围内随着LPS、TNF-α浓度的增加及作用时间的延长,静脉内皮细胞活力降低,静脉内皮细胞损伤程度与LPS、TNF-α呈一定的浓度与时间依赖性。本实验所选用的LPS浓度为0.1~50 μg/mL,TNF-α浓度为5~100 ng/mL,作用时间均为4、12、24 h,与Wu 等[12](LPS浓度为1 ng/mL,作用时间为4 h)、Li等[13](LPS浓度为0.2 ng/mL,作用时间为24 h)和吕自明等[14](TNF-α浓度梯度为5~80 ng/mL,作用时间为4 h)、Li等[15](TNF-α浓度为10 ng/mL,作用时间为4 h)建立此模型所选择的浓度和时间有共同之处。本实验的优点为充分考虑了诱导剂浓度及作用时间对此模型的影响。然而,本研究也存在一些不足,若要想尽可能减小实验误差,应选取更多的浓度梯度与不同作用时间及采用更多的方法检测细胞活力和细胞凋亡程度,并对其结果进行综合分析。
综上所述,本研究证实不同浓度的诱导剂及与人类脐静脉内皮细胞作用不同时间所建立的人类脐静脉内皮细胞损伤模型是有差异的,因此在建立此模型时,应综合考虑该试剂的浓度及与细胞作用的时间,尽可能选用不同原理的仪器对细胞进行活力检测和凋亡率测定,从而选择较好的模型。
[ 1 ] Myers T. Mosby’s Dictionary of Medicine, Nursing & Health Professions[M]. 7th ed, St Louis: Mosby, 2006:115-116,335,520,1454,1849,1949.
[ 2 ] 中华医学会骨科学分会. 中国骨科大手术静脉血栓栓塞症预防指南[J]. 中华关节外科杂志(电子版), 2009, 3(3):380-383.
[ 3 ] 付妍,王大为. 血栓栓塞性疾病的急诊治疗和预防[J]. 中国临床医生, 2006, 34(11):52-53.
[ 4 ] Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy[J]. Chest, 2004, 126(3 Suppl):338S-400S.
[ 5 ] 蒲丽娟,刘义. 对乙酰氨基酚对过氧化氢诱导的人脐静脉内皮细胞损伤的保护作用[J]. 中国动脉硬化杂志, 2009, 26(9):714-718.
[ 6 ] Li ZL, Liu JC, Hu J, et al. Protective effects of hyperoside against human umbilical vein endothelial cell damage induced by hydrogenperoxide[J]. J Ethnopharmacol, 2012, 139(2):388-394.
[ 7 ] 李辉. miRNA-720对TNF-α诱导的人脐静脉内皮细胞凋亡的作用与机制[D]. 中南大学, 2013.
[ 8 ] 刘立新,韩柏,王迪浔,等. 过氧化氢诱导人脐静脉内皮细胞株的凋亡及其调控的研究[J]. 中华实验外科杂志, 2001, 18(4):340-342.
[ 9 ] Uberti F, Lattuada D, Morsanuto V, et al. Vitamin D protects human endothelial cells from oxidative stress through the autophagic and survival pathways[J]. J Clin Endocrinol Metab, 2014, 99(4):1367-1374.
[10] Chen S, Tang Y, Qian Y, et al. Allicin prevents H2O2-induced apoptosis of HUVECs by inhibiting an oxidative stress pathway[J]. BMC Complement Altern Med, 2014, 30(14):321.
[11] Wang Y, Bu W, Xie H, et al. Protective effects of soybean isoflavone on human umbilical vein endothelial cell injury induced by H?O? and lipopolysaccharide[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2014, 42(2):150-155.
[12] Wu J, Li X, Huang L, et al. HSPA12B inhibits lipopolysaccharide-induced inflammatory response in human umbilical vein endothelial cells[J]. J Cell Mol Med, 2015, 19(3):544-554.
[13] Li W, Sun W, Yang CH, et al. Tanshinone Ⅱ a protects against lipopolysaccharides-induced endothelial cell injury via Rho/Rho kinase pathway[J]. Chin J Integr Med, 2014, 20(3):216-223.
[14] 吕自明,刘映峰,缪绯,等. TNF-α对人脐静脉内皮细胞活性及PD-L1蛋白表达的影响[J]. 热带医学杂志, 2013, 13(6):691-694.
[15] Li S, Xu J, Yao W, et al. Sevoflurane pretreatment attenuates TNF-α-induced human endothelial cell dysfunction through activating eNOS/NO pathway[J]. Biochem Biophys Res Commun, 2015, [Epub ahead of print].
(收稿:2015-03-27;修回:2015-04-28)
(本文编辑:卢千语)
H2O2、LPS and TNF-α induced injury of human umbilical vein endothelial cells
LOU Zhen-kai, LUO Wang, LI Xing-guo, ZHAO Xue-ling, WANG Bing. Department of Orthopaedics, the First Affiliated Hospital of Kunming Medical University, Kunming 650032, China
WANGBingE-mail:wbdoctor@hotmail.com
Objective To investigate the method of establishing human umbilical vein endothelial cells (HUVECs) injury model, and to provide experimental basis for the research of vascular endothelial cells in vitro. Methods HUVECs were separated and cultured, the hydrogen peroxide (H2O2), lip polysaccharide (LPS) and tumor necrosis factor-alpha (TNF-α) with different concentrations were used to induce the cell damage. MTT assay was used to determine the vitality of cells (OD value)at different time interval. Results OD value of H2O2damage groups was significantly lower than that of normal control group (P<0.01). No significant differences were found among H2O2damage groups (P>0.05). No significant differences were found between 0.1 μg/mL LPS damage group and normal control group (P>0.05). OD value of the other LPS damage groups was significantly lower than that of normal control group (P<0.05). The effect of LPS on HUVECs was time and concentration dependent within a certain range. OD value of TNF-α damage groups was significantly lower than that of normal control group (P<0.01). The effect of TNF-α on HUVECs was time and concentration dependent within a certain range. Conclusion The injury model of HUVECs could be induced by H2O2, LPS and TNF-α in vitro.
Hydrogen peroxide;Lip polysaccharide;Tumor necrosis factor-alpha;Human umbilical vein endothelial cell
国家自然科学基金(81160236)
650032, 昆明医科大学第一附属医院骨科
王兵 E-mail: wbdoctor@hotmail.com
10.3969/j.issn.1673-7083.2015.03.010
