负载rhBMP-2钙磷硅基活性骨修复材料的3D打印构建及生物学性能研究
2015-03-27李翠笛陈芳萍王金武戴尅戎刘昌胜
李翠笛 陈芳萍 王金武 戴尅戎 刘昌胜
·实验研究·
负载rhBMP-2钙磷硅基活性骨修复材料的3D打印构建及生物学性能研究
李翠笛 陈芳萍 王金武 戴尅戎 刘昌胜
目的 构建一种新型钙磷硅基活性骨修复材料,研究材料成分、孔道结构和是否负载生长因子对支架力学性能、细胞黏附性能和骨组织形成过程的影响。方法 以磷酸钙骨水泥(CPC)、介孔硅酸钙(MCS)为原料,采用3D打印技术构建不同孔道结构的MCS/CPC复合支架,在扫描电子显微镜下观察支架内部孔道结构,通过万能力学试验机测试各组支架的最大抗压力学性能,用四甲基偶氮唑盐法测试各组支架的细胞黏附性能。建立大鼠颅骨原位缺损修复模型,在支架上负载重组人骨形态发生蛋白(rhBMP)-2制备得到钙磷硅基活性多孔支架(MCS/CPC/rhBMP-2),考察CPC、MCS/CPC和MCS/CPC/rhBMP-2支架的组织相容性与成骨性能。结果 采用3D打印技术能够实现对钙磷硅基骨修复支架内部孔道结构的可控制备。垂直孔设计大小为350 μm 的MCS/CPC支架具有适宜的孔隙率和抗压力学强度(分别为56.6%和9.8 MPa);细胞相容性良好,有利于细胞黏附。负载rhBMP-2可显著加快新生骨组织形成,植入MCS/CPC/rhBMP-2复合支架初期纤维组织即可在连通孔道中自由生长,在植入12周后,MCS/CPC/rhBMP-2支架新生骨面积明显高于CPC和MCS/CPC支架,且新生骨组织形成过程与颅骨膜内成骨过程相似,具有一定的仿生效应。结论 采用3D打印法制备的MCS/CPC/rhBMP-2支架材料具有规则的连通孔道,力学性能良好,促进成骨效果优异,是理想的新型骨缺损修复材料。
骨修复材料;介孔材料;硅酸钙;3D打印
创伤、感染、肿瘤、先天畸形等因素造成的骨组织缺损给患者的生活带来了巨大的不便。骨移植是解决骨缺损问题的常用治疗手段。自体骨移植具有疗效佳、无免疫源性的优势,但自体可供移植的骨量有限,而供区损伤也为患者带来了额外的痛苦。异体骨移植则因可能引起人体免疫反应且存在疾病传播风险而应用受限。骨修复支架是骨组织工程的重要研究内容,为骨缺损修复带来新的希望。
在各种骨修复材料中,磷酸钙骨水泥(CPC)因在室温下可固化生成与天然骨无机成分类似的缺钙羟基磷灰石,并具有良好的可塑性、骨传导性等特性而备受关注[1-3]。但在临床应用中,CPC诱导成骨生物活性欠佳,降解速度较缓慢,未得到广泛应用[4-5]。以生物玻璃为代表的硅基材料能引导羟基磷灰石形成,其释放的硅离子可促进成骨相关基因骨桥蛋白和骨钙素的表达。硅对骨、软骨代谢基质及细胞外基质的形成和矿化具有重要影响[6-8]。研究[9-10]发现,用硅酸钙引导CPC,能显著提高材料的降解性能和生物活性,在细胞及基因水平可促进成骨细胞增殖分化、刺激血管内皮细胞。骨形态发生蛋白(BMP)可显著促进间充质干细胞成骨分化,能很大程度地加快骨修复过程。大量研究[11-12]证实在骨水泥中添加BMP-2可明显提高材料的生物活性和骨修复能力。
从骨组织自愈合的角度来看,理想的骨组织支架除具有良好的生物相容性、生物降解性外,还应具有三维立体多孔道结构[13-14]。该结构具有较高的比表面积和充足的空间,有利于活性因子负载、细胞黏附生长、细胞外基质沉积、营养成分和氧气进入、代谢产物排出以及血管神经长入等。同时,支架需为新生组织提供支撑直至其具备足够的自身生物力学性能,因而可塑性和力学强度也是评价骨修复支架的一大重要指标。
传统的多孔支架材料制备方法各有不同优点[15-18],但均需人工操作,可重复性差,无法控制孔道结构(如孔的尺寸、空间分布、连通性等),更缺乏制造复杂外形的能力,还存在制孔剂毒性作用问题。20世纪80年代出现的一种基于计算机辅助设计的新型制造技术——3D打印技术,具有制造个体化和一次成型的特点,可设计孔道结构并控制制备过程,构建出任意复杂形状的三维实体,为组织工程支架的仿形与仿生制造提供了新途径[19-24]。
本研究基于优化支架材料组分及孔道结构的考虑,将自主研发的新型介孔硅酸钙(MCS)材料与CPC均匀混合作为打印材料,采用3D打印技术制备具有不同孔道结构的MCS/CPC复合支架,研究支架孔径及孔分布对细胞黏附性能和力学性能的影响,试图为优化支架构建方案提供实验依据。本研究还将上述钙磷硅基复合多孔支架负载重组人骨形态发生蛋白(rhBMP-2),并在大鼠颅骨原位缺损模型上研究支架和rhBMP-2在成骨过程中的作用。
1 材料与方法
1.1 多孔支架的设计制备
支架材料主要为CPC(上海瑞邦生物材料有限公司)和MCS(由本课题组合成)。CPC在粉碎机中间歇粉碎60 min后和MCS 分别过500目筛,取筛下粉混合均匀得到复合粉末(MCS-5 wt.% CPC)。将固化黏结液(含6 wt%聚乙烯醇和4 wt%海藻酸钠)与复合粉末按0.4 mL/g液固比混合,均匀调和后转移至微滴喷射自由成型系统(上海富奇凡机电科技有限公司)料腔内,设定相应加工参数,构建外形大小为10 mm×10 mm×4 mm、孔道结构不同的MCS/CPC多孔支架。将支架样品置于37 ℃、100%湿度环境中固化72 h,收集备用。
1.2 支架孔隙率测定
采用阿基米德法测量多孔支架的孔隙率,具体操作步骤如下:测量干燥支架在空气中的质量ms,用游标卡尺测量支架的实际尺寸并计算得到支架体积Vs;选用容积为10 mL的称量瓶,将称量瓶装满无水乙醇,测量并记录其质量m1;将支架样品置于装满无水乙醇的称量瓶中浸泡,直至无气泡从样品中溢出,擦去溢出的无水乙醇,测量并记录质量m2;记无水乙醇密度为ρ乙醇,按照公式P=[1-(m1+ms-m2)/ρ乙醇Vs]×100%计算支架材料的孔隙率。实验共5组样品,每组设3个平行样。
1.3 孔道结构对支架力学性能的影响
用万能力学试验机(AG-2000A,日本岛津公司)以载荷速度0.5 mm/min、最大压力2000 N测量支架压缩强度。每组设3个平行样。
1.4 孔道结构对细胞黏附性能的影响
由于活细胞能与四甲基偶氮唑盐(MTT)发生氧化还原反应,产生蓝紫色结晶物,本实验采用MTT比色法测定不同时间黏附于不同孔道结构MCS/CPC支架表面的细胞数量,评价支架初始黏附性能。将片状支架置于10 mL离心管(管底部放入少量棉花便于样品取出)中,封口,高温灭菌30 min后取出,逐一置于24孔细胞培养板。Dulbecco改良Eagle培养基(DMEM)中包含10%胎牛血清以及2%抗生素(200 μg/mL 青霉素和 200 μg/mL 链霉素),抽滤灭菌;取浓度为1×106个/mL小鼠成肌细胞(C2C12)悬液20 μL滴加至样品表面,添加培养基至每孔含2 mL液体。细胞与支架共培养1、3、7 d。培养结束后,弃去培养基,用磷酸盐缓冲液(pH=7.25)小心清洗样品2次,洗脱材料上未黏附的细胞。每孔加入100 μL培养基和MTT检测液(5 mg/mL),37 ℃下培养4 h后,取出支架并转移至另一24孔细胞培养板,每孔加入二甲基亚砜500 μL,37℃下溶解结晶20 min,在酶标仪上490 nm波长处测定溶液的吸光值。
1.5 动物体内植入实验
综合考虑孔隙率、力学性能和黏附性能选择孔道结构优化设计的多孔支架。36只健康成年大鼠(雌雄不限,购自上海交通大学医学院实验动物中心)分为CPC组、MCS/CPC组、MCS/CPC/rhBMP-2组,每组6个平行样,分别于4、8、12周植入相应支架。手术按外科操作原则进行,所有器械均经高温湿热灭菌,手术部位术前脱毛。实验动物俯卧位固定于手术台,采用4%戊巴比妥钠溶液(40 mg/kg)实施腹腔注射麻醉。常规消毒手术部位,切开皮肤,采用医用电钻在大鼠颅骨两侧分别作与颅骨方向垂直的直径6 mm、深2 mm的圆柱形缺损,植入同样尺寸的具有优化孔道结构的支架后逐层关闭切口。术后注射青霉素预防感染并正常喂养。
1.6 硬组织切片VG染色组织学观察
支架植入4、8、12周后处死实验动物,从植入部位取材并用中性福尔马林液固定。首先对样本进行梯度酒精(70%、90%、100%)脱水,随后将其用聚丙烯酸甲酯包埋,沿垂直方向切片并经VG染色后,采用光学显微镜观察有无炎症反应、骨组织长入以及材料降解情况。选取3张连续样本切片,通过Leica MTLA全自动专业研究级显微镜(德国Leica公司)采集图像并采用Image Pro Plus 6.0 图像分析软件分析成骨量,测量成骨面积并计算平均值,得到骨组织标本的新生骨量。
1.7 脱钙骨组织切片HE染色和Masson三色法染色组织学观察
将12 周取出的植入部位组织样本以0.9% NaCl生理盐水冲洗后采用中性福尔马林溶液固定2 h,再经洗涤、脱水、浸蜡、包埋、切片、染色、封片等步骤制成HE染色及Masson三色染色组织切片,采用倒置研究型显微镜(德国Leica公司)对组织切片进行对照观察。
1.8 统计学方法
数据以平均值±标准差表示,用方差分析(ANOVA)及t检验进行数据分析,P<0.05为差异具有统计学意义。
2 结果
2.1 支架的表面形貌和孔道结构
采用3D打印技术成功构建不同孔道结构支架(下页表1)后,通过数码相机、日本电子株式会社的JSM-6360LV扫描电子显微镜(SEM)观察支架的表面形貌和孔道结构(下页图1)。结果发现,微滴喷射自由成型系统可将具有一定粘性的浆体按设定的路径、网格间距层层堆积形成均匀分布的孔道,使支架孔道结构可被精确控制。尽管支架固化及干燥过程中可能伴随着溶剂的挥发出现收缩,但由于固化液中加入的聚合物可对材料起到稳定作用,最终制备的支架结构与设计模型基本一致,无明显收缩。
2.2 支架孔隙率
采用阿基米德排液法测定上述5组支架的孔隙率:A组支架垂直孔径为250 μm,孔隙率最小(40.8%);C组支架垂直孔径为 500 μm,孔隙率最大(65.4%);B、D、E组网格间距、孔径参数相同,但孔道分布不同,各组孔隙率非常接近,分别为 56.6%、57.7%和54.2%。孔道大小参数是影响孔隙率的主要参数;在孔道大小参数相同的情况下,通过设定不同加工路径参数,可以得到孔隙率接近但孔道分布不同的支架。
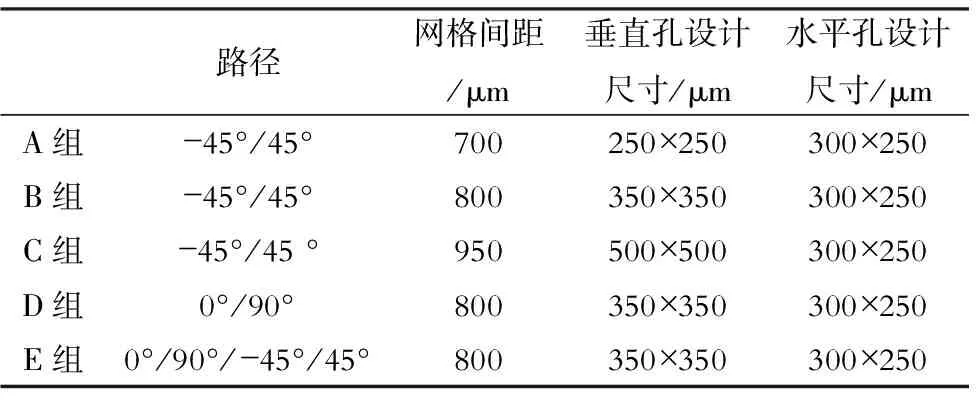
表1 不同孔道结构支架的加工参数

图1 不同孔道结构支架的设计图(a1、a2、b1、b2、c1、c2、d1、d2、e1、e2)、数码照片(a3、b3、c3、d3、e3)和SEM照片(a4、b4、c4、d4、e4)
2.3 支架抗压力学性能
A、B、C组支架孔道依次增大,而相应的最大抗压强度则依次下降,分别为13.8、9.8、5.2 MPa。B、D、E组孔道大小相同,但分布不同,其中加工路径为-45°/45°的B组支架力学性能优于加工路径为 0°/90°的D组(最大抗压强度为7.4 MPa),这可能是由于三角形结构有利于分散应力,使其具有更好的稳定性,而加工路径为0°/90°/-45°/45°的E组支架力学性能最差(最大抗压强度为3.6 MPa),这可能是由于多重加工路径降低了结构的有序度所致。
2.4 孔道结构对细胞黏附的影响
将C2C12细胞与支架共同培养,通过MTT法测定孔道结构对细胞黏附性能的影响。共培养初期,细胞对不同孔道结构的支架无明显黏附选择。共培养3、7 d后,在A、B、C组中,垂直孔径为350 μm的B组支架最有利于细胞黏附,而垂直孔径为500 μm的C组支架黏附的细胞数量明显少于其他两组,这可能是由于支架孔径过小无法为细胞的生长和迁移提供足够的空间,而过大则可供黏附的比表面积较小;在孔道大小相同但分布不同的B、D、E组中,加工路径为-45°/45°的B组支架最有利于细胞黏附增殖,而加工路径为0°/90°/-45°/45°的E组支架连通孔比加工路径为0°/90°的D组少,但细胞黏附数量仍略高于D组,可见孔道分布对细胞黏附也有一定影响。基于上述结果,本实验选择垂直孔径350 μm、加工路径-45°/45°的支架进行后续研究。
2.5 硬组织切片组织学观察
将CPC、MCS/CPC、MCS/CPC/rhBMP-2支架分别植入大鼠颅骨缺损处4、8、12周后,观察植入部位样本VG染色组织切片(图2)。3种支架植入缺损部位后孔道结构及支架整体均完整,未发生断裂变形,符合植入部位对力学性能的要求。植入4周后,CPC和MCS/CPC支架周围仅有钙盐沉积,尚未形成新生骨;MCS/CPC/rhBMP-2支架孔道间可见新生骨小梁分布,且骨小梁内部存在丰富骨细胞。植入8周后,CPC支架内钙盐沉积增加,但仍未形成新生骨组织;MCS/CPC支架孔道间可见丰富的纤维组织及新生骨小梁长入,支架本身逐渐降解;MCS/CPC/rhBMP-2支架可见新生骨组织沿应力线向内生长,且与支架材料紧密结合。植入12周后,CPC支架边缘可见新生骨生成,MCS/CPC支架孔道内可见纤维组织中的新生骨组织趋于成熟,MCS/CPC/rhBMP-2支架内新生骨组织继续沿应力线生长且骨小梁间不断添加骨质形成较为密实的骨组织。
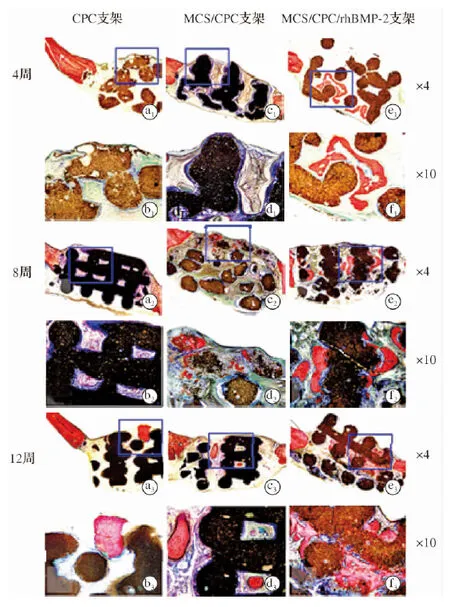
图2 CPC、MCS/CPC和MCS/CPC/rhBMP-2 支架植入4、8、12周后,植入部位样本VG染色组织学观察结果
CPC、MCS/CPC和MCS/CPC/rhBMP-2支架分别在植入12、8、4周后观察到新生骨形成,且新生骨组织面积均随时间推移而增加,其中MCS/CPC/rhBMP-2支架的成骨面积在各观察时点均为最大。组织形态计量学分析结果显示,支架植入12周后,CPC、MCS/CPC和MCS/CPC/rhBMP-2支架新生骨面积分别约为7.3%、10.1%和24.3%,MCS/CPC/rhBMP-2支架新生骨面积显著大于CPC支架(P<0.01)。这一结果表明,在支架材料中加入少量MCS可加快新生骨形成,而负载的rhBMP-2可发挥诱导成骨作用使其进一步加快。
2.6 脱钙骨组织切片组织学观察
通过HE染色和Masson三色染色组织学切片观察MCS/CPC/rhBMP-2支架植入4、8、12周后新生骨组织、成骨相关细胞和胶原组织的生长情况(图3)。植入4周后,支架孔道间可见丰富胶原纤维长入且与支架紧密贴合,其内部分布有大量骨原细胞、造血细胞和血管组织,且细胞开始向支架内部迁移;植入8周后,大量未钙化类骨质逐渐长入支架内部,孔道间可见趋向成熟的新生骨组织,其内有造血细胞分布;植入12周后,大量类骨质长入支架内部,新生骨组织相互连接形成致密骨组织,在Masson三色染色切片上新生骨组织由蓝色转变为红色,表明其正转化为成熟骨组织。
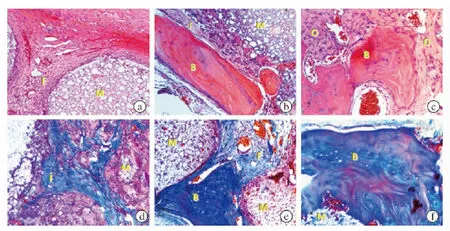
图3 MCS/CPC/rhBMP-2 支架植入4、8、12周后样本HE染色×100(a、b、c分别为植入后4、8、12周)及Masson三色染色×100(d、e、f分别为植入后4、8、12周)组织学切片观察结果
3 讨论
要使骨缺损得到良好修复,所选择的支架材料应当具有合适的三维多孔结构。较高的孔隙率、较好的连通性、均衡的微观结构利于新骨形成,但过高的孔隙率、过大的孔径又会降低材料的力学强度,只有最佳的生物学性能才能使骨组织工程支架发挥最大作用。传统的机械加工及数控加工方法很难满足这样的要求。目前的多孔生物材料大多不能很好地再现骨组织微结构的特点,孔道之间的连通率也难以保证,植入后可严重影响骨缺损部位血液、营养的循环代谢。
3D打印技术具有制造个体化和一次成型的特点,适用于制作非均质、结构多孔的支架材料。支架材料孔道结构是影响其骨传导性的主要因素之一,尤其孔径、孔隙率、孔道连通性这3个结构参数是普遍关注的指标[25-26]。有研究[27]表明,有矿化骨再生的最小孔径为100 μm,孔径过大(>500 μm)不利于诱导成骨[28]。本实验以MCS/CPC为原料,采用3D打印技术设计制备了孔径在200~500 μm范围内、孔道大小及分布不同的钙磷硅基复合多孔支架,旨在通过研究孔道结构对支架力学性能、细胞黏附性能的影响为骨修复支架孔道结构设计提供优化方案,并观察了负载有生长因子rhBMP-2的生物活性骨修复支架植入体内的成骨过程。
骨组织的形态结构和骨量受周围力学环境的影响,因而骨组织工程支架的力学性能影响着骨重建过程。本实验制备的MCS/CPC多孔支架孔隙率为40.8%~65.4%,最大抗压强度为3.6~13.8 MPa,抗压强度高于采用传统方法制备的多孔CPC支架[29]。此外,支架的孔道大小和分布显著影响其细胞黏附性,在垂直孔径相同的情况下,孔道连通性高的支架更有利于细胞黏附生长。
VG染色、HE染色和Masson三色染色组织学切片观察结果表明,在颅骨缺损修复模型中,成骨过程是由长入支架孔道间的纤维组织内部形成骨化中心,并不断扩展形成骨小梁,最后骨小梁生长并整合成致密骨组织,该过程与颅骨自身膜内成骨过程接近。由此可见,连通的孔道结构在成骨过程中尤为重要,而采用3D打印技术制备的支架连通孔道结构,有利于新生组织的长入和钙、硅离子从材料中扩散,为新生骨形成提供了有利条件。此外,MCS/CPC/rhBMP-2支架比CPC或MCS/CPC支架更能促进新生骨组织快速形成,且由MCS/CPC/rhBMP-2支架连通孔道内生长的新生组织内均含有丰富的造血细胞可以推测,MCS/CPC/rhBMP-2支架还有利于细胞迁移和血管生成。
[ 1 ] Ginebra MP, Fernández E, de Maeyerl EA, et al. Setting reaction and hardening of an apatitic calcium phosphate cement[J]. J Dent Res, 1997, 76(4):905-912.
[ 2 ] Liu C, Shao H, Chen F, et al. Rheological properties of concentrated aqueous injectable calcium phosphate cement slurry[J]. Biomaterials, 2006, 27(29):5003-5013.
[ 3 ] Sanzana ES, Navarro M, Macule F, et al. Of the in vivo behavior of calcium phosphate cements and glasses as bone substitutes[J]. Acta Biomater, 2008, 4(6):1924-1933.
[ 4 ] Ahn G, Lee JY, Seol DW, et al. The effect of calcium phosphate cement-silica composite materials on proliferation and differentiation of pre-osteoblast cells[J]. Mater Lett, 2013, 109:302-305.
[ 5 ] Jugdaosingh R. Silicon and bone health[J]. J Nutr Health Aging, 2007, 11(2):99-110.
[ 6 ] Thian ES, Huang J, Best SM, et al. The response of osteoblasts to nanocrystalline silicon-substituted hydroxyapatite thin films[J]. Biomaterials, 2006, 27(13):2692-2698.
[ 7 ] Zhao Q, Qian JC, Zhou H, et al. In vitro osteoblast-like and endothelial cells’ response to calcium silicate/calcium pho-sphate cement[J]. Biomed Mater, 2010, 5(3):35004.
[ 8 ] Guo H, Wei J, Yuan Y, et al. Development of calcium silicate/calcium phosphate cement for bone regeneration[J]. Biomed Mater, 2007, 2(3):S153-S157.
[ 9 ] Crouzier T, Sailhan F, Becquart P, et al. The performance of BMP-2 loaded TCP/HAP porous ceramics with a polyelectrolyte multilayer film coating[J]. Biomaterials, 2011, 32(30): 7543-7554.
[10] Crouzier T, Szarpak A, Boudou T, et al. Polysaccharide-blend multilayers containing hyaluronan and heparin as a delivery system for rhBMP-2[J]. Small, 2010, 6(5):651-662.
[11] Seol YJ, Park DY, Park JY, et al. A new method of fabricating robust freeform 3D ceramic scaffolds for bone tissue regeneration[J]. Biotechnol Bioeng, 2013, 110(5):1444-1455.
[12] Leong KF, Cheah CM, Chua CK. Solid freeform fabrication of three-dimensional scaffolds for engineering replacement tissues and organs[J]. Biomaterials, 2003, 24(13):2363-2378.
[13] Carey LE, Xu HH, Simon CG Jr, et al. Premixed rapid-setting calcium phosphate composites for bone repair[J]. Biomaterials, 2005, 26(24):5002-5014.
[14] Xu HH, Quinn JB, Takagi S, et al. Synergistic reinforcement of in situ hardening calcium phosphate composite scaffold for bone tissue engineering[J]. Biomaterials, 2004, 25(6):1029-1037.
[15] Barralet JE, Grover L, Gaunt T, et al. Preparation of macroporous calcium phosphate cement tissue engineering scaffold[J]. Biomaterials, 2002, 23(15):3063-3072.
[16] Deville S. Freeze-casting of porous ceramics: a review of current achievements and issues[J]. Adv Eng Mater, 2008, 10(3):155-169.
[17] Hesaraki S, Zamanian A, Moztarzadeh F. The influence of the acidic component of the gas-foaming porogen used in preparing an injectable porous calcium phosphate cement on its properties: acetic acid versus citric acid[J]. J Biomed Mater Res B Appl Biomater, 2008, 86(1):208-216.
[18] Miao X, Hu Y, Liu J, et al. Porous calcium phosphate ceramics prepared by coating polyurethane foams with calcium phosphate cements[J]. Mater Lett, 2004, 58(3-4):397-402.
[19] Yeong WY, Chua CK, Leong KF, et al. Rapid prototyping in tissue engineering: challenges and potential[J]. Trends Biotechnol, 2004, 22(12):643-652.
[20] Landers R, Mülhaupt R. Desktop manufacturing of complex objects, prototypes and biomedical scaffolds by means of computer-assisted design combined with computer-guided 3D plotting of polymers and reactive oligomers[J]. Macromol Mater Eng, 2000, 282(1):17-21.
[21] Wu C, Luo Y, Cuniberti G, et al. Three-dimensional printing of hierarchical and tough mesoporous bioactive glass scaffolds with a controllable pore architecture,excellent mechanical strength and mineralization ability[J]. Acta Biomater, 2011, 7(6):2644-2650.
[22] Seyednejad H, Gawlitta D, Dhert WJ, et al. Preparation and characterization of a three-dimensional printed scaffold based on a functionalized polyester for bone tissue engineering applications[J]. Acta Biomater, 2011, 7(5):1999-2006.
[23] Park S, Kim G, Jeon YC, et al. 3D polycaprolactone scaffolds with controlled pore structure using a rapid prototyping system[J]. J Mater Sci Mater Med, 2009, 20(1):229-234.
[24] Lode A, Meissner K, Luo Y, et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions[J]. J Tissue Eng Regen Med, 2014, 8(9):682-693.
[25] Karageorgiou V, Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis[J]. Biomaterials, 2005, 26(27):5474-5491.
[26] Jones AC, Arns CH, Hutmacher DW, et al. The correlation of pore morphology, interconnectivity and physical properties of 3D ceramic scaffolds with bone ingrowth[J]. Biomaterials, 2009, 30(7):1440-1451.
[27] Kuboki Y, Jin Q, Kikuchi M, et al. Geometry of artificial ECM:sizes of pores controlling pheotype expression in BMP-induced osteogenesis and chondrogenesis[J]. Connect Tissue Res, 2002, 43(2-3):529-534.
[28] Hulbert SF,Morrison SJ,Klawitter JJ. Tissue reaction to three ceramics of porous and non-porous structures[J]. J Biomed Mater Res, 1972, 6(5):347-374.
[29] Guo H, Su J, Wei J, et al. Biocompatibility and osteogenicity of degradable Ca-deficient hydroxyapatite scaffolds from calcium phosphate cement for bone tissue engineering[J]. Acta Biomater, 2009, 5(1):268-278.
(收稿:2015-02-28;优先出版:2015-05-04)
(本文编辑:易欣)
Biological property of rhBMP-2 loaded mesoporous calcium silicate/calcium phosphate cement scaffolds fabricated with 3D bioplotting technology
LI Cui-di1,3, CHEN Fang-ping1,2, WANG Jin-wu4, DAI Ke-rong4, LIU Chang-sheng1,2
WANGJin-wuE-mail:jinwu_wang@163.com
Objective To fabricate recombinant human bone morphogenetic protein-2 (rhBMP-2) loaded mesoporous calcium silicate/calcium phosphate cements (MCS/CPC) scaffolds based on 3D bioplotting technique, and investigate the combined effect of material component, mesoporous structure and growth factor on mechanical property, cell adhesion potential and osteogenesis of the bone repair scaffolds. Methods Scaffolds with different designed structure were fabricated to study the effect of pore size and distribution on mechanical property and cell adhesion potential for optimal design. To obtain a hybrid system in the repair of bone defects, rhBMP-2 was incorporated into the optimized scaffolds. The in vivo effects of CPC, MCS/CPC and MCS/CPC/rhBMP-2 scaffolds were further assessed in rat cranial defect models by histological analysis. Results MCS/CPC scaffolds with straight pore size of 350 μm possessed proper porosity (56.6%), high mechanical strength (9.8 MPa) and good biocompatibility. After the implantation for 12 weeks, MCS/CPC/rhBMP-2 scaffolds resulted in much more bone regeneration compared with the CPC and MCS/CPC scaffolds. In addition, new bones developed intramembranously, which is similar to the osteogenetic process of facial cranium bones. Conclusion Mesoporous calcium silicate incorporated macroporous scaffolds loaded with rhBMP-2 had synergistic enhancing effects on bone regeneration and were supposed to be a promising biomaterial for bone repair.
Bone repair; Mesoporous material; Calcium silicate; 3D bioplotting
国家重大科学研究计划(2011CB013300、2012CB933604)、国家自然科学基金(81171707)、上海市卫生系统重要疾病联合攻关项目(2013ZYJB0501)、上海教委重点学科建设基金(J50206)
200237 上海, 华东理工大学生物反应器工程国家重点实验室(李翠笛、陈芳萍、刘昌胜)、华东理工大学教育部超细材料重点实验室(陈芳萍、刘昌胜)、华东理工大学教育部生物医学材料工程技术研究中心(李翠笛); 200011, 上海市骨科内植物重点实验室、上海交通大学医学院附属第九人民医院骨科(王金武、戴尅戎)
王金武 E-mail: jinwu_wang@163.com
刘昌胜 E-mail: csliu@sh163.net
10.3969/j.issn.1673-7083.2015.03.006
LIUChang-shengE-mail:csliu@sh163.net
The State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology1, Shanghai 200237, China; Key Laboratory for Ultrafine Materials of Ministry of Education, School of Materials Science and Engineering, East China University of Science and Technology2, Shanghai 200237, China; Engineering Research Center for Biomedical Materials of Ministry of Education, East China University of Science and Technology3, Shanghai 200237, China; Shanghai Key Laboratory of Orthopaedic Implant, Department of Orthopaedics, the Ninth People’s Hospital Affiliated to Shanghai Jiaotong University School of Medicine4, Shanghai 200011, China
