硫酸氢氯吡格雷阿司匹林片的处方工艺研究
2015-03-04邢雪敏
李 欣,邢雪敏,颜 红
(1.山东省药学科学院,山东省化学药物重点实验室,山东济南250101;2.山东福瑞达医药集团公司,山东省黏膜与皮肤给药技术重点实验室,山东济南250101)
硫酸氢氯吡格雷阿司匹林片的处方工艺研究
李欣1,2,邢雪敏1,2,颜红1,2
(1.山东省药学科学院,山东省化学药物重点实验室,山东济南250101;2.山东福瑞达医药集团公司,山东省黏膜与皮肤给药技术重点实验室,山东济南250101)
摘要:目的探讨硫酸氢氯吡格雷阿司匹林片的制备工艺。方法采用正交设计筛选处方,设计采用粉未直接压片工艺制备双层片,选出最优处方并进行验证及质量考察。结果样品的片重差异、溶出度、含量、有关物质等均符合要求。工艺合理,质量可控。结论所制备的硫酸氢氯吡格雷阿司匹林片工艺简单、质量稳定、适合于工业化生产。
硫酸氢氯吡格雷阿司匹林片由赛诺菲安万特公司研制开发,商品名为Duoplavin,该产品2009年12 月17日获得欧洲药品管理局(EMA)的人用医药产品委员会(CHMP)的上市许可,该复方片包括2个剂量组合,即氯吡格雷75 mg/阿司匹林75 mg和氯吡格雷75 mg/阿司匹林100 mg。硫酸氢氯吡格雷是血小板聚集抑制剂,用于预防和治疗因血小板高聚集状态引起的心、脑及其他动脉循环障碍疾病[1]。硫酸氢氯吡格雷和阿司匹林都具有抑制血小板聚集的作用,二者合用,抗血小板活性显著增强,可用于治疗血小板聚集引起的疾病,包括稳定或不稳定的心绞痛、心血管和脑血管系统的疾病,疗效确切,在全球范围内的临床试验中得到证实[2,3]。硫酸氢氯吡格雷存在多种晶型,由于赛诺菲安万特公司将Ⅱ型晶型申请了专利[4],为了规避专利,我们采用晶型Ⅰ型原料,该晶型原料在高湿条件下会发生晶型转变,而阿司匹林在湿热条件下会水解为水杨酸和醋酸,因此,本研究采用粉末直接压片工艺,分别设计了硫酸氢氯吡格雷层及阿司匹林层处方,将两组组分压制成双层片。
1 仪器与试药
1.1仪器DP-30单冲压片机(北京国药龙立有限公司) ; ZPW-21B双色旋转式压片机(上海天和制药机械有限公司) ;智能片剂硬度仪(天津天大天发科技有限公司) ;脆碎度检查仪(天津天大天发科技有限公司) ; ZRS-8G智能溶出试验仪(天津天大天发科技有限公司) ; BY-300糖衣机(中南制药机械厂)。
1.2材料与试药硫酸氢氯吡格雷阿司匹林片原研药(Sanofi-Aventis Deutschland GmbH,批号: 3A221) ;硫酸氢氯吡格雷(浙江车头制药厂,批号: 13766003) ;阿司匹林(山东新华制药股份公司,批号: 613058) ;甘露醇(法国Roquette Freres,批号: E103D) ;微晶纤维素PH112 (德国JRS,批号: 5611232426) ;硬脂酸(湖南尔康制药辅料有限公司,批号: 101820120802 ) ;微粉硅胶(德国WACRER,批号: VA76178) ;淀粉,善流(上海卡乐康包衣技术有限公司,批号: IN525101) ;硬脂富马酸钠(生达化药,批号: S96-255) ;低取代羟丙基纤维素(辽宁奥达制药有限公司,批号: 20130101)。
2 方法与结果
2.1处方筛选
2.1.1硫酸氢氯吡格雷层处方筛选根据处方中各辅料的作用,选择甘露醇(因素A)、微晶纤维素(因素B)、硬脂富马酸钠(因素C)、低取代羟丙基纤维素(因素D)为考察因素。采用L9(34)正交试验设计,以休止角、硬度、崩解时间、脆碎度,黏冲程度5个指标。休止角为混匀后粉末的休止角,选用上述指标进行综合评分。休止角θ>40为0分,θ<40为1分,θ<30为2分;硬度(N) 10~30为0分,30~70为1分,70~100为2分;崩解时间大于15 min为0分,大于10 min为1分,小于10 min为2分,小于5 min为3分;脆碎度大于l%或裂片为0分,小于1%为1分;粘冲0分,不粘冲1分。本品片芯处方设计与结果见表1。
2.1.2阿司匹林层处方筛选在预试验基础上,选择淀粉(因素A)、低取代羟丙基纤维素(因素B)、微粉硅胶(因素C)、硬脂酸(因素D)为考察因素,应用L9(34)表设计试验,以流动性、硬度、脆碎度、崩解时间、粘冲程度为考察指标,将压力、片重调节为固定值。赋分标准及方法同硫酸氢氯吡格雷层一致,试验设计和结果见表2。

续表2:
2.1.3双层片的处方优化从表l和表2的结果综合来看,硫酸氢氯吡格雷层处方3最优,处方7其次;阿司匹林层处方9最优,处方8其次。硫酸氢氯吡格雷层优选处方(因素A)、阿司匹林层优选处方(因素B)为考察因素,将每组分项下两处方作为其2个水平,设计交叉试验,以双层片硬度、崩解时间、脆碎度为考察指标,将压力、片重调节为固定值。根据样品质量,制订综合评分方法。硬度(N) 10~30 为0分,30~70为1分,70~100为2分;崩解时间大于15 min为0分,小于10 min为1分,小于7.5 min为2分,小于5 min为3分;脆碎度大于1%或裂片为0分,小于1%为1分,小于0.5%为2分,小于0.25%为3分。试验设计和结果见表3。
由表3结果可知,硫酸氢氯吡格雷层处方3与阿司匹林层处方9组合的处方11最优,硫酸氢氯吡格雷层处方3与阿司匹林层处方8组合的处方10其次。分别测定处方10、处方11在水中的溶出度,并与原研样品进行对比,结果见表4,自研品中硫酸氢氯吡格雷与原研品中硫酸氢氯吡格雷样品的累积溶出曲线见图1,自研品中阿司匹林与原研品种阿司匹林样品的累积溶出曲线见图2,相似因子见表5。通过比较样品累积溶出度结果及相似因子,处方11双层片为最优选择。
处方11组成为:硫酸氢氯吡格雷层:硫酸氢氯吡格雷75 mg、甘露醇80 mg、微晶纤维素60 mg、硬脂富马酸钠6 mg、低取代羟丙基纤维素12 mg;阿司匹林层:阿司匹林100 mg、淀粉60 mg、低取代羟丙基纤维素30 mg、微粉硅胶4 mg、硬脂酸2 mg。
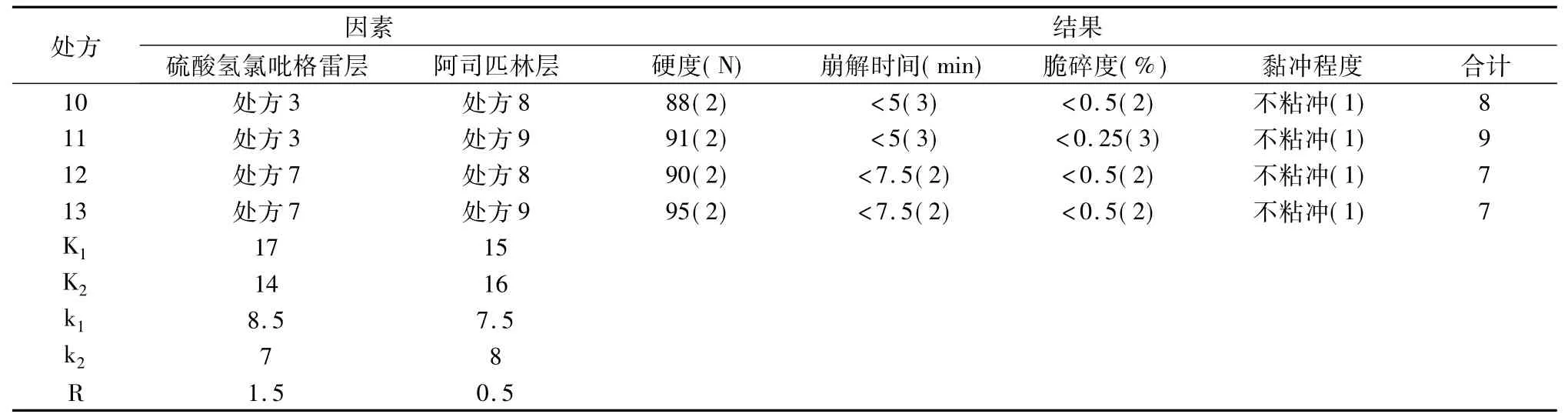
表3 硫酸氢氯吡格雷阿司匹林片正交设计试验方案及结果

表4 样品累积溶出度结果
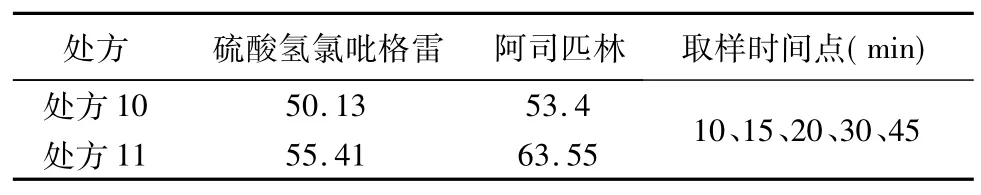
表5 相似因子计算表
2.2双层片制备工艺①分别取各辅料,于105℃条件下干燥2 h,备用;②阿司匹林层:原料过80目筛,辅料分别过40目筛,将辅料按淀粉、低取代羟丙基纤维素的顺序混合均匀后,取辅料与原料药按等量递加的方法混匀、再加入微粉硅胶、硬脂酸混合均匀,备用;③硫酸氢氯吡格雷层:原料过80目筛,辅料分别过40目筛,将辅料按照微晶纤维素、甘露醇、羟丙基纤维素的顺序混匀后,与硫酸氢氯吡格雷混合均匀、再加入硬脂富马酸钠混合均匀、备用;④压片:将上述两种颗粒分别倒入压片机的两个料斗中。将两部分压制成双层片,冲模为6.5 mm的浅凹型圆模;⑤包衣:依增重3%配制固含量10%的包衣液进行包衣。
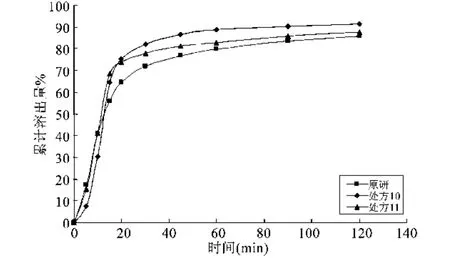
图1 硫酸氢氯吡格雷自研样品与原研样品体外释放曲线

图2 阿司匹林自研样品与原研样品体外释放曲线
2.3验证试验将确定的处方及工艺用于3批中试生产,照《中国药典》2010年版(二部)重量差异测定法(附录ⅠA)进行片重差异测定,根据自拟质量标准进行溶出度、含量和有关物质的测定,结果均符合标准要求。详见表6。
3 讨论
3.1硫酸氢氯吡格雷有多种晶型,其中市售原研制剂为Ⅱ型原料,本试验采用的是Ⅰ型原料,两者之间无生物等效性差异[5]。硫酸氢氯吡格雷对于湿度和温度敏感,且Ⅰ型相对于Ⅱ型,制剂制备难度更 大,且更不稳定。文献[6,7]报道采用常规湿法制粒将会引起晶型转型,故本试验在文献基础上,直接采用非水法进行研究。
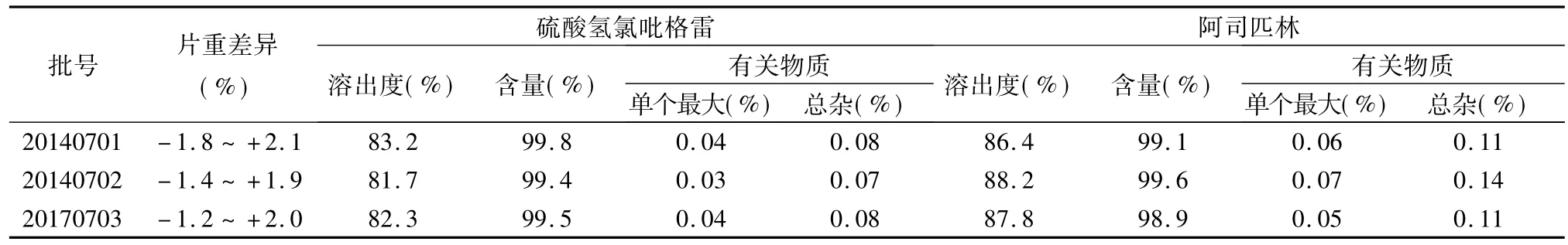
表6 中试样品检测结果
3.2阿司匹林是传统的解热镇痛抗炎药,从20世纪60年代开始,由于被发现有较好的抗血栓作用而广泛用于防治心脑血管疾病[8]。在我国,阿司匹林的生产和使用也在逐渐增加,但其制剂普遍存在析出游离水杨酸的问题[9],水杨酸是阿司匹林的水解产物,这可能和湿法制粒工艺有关。为了避免这一可能的影响因素,我们研究了粉末直接压片的工艺,样品中阿司匹林组分稳定性良好,水杨酸含量基本控制在0.5%以内。说明粉末直接压片工艺可解决阿司匹林的稳定性问题。
3.3本品采用直接压片方法制备硫酸氢氯吡格雷阿司匹林片、省时省力、工艺简单可行,适合于工业化生产。避免了两种主药在湿法制粒过程中湿热对其稳定性的影响。
参考文献:
[1]张宁仔.不稳定性心绞痛的诊断与治疗不稳定性心绞痛发病机理[J].中国医师进修杂志,1995,18(10) : 1 -3.
[2]Sullivan J,Amarshi N.Dual antiplatelet therapy with clopidogrel and aspirin[J].Am J Health-syst Pharm,2008,65(12) : 1134-1143.
[3]陈丹丹,李晋奇.阿司匹林联合氯吡格雷应用研究进展[J].药学研究,2014,3(2) : 106-107.
[4]A·布斯奎特,B·卡斯特罗,J·圣-格尔麦恩.氯吡格雷硫酸氢盐的多晶型物及其制备方法和药物组合物:中国,CN1128805C[P].2003-11-26.
[5]刘文乔,于梦,苗瑞娜,等.两种晶型硫酸氢氯吡格雷片稳定性的比较[J].沈阳药科大学学报,2013,30 (7) : 543-548,576.
[6]Mohan A,Hariharan M,Vikraman E,et al.Identificartion and characterization of a principal oxidation impurity in clopidogrel drug substance and drug product[J].J Pharm Biomed Anal,2008,47(1) : 183-189.
[7]Hegde DA,Chothe SS,Ghogari IS,et al.Novel stable pharmaceutical compositions of clopidogrel bisulfate and process of preparation thereof,United States,20100086590[P].2010 -08-04.
[8]Armstrong PW,Lorell BH,Nissen S,et al.Pravastatin and aspirin[J].Circulation,2002,106(6) : e9011-e9012.
[9]邹凯华,张华.阿司匹林的研究进展[J].上海医药,2009,30(2) : 64-66.
关键词:硫酸氢氯吡格雷;阿司匹林;双层片;制备
Study on preparation process of Clopidogrel Bisulfate and Aspirin Tablet
LI Xin1,2,XING Xue-min1,2,YAN Hong1,2
(1.Key Laboratory for Chemical Drug Research of Shandong Province,Shandong Academy of Pharmaceutical Science,Jinan 250101,China;2.Shandong Provincial Key Laboratory of Mucosal and Transdermal Drug Delivery Technologies,Shandong Freda Co.,Ltd.,Jinan 250101,China)
Abstract:ObjectiveTo study the preparation technology of Compound Clopidogrel Bisulfate and Aspirin Tablet.Methods The orthogonal design was adopted to screen the formula technology.Powder direct tableting process preparation of double-deck tabtet was used.The screened optimal formula was performed and the verification and quality investigation.Results The tablet weight variation,dissolution rate,content and related substances of the samples were all in accordance with the corresponding requirements.The technology was rational and the quality was controllable.ConclusionThe preparation technology of Compound Clopidogrel Bisulfate and Aspirin Double-deck Tablet was simple with stable quality and suitable for industrial production.
Key words:Clopidogrel Bisulfate; Aspirin; Double-deck tablet; Prepartion
作者简介:李欣,女,研究方向:药物制剂,E-mail: leeup@163.com
中图分类号:R944
文献标识码:A
文章编号:2095-5375(2015) 10-0584-004
