鲤鱼肌肉Ⅴ型胶原蛋白的分离纯化及其抗体制备
2015-03-03鲍俊旺蔡秋凤张凌晶刘光明曹敏杰
徐 超,鲍俊旺,蔡秋凤,2,张凌晶,2,刘光明,2,曹敏杰,2
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门 361021)
鲤鱼肌肉Ⅴ型胶原蛋白的分离纯化及其抗体制备
徐超1,鲍俊旺1,蔡秋凤1,2,张凌晶1,2,刘光明1,2,曹敏杰1,2
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门 361021)
[摘要]通过酸溶、胃蛋白酶酶解和氯化钠盐析等方法,从鲤鱼肌肉中纯化得到了V型胶原蛋白.SDS-PAGE电泳图谱分析发现,其至少由2条α链(α1和α2)组成,其中α1分子质量约为135 ku,α2分子质量约为120 ku.通过圆二色光谱仪分析其二级结构,发现其具有胶原蛋白三股螺旋结构的典型特征,其热变性温度为30.5 ℃.将V型胶原蛋白作为抗原免疫新西兰大白兔,成功制备了多克隆抗体.采用免疫印迹法对该多克隆抗体的特异性进行分析,证明其仅与鱼类V型胶原蛋白产生反应,特异性良好.
[关键词]V型胶原蛋白;圆二色谱;多克隆抗体;免疫印迹法;鲤鱼
0引言
胶原蛋白(Collagen)是一种高分子蛋白质,是构成细胞外基质(Extracellular Matrix,ECM)非常重要的结构蛋白质之一,在细胞质基质中含量也最为丰富.胶原蛋白广泛存在于动物的皮肤、肌腱、软骨、韧带及其他结缔组织中,具有支撑器官、保护机体的功能,占哺乳动物蛋白质总量的25%~30%[1].生物体内胶原蛋白种类较多,常见的类型有Ⅰ型、Ⅱ型、Ⅲ型、Ⅴ型和Ⅵ型.在鱼类的肌肉组织中已经报道了Ⅰ、Ⅱ、Ⅴ、Ⅵ等类型的胶原蛋白,其中,Ⅰ型胶原蛋白的含量最为丰富,为主要胶原蛋白,而Ⅴ型胶原蛋白的含量相对较低,为次要胶原蛋白[2].
胶原蛋白因为具有良好的生物降解性、生物相容性以及生物活性,如低免疫原性、在体内易被吸收、能促进细胞生长、促进血小板凝结等,在食品、医药、组织工程、化妆品等领域获得广泛的应用.胶原蛋白制备的基本原理主要是根据其难于溶解的特性,通过改变蛋白质所在的外界环境,最后实现胶原蛋白与其他蛋白质的分离.鱼类胶原蛋白的提取主要以酸法和酶法为主,也有盐析等提取方法.在实际提取过程中,不同提取方法之间往往互补[3-4].Sato等[5]用酸、酶结合盐析法从鲤鱼(Cyprinus carpio)肌肉中提取出Ⅰ型和Ⅴ型胶原蛋白.Wang等[6]从软骨鱼史氏鲟(Acipenser schrenckii)鱼皮中提取了Ⅰ型和Ⅴ型胶原蛋白.
目前,国内外对于鱼类Ⅰ型胶原蛋白的研究已有很多报道[3-6],但对于含量较少、提取过程较为复杂的Ⅴ型胶原蛋白的研究报道较少.研究发现,鱼类冷藏过程中肌肉的软化与胶原蛋白(尤其与Ⅴ型胶原蛋白)含量的变化密切相关[2,5].因此,对Ⅴ型胶原蛋白的研究应引起人们的高度关注.本研究从鲤鱼肌肉中分离纯化Ⅴ型胶原蛋白,并成功制备了高特异性多克隆抗体,为今后对鱼类Ⅴ型胶原蛋白的进一步研究提供了新手段.
1材料与方法
1.1 材料与仪器
鲜活鲤鱼((1500±200) g)购于厦门集美菜市场,宰杀后取其肌肉立即用于实验.蛋白质分子质量标准购于美国Thermo scientific公司;胃蛋白酶购于国药集团化学试剂有限公司;硝酸纤维素膜(NC膜)为 Bio-Rad(美国)公司产品;羊抗兔 IgG-HRP 为DAKO(丹麦)公司产品,ECL 底物为 Pierce(美国)公司产品.其他试剂均为分析纯.
组织捣碎机(PT-2100,Kinematica,瑞士);高速冷冻离心机(Avanti JA-26.5,Beckman,美国);小型冷冻离心机(Centrifuge 5417,Eppendorf,德国);超纯水系统(RIOS 8,Millipore,美国);凝胶成像仪(G-BOX,Syngene,英国);圆二色光谱仪(Chirascan,Applied Photophysics,英国);恒温水浴锅(Memmert,德国);pH计(Sartorius,德国).
1.2 实验方法
1.2.1鲤鱼Ⅴ型胶原蛋白的分离纯化
鲤鱼肌肉中胶原蛋白的提取主要参照Sato等[5]和Wang等[6]的方法,并做了适当修改,具体实验步骤如下:将新鲜的鱼肉(1500 g)绞碎后置于10倍体积的0.1 mol/L NaOH溶液中,组织捣碎,离心(5000 r/min,20 min)取沉淀再加入到20倍体积的0.1 mol/L NaOH溶液中,搅拌过夜,此操作重复4次.获得的沉淀用蒸馏水洗至中性,再加入到10倍体积的0.5 mol/L乙酸溶液中,搅拌2 d,离心去除酸不溶性成分.上清液加入质量分数为1%的胃蛋白酶,搅拌2 d,离心去除不溶性成分,上清液再加入NaCl至终浓度为2 mol/L,将胶原蛋白析出,离心(9000 r/min,30 min)取沉淀.此时的胶原蛋白主要为Ⅰ型和Ⅴ型胶原蛋白的混合物,需要在接下来的步骤通过不同的盐浓度进行分离.得到的沉淀加入50 mmol/L Tris-HCl(pH=7.5,含1 mol/L NaCl)溶解,离心后取上清液,再加入NaCl至终浓度为2.4 mol/L,再进一步离心(24900 r/min,90 min)后所得沉淀即为Ⅰ型胶原蛋白.
在Ⅰ型胶原蛋白的上清液中加入NaCl至终浓度为4.0 mol/L,离心(24900 r/min,90 min)取沉淀,将沉淀复溶于0.5 mol/L的乙酸溶液,再装入到透析袋中用乙酸溶液透析,期间每4 h换一次透析液.透析24 h加入NaCl至终浓度为0.7 mol/L,离心(10000 r/min,30 min)取上清液,在上清液中加入NaCl至终浓度为2.0 mol/L,离心(10000 r/min,30 min),沉淀即为V型胶原蛋白.将沉淀复溶并用0.5 mol/L乙酸透析,用于后续实验.
1.2.2圆二色谱对Ⅴ型胶原蛋白的测定
将纯化的胶原蛋白质量浓度调整为0.2 g/L,然后放入直径为0.2 cm的比色皿中进行圆二色谱分析.设置波长范围为190~260 nm,步进值为1.0,带宽为1 nm,单点扫描时间为0.5 s,单一温度点为20 ℃.同一个样品重复测量3次.
测定胶原蛋白的热变性温度时,从10~80 ℃,每上升1 ℃扫描一次,再将得到的数据经软件分析其热变性温度.
1.2.3Ⅴ型胶原蛋白多克隆抗体的制备
取100 μL 1 g/L的纯化V型胶原蛋白与300 μL弗氏完全佐剂混合,置于混合器剧烈振荡使抗原充分乳化,再将乳剂静脉注射至质量约2 kg的新西兰大白兔.两周后,用100 μg V型胶原蛋白与300 μL弗氏不完全佐剂混合,选取不同点加强免疫4次,耳动脉取少量血清检测抗体效价.在效价达到要求后,最后一次采血,将血浆放置于4 ℃静置过夜,然后1500 r/min离心15 min,得到的上清液即为抗血清.
将抗血清和0.1 mol/L Tris-HCl (pH=8.0)等比例混合上样于与预先用相同缓冲液平衡好的Protein A Sepharose预装柱,然后依次用10倍体积的0.1 mol/L Tris-HCl(pH=8.0)和0.01 mol/L Tris-HCl(pH=8.0)开始流洗,直至蛋白质含量A280达基线.用0.1 mol/L甘氨酸(pH=3.0)以1 mL/min的流速进行洗脱,收集样品,用 1 mol/L Tris-HCl(pH=8.0)中和.将纯化得到的IgG多克隆抗体进行分装,于-80 ℃冰箱保存.
1.2.4免疫印迹法(Western blotting)
免疫印迹法参考Towbin等[7]的方法,将SDS-PAGE凝胶上的样品转移至硝酸纤维素膜,加入质量分数为5%的脱脂奶室温封闭2 h,TBST漂洗,加入一抗(兔抗V型胶原蛋白抗体,1∶4000)室温孵育2 h,TBST漂洗,再加入HRP 标记的羊抗兔IgG(1∶20000)作为二抗,室温孵育1 h,用TBST漂洗后,加入底物进行化学发光ECL显色.
2结果
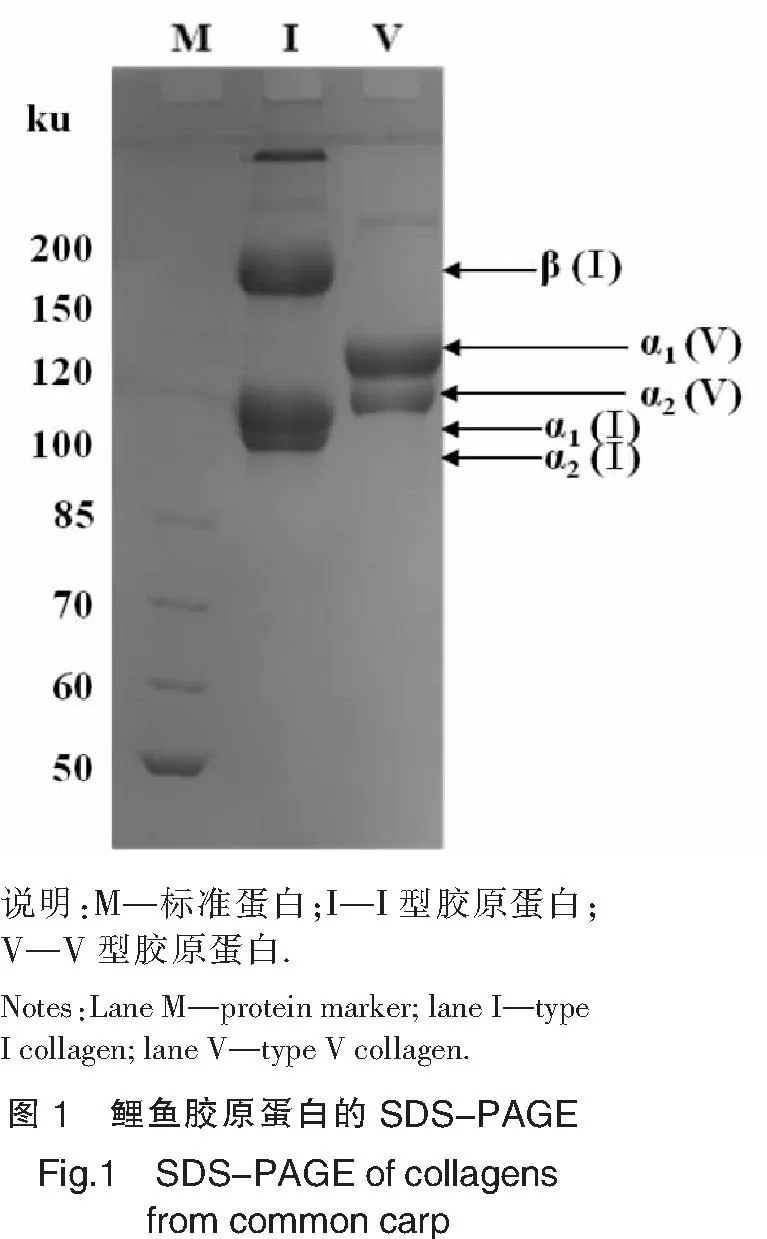
2.1 鲤鱼Ⅴ型胶原蛋白的分离纯化
由于不同类型的胶原蛋白在中性和酸性条件下有不同的盐析浓度,根据胶原蛋白这一特性,通过胃蛋白酶酶解和氯化钠盐析从鲤鱼肌肉中分离得到2种不同的胶原蛋白,即:Ⅰ型和Ⅴ型胶原蛋白(见图1).鲤鱼V型胶原蛋白α1链(分子质量约135 ku)的含量约为α2链(分子质量约120 ku)的2倍,推测其亚基组成形式可能为α1(V)2α2(V).研究表明,鱼类Ⅴ型胶原蛋白至少由3条α链组成[8-10],且至少存在4种亚基组成形式,分别是α1(V)2α2(V)、α1(V)α2(V)α3(V)、α2(V)3以及Ⅴ/Ⅵ混合的α链[11].本研究结果与文献[5-6,12-13]提取的Ⅴ型胶原蛋白的电泳图谱结果相似.
2.2 Ⅴ型胶原蛋白的圆二色谱分析
圆二色光谱(CD)是应用最为广泛的测定生物大分子二级结构的方法,被广泛应用于蛋白质构象研究.如图2所示,鲤鱼Ⅰ型和Ⅴ型胶原蛋白的CD光谱波峰在221 nm处,波谷在198 nm处,两条光谱线在210 nm处相交,这是胶原蛋白三股螺旋结构典型的特征[14-15].该结果与Wang等[5]从史氏鲟鱼皮中得到的Ⅰ型和Ⅴ型胶原蛋白的圆二色谱扫描结果相似.如图3所示,鲤鱼Ⅴ型胶原蛋白的热变性温度为30.5 ℃.采用同样的方法分析得到鲤鱼Ⅰ型胶原蛋白的热变性温度为28.5 ℃.Wang等[5]从史氏鲟鱼皮中纯化的Ⅰ型和Ⅴ型胶原蛋白的热变性温度分别为32.52 ℃和35.92 ℃,说明Ⅴ型比Ⅰ型胶原蛋白热稳定性高,这与本文的研究结果类似.
2.3 抗Ⅴ型胶原蛋白多克隆抗体的性质分析
2.3.1Dot blot法进行抗体效价分析
在NC膜上用移液枪点上相同量的抗原,将纯化后的抗V型胶原蛋白多克隆抗体稀释不同倍数作为一抗孵育,经二次抗体反应后进行ECL显色.由图4可知,抗V型胶原蛋白多克隆抗体的效价可以达到 1∶8000.

2.3.2抗Ⅴ型胶原蛋白多克隆抗体的特异性分析
采用 Western blotting对抗Ⅴ型胶原蛋白多克隆抗体进行特异性分析.由图5a可知,该抗体仅与鲤鱼Ⅴ型胶原蛋白条带反应,而不与肌肉粗提物中的其他蛋白质反应,表明制备的抗Ⅴ型胶原蛋白多克隆抗体特异性良好.对反应条带进行分析,两条链的反应程度相当,与SDS-PAGE的结果有差异,这可能是由于样品的浓度不同引起的结果.由于Western bloting采用的是ECL法显影,灵敏度高,在样品蛋白浓度较高的情况下,会掩盖这种浓度差异.进一步对该抗体的种属特异性进行分析,从图5b和图5c的结果可知,制备的抗V型胶原蛋白多克隆抗体只与海水鱼蓝圆鲹(Decapterus maruadsi)肌肉中的V型胶原蛋白有反应,而对皱纹盘鲍(Haliotis discus hannai)、南美白对虾(Penaeus vannameiBoone)、猪和牛的肌肉粗提液的检测结果均为阴性,表明本研究制备的抗鲤鱼Ⅴ型胶原蛋白多克隆抗体种属特异性良好.

3讨论
本研究通过酸溶、胃蛋白酶酶解和氯化钠盐析等方法从鲤鱼肌肉中纯化得到了Ⅴ型胶原蛋白.在与含量最高的I型胶原蛋白的分离中,利用Ⅰ型和Ⅴ型胶原蛋白在不同的盐浓度下溶解度的差异,采用改变盐浓度的方法把二者分开.SDS-PAGE结果显示,纯化的蛋白质主要由2条α链(α1和α2)组成,其中α1分子质量约为135ku,α2分子质量约为120ku.文献[8-10]报道,鱼类V型胶原蛋白至少由3条α链(主要为α1和α2)组成.最近报道的史氏鲟V型胶原蛋白则由α1、α2和α3组成[6],这是否是软骨鱼的特征有待进一步验证.本实验得到的V型胶原蛋白α1链的含量约为α2链的2倍,推测α1(V)2α2(Ⅴ)可能为其亚基组成.通过圆二色光谱分析其二级结构,发现V型胶原蛋白具有胶原蛋白三股螺旋结构的典型特征,其热变性温度为30.5 ℃.
将纯化的Ⅴ型胶原蛋白作为抗原免疫新西兰大白兔,成功制备了抗V型胶原蛋白多克隆抗体,采用免疫印迹法对制备的多克隆抗体进行特异性分析,发现其特异性良好.采用制备的抗体对其他水产动物和哺乳动物肌肉粗提液进行检测,结果发现,只有蓝圆鲹肌肉中检测到了Ⅴ型胶原蛋白的存在,且只有一条α链有反应,推测这可能是由于不同鱼类之间Ⅴ型胶原蛋白一级结构的差异造成的.利用该抗体,在皱纹盘鲍、南美白对虾、猪和牛的肌肉中均未检测到V型胶原蛋白的阳性反应,推测这是由于不同物种间Ⅴ型胶原蛋白的同源性低导致的结果.当然,这也可能是由于皱纹盘鲍和南美白对虾的肌肉中Ⅴ型胶原蛋白的含量很低所致,具体原因有待进一步的实验验证.
有研究发现,在鱼体死后的肌肉软化过程中,胶原蛋白的含量不断降低,肌肉硬度与胶原蛋白的含量及完整性密切相关[2,16].由于传统的胶原蛋白提取分析方法只能获得胶原蛋白含量变化的信息,但不能得到胶原蛋白降解的直接证据.为了研究鱼类冷藏过程中胶原的变化,有必要制备高特异性的抗鱼类胶原蛋白抗体,通过免疫印迹方法并结合肌肉弹性的质构分析,可以更准确地了解胶原蛋白在不同冷藏时间含量的变化情况并揭示其机理.本研究结果表明,制备的抗V型胶原抗体的特异性和效价都比较理想,为后期详细研究鱼类冷藏过程中肌肉软化时Ⅴ型胶原蛋白的降解情况提供可靠的分析方法.
[参考文献]
[1]蒋挺大,张春萍.胶原蛋白[M].北京:化学工业出版社,2001.
[2]SATO K,ANDO M,KUBOTA S,et al.Involvement of type V collagen in softening of fish muscle during short-term chilled storage[J].Journal of Agricultural and Food Chemistry,1997,45(2):343-348.
[3]连喜军,鲁晓翔,刘勤生.鱼类胶原蛋白研究进展[J].肉类研究,2007,01:46- 49.
[4]DEYL Z,MIKSIK A,ECKHARDT A.Preparative procedures and purity assessment of collagen proteins[J].Journal of Chromatography B,2003,790(1/2):245-275.
[5]SATO K,YOSHINAKA R,SATO M,et al.Isolation of types I and V collagens from carp muscle[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1988,90(1):155-158.
[6]WANG L,LIANG Q F,WANG Z B,et al.Preparation and characterisation of type I and V collagens from the skin of Amur sturgeon(Acipenser schrenckii)[J].Food Chemistry,2014,148:410- 414.
[7]TOWBIN H,STAEHELIN T,GORDON J.Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets:procedure and some applications[J].Proceedings of the National Academy of Sciences of the United States of America,1979,76:4350- 4354.
[8]HWANG J H,MIZUTA S,YOKOYAMA Y,et al.Purification and characterisation of molecular species of collagen in the skin of skate(Raja kenojei)[J].Food Chemistry,2007,100(3):921-925.
[9]NISHIMOTO M,MIZUTA S,YOSHINAKA R.Characterization of molecular species of collagen in muscles of Japanese amberjack,Seriolaquinqueradiata[J].Food Chemistry,2004,84(1):127-132.
[10]NISHIMOTO M,SAKAMOTO R,MIZUTA S,et al.Identification and characterisation of molecular species of collagen in ordinary muscle and skin of the Japanese flounderParalichthysolivaceus[J].Food Chemistry,2005,90(1/2):151-156.
[11]BIRK D E.Type V collagen:heterotypic type I/V collagen interactions in the regulation of fibril assembly[J].Micron,2001,32:223-237.
[12]SATO K,SAKUMA A,OHTSUKI K,et al.Subunit composition of eel(Anguilla japonica)type V collagen:evidence for existence of a novel fourth α4(V)chain[J].Journal of Agricultural and Food Chemistry,1994,42:675-678.

[14]IKOMA T,KOBAYASHI H,TANAKA J,et al.Physical properties of type I collagen extracted from fish scales ofPagrusmajorandOreochromisniloticas[J].International Journal of Biological Macromolecules,2003,32(3/5):199-204.
[15]WOOD A,OGAWA M,PORTIER R J,et al.Biochemical properties of alligator(Alligator mississippiensis)bone collagen[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,151(3):246-249.
[16]曹敏杰,张玲,王慈.鱼类基质金属蛋白酶研究进展[J].集美大学学报(自然科学版),2014,19(5):321-329.
(责任编辑马建华英文审校曹敏杰)
Purification of Type V Collagen from Common Carp(Cyprinus carpio)Muscle and Preparation of Polyclonal AntibodyXU Chao1,BAO Jun-wang1,CAI Qiu-feng1,2,ZHANG Ling-jing1,2,LIU Guang-ming1,2,CAO Min-jie1,2
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China;
2.Engineering Research Center for Aquatic Products Processing of Fujian Province,Xiamen 361021,China)
Abstract:The type V collagen from common carp muscle was extracted by pepsin digestion and salt precipitation.SDS-PAGE analysis revealed that the protein contains at least two different α chains(α1and α2).The molecular mass of α1-chain was about 135 ku,while that of α2-chain was around 120 ku.The characteristic of type V collagen is typical with triple helical structure and its denaturation temperature is 30.5 ℃ as assessed by circular dichroism.Purified type V collagen was used as an antigen to immunize a New Zealand rabbit subcutaneously to prepare a specific polyclonal antibody.The specificity of the anti-collagen(V)polyclonal antibody was confirmed by Western blotting and it specifically reacted with type V collagen from fish.
Key words:type V collagen;circular dichroism;polyclonal antibody;Western blotting;Cyprinuscarpio
[中图分类号]Q 512+.6
[文献标志码]A
[文章编号]1007-7405(2015)06-0401-06
[作者简介]徐超(1991—),男,硕士生,从事蛋白质化学研究.通信作者:曹敏杰(1964—),男,教授,博士,从事蛋白质化学及水产品加工方向研究,E-mail:mjcao@jmu.edu.cn.
[基金项目]国家自然科学基金资助项目(31271838);海洋公益性行业科研专项经费项目(201305015-3)
[收稿日期]2015-03-30[修回日期]2015-05-27
