姜黄素对佐剂性关节炎大鼠血清骨保护素和核因子κ B受体活化因子配体蛋白表达及骨密度的影响
2015-03-03赵凌杰邱艳商玮刘春丽赵智明郭郡浩蔡辉
赵凌杰 邱艳 商玮 刘春丽 赵智明 郭郡浩 蔡辉
姜黄素对佐剂性关节炎大鼠血清骨保护素和核因子κ B受体活化因子配体蛋白表达及骨密度的影响
赵凌杰邱艳商玮刘春丽赵智明郭郡浩蔡辉
【摘要】目的观察姜黄素对佐剂性关节炎(adjuvant arthritis,AA)大鼠血清骨保护素(osteoprotegerin,OPG)、核因子κB受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)表达以及骨密度的影响,探讨姜黄素防止类风湿关节炎(rhuematoid arthritis,RA)骨破坏的作用机制。方法取SD大鼠30只,随机分为模型组、姜黄素组及正常组,第28天腹主动脉取血,采用ELISA法来检测血清中RANKL、OPG蛋白的表达,取血后处死大鼠,剥离大鼠右侧胫骨,行骨密度检查。结果(1)与正常组比较,造模组即模型组与姜黄素组大鼠血清RANKL均显著升高(P<0.01),血清OPG显著降低(P<0.01),RANKL/OPG比值显著升高(P<0.01);(2)与模型组比较,治疗组即姜黄素组血清RANKL显著降低(P<0.01),血清OPG均显著升高(P<0.01),RANKL/OPG比值均显著降低(P<0.01);(3)3组大鼠胫骨整体骨密度无显著性差异(P>0.05),姜黄素组大鼠兴趣区骨密度值显著高于模型组(P<0.01)。结论姜黄素对AA大鼠具有良好的治疗作用,能够通过调节血清RANKL及OPG的表达,来调节OPG/RANKL通路,从而提高AA大鼠骨密度,抑制其骨丢失。
【关键词】姜黄素;佐剂性关节炎;骨密度;骨保护素;核因子κB受体活化因子配体
姜黄素(curcumin)是从植物姜黄根茎中分离出来的天然多酚类产物。近年来在体外和体内对姜黄素进行了广泛的研究[1-2],发现姜黄素具有抗肿瘤、抗病毒、抗关节炎、抗氧化等作用,其作用机制涉及到多个靶点,包括转录因子如核因子κB(NF-κB),生长因子如血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),炎性细胞因子如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素1( interleukin 1,IL-1)、IL-6,蛋白激酶如丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)和Akt,以及其他酶如环氧合酶2(cyclooxygenase-2,COX-2)。由于其有效性,安全性及多目标调控性,姜黄素成为一个潜在的治疗及预防类风湿关节炎的药物。
类风湿关节炎(rhuematoid arthritis,RA)是一种慢性炎症性疾病,以多关节滑膜炎为特征伴随软骨及骨破坏,引起关节畸形,甚至导致患者残疾。且RA的发病率随着环境及空气的污染呈逐年增高的趋势[3]。RA骨破坏包括局灶性炎症活动部位的骨侵蚀和关节周围的骨量减少,其机制并未被完全阐明,诸多证据表明RANK/RANKL通路是RA的骨质流失的关键因素。RA动物模型支持RANK/RANKL系统在骨侵蚀中发挥作用,AA大鼠模型是最常见的RA动物模型,其造模方法简单,成功率高[4]。本文通过观察姜黄素对AA大鼠血清OPG、RANKL蛋白表达及骨密度的影响,进一步探讨其对RA的作用机制,为姜黄素治疗RA提供动物实验参考。
1材料与试剂
1.1动物
雄性SD大鼠30只,清洁级,实验起始体质量140~160 g,(南京军区南京总医院的实验动物中心供应,使用许可证:SYXK20030032)。
1.2试剂
姜黄素溶液:浓度为5 mg/mL(将姜黄素500 mg溶解于无菌的二甲基亚砜(dimethyl sulfoxide,DMSO)10 mL,加无菌生理盐水直至100 mL,用5 mL注射器进行分装,保存需要避光,冰箱温度调节在-20 ℃,1周内使用完,禁止反复冻融。
2实验方法
2.1分组及造模方法
将大鼠以随机数字表法分为3组:正常组,模型组,姜黄素组,每组10只。用标准饲料饲养,饮水自由,将室温控制在18~26℃之间,湿度调控在70%左右,适应性喂养1周。除了正常组不造模,将其余2组大鼠左后跖处进行常规消毒,皮内注射完全弗氏佐剂0.1 mL,制成AA模型,造模当天记做第0天。
2.2给药方法
模型组、姜黄素组,于第7天开始腹腔注射给药。姜黄素组给予姜黄素溶液50 mg/kg·d,连续21天;模型组给予10% DMSO,5 mg/kg·d,连续21天;正常组自由饮水。于最后一次姜黄素治疗后24小时,即第28天将大鼠仰卧位固定头部、四肢,行腹主动脉取血,离心,取血清,低温冰箱保存备检,ELISA法检测血清RANKL、OPG蛋白的表达;取血后处死大鼠,剥离大鼠右侧胫骨,双能X线骨密度仪(dual energy x-ray absorptiometry,DXA)测量大鼠胫骨骨密度记做整体骨密度,及胫骨远端1 cm处的兴趣区域骨密度记为兴趣区骨密度。
2.3检测指标和方法
2.3.1整体及兴趣区骨密度处死大鼠后,剥离大鼠右侧胫骨,取其标本,用DXA进行检测,记录整个胫骨的整体骨密度及兴趣区骨密度。
2.3.2血清RANKL、OPG蛋白表达参考文献[5]及试剂盒说明,离心机离心→取血清保存备检→激活标本→分别取OPG的ELISA试剂盒与RANKL的ELISA试剂盒→加入0.5 mL的蒸馏水混匀,配制成10 ng/mL溶液→标准管8管→第1管加入标本稀释液900 μL→第2至8管加入标本稀释液500 μL→在第1管中加入10 ng/mL的标准品溶液100 μL混匀后加样器吸出500 μL移至第2管→如此反复稀释,从第7管中吸出500 μL弃去,第8管为空白对照组→洗涤液:用重蒸水1:20稀释→加样:每孔各加入标准品或待测样品100 μL,将反应板充分混匀后至37℃120分钟→洗板:用洗涤液将反应板充分洗涤4~6次,向滤纸上印干→每孔加入第一抗体工作液100 μL,将反应板充分混匀后至37℃60分钟→洗板:同前→每孔加入酶标抗体工作液100 μL,将反应板充分混匀后至37℃ 30分钟→洗板:同前→每孔加入底物工作液100 μL,至37 ℃暗处15分钟→每孔加入100 μL终止液混匀→30分钟内用酶标仪在40 nm处测吸光值→结果计算:以标准品1000、500、250、125、62、31、15.6、0 pg/mL作为横坐标,光密度(optical density,OD)值为纵坐标,建立标准曲线→经多元回归计算结果。
2.4统计学处理

3结果
注射完全弗氏佐剂后3~4小时,造模组所有大鼠左后足即可出现红、肿的炎症表现;第3天左右达到高峰;第7天左右4只足爪均有不同程度的肿胀,表明造模成功。本实验的造模成功率为100%。
3.13组大鼠骨密度的比较
3组大鼠右侧胫骨整体骨密度之间比较均无显著性差异(P>0.05);模型组大鼠兴趣区骨密度值显著低于正常组大鼠兴趣区骨密度(P<0.01);姜黄素组大鼠兴趣区骨密度值显著高于模型组(P<0.01)。由此可见,大鼠造模后一定时间(28天)内整体胫骨骨密度未出现显著性降低。而造模组大鼠胫骨远端的骨密度出现显著性降低,姜黄素的治疗能显著抑制AA骨密度下降,治疗后骨密度与正常组无显著性差异,详见表1。

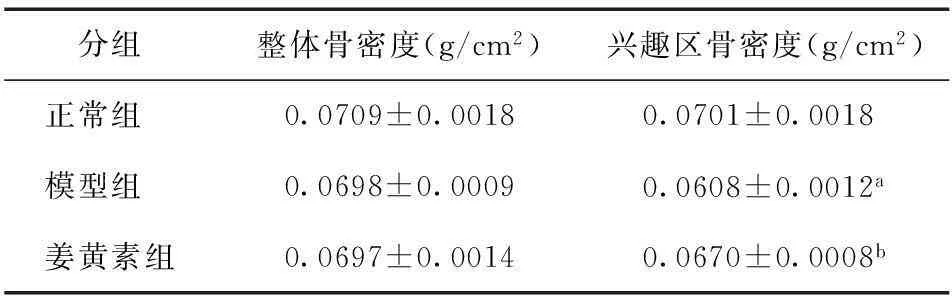
分组整体骨密度(g/cm2)兴趣区骨密度(g/cm2)正常组 0.0709±0.00180.0701±0.0018模型组 0.0698±0.00090.0608±0.0012a姜黄素组0.0697±0.00140.0670±0.0008b
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01。
3.23组大鼠血清RANKL、OPG及其比值的比较
由表2可见,大鼠血清RANKL,与正常组比较,模型组、姜黄素组均显著升高(P<0.01);与模型组比较,治疗组即姜黄素组显著降低(P<0.01)。大鼠血清OPG,与正常组比较,模型组、姜黄素组均显著降低(P<0.01);与模型组比较,姜黄素组显著升高(P<0.01)。RANKL/OPG比值,与正常组大鼠比较,模型组、姜黄素组均显著升高(P<0.01);与模型组比较,姜黄素组显著降低(P<0.01)。姜黄素能够通过改变血清RANKL及OPG的表达,来改变其比值。
表2各组大鼠血清RANKL、OPG及其比值的比较
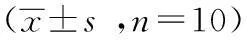
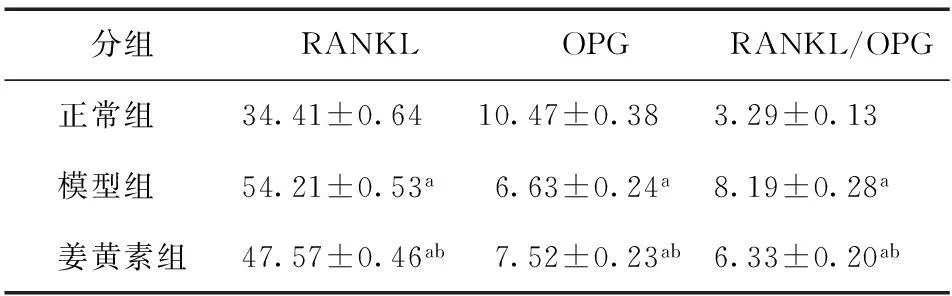
分组RANKLOPGRANKL/OPG正常组 34.41±0.6410.47±0.383.29±0.13模型组 54.21±0.53a6.63±0.24a8.19±0.28a姜黄素组47.57±0.46ab7.52±0.23ab6.33±0.20ab
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01。
4讨论
RA这一病名是由英国人Garrod第一个提出的,发病后表现为小关节肿胀疼痛等炎症症状,进而出现受累部位骨丢失,随着病情进展,骨破坏加重,呈不可逆性,如未进行正规治疗,2年内关节软骨及骨的破坏可达到50%[6]。关节软骨及骨破坏是RA的重要病理特征,而局部的骨侵蚀又是RA患者关节畸形、功能障碍的最主要原因,因此早期预防及控制骨破坏是改变RA预后的关键。RA的骨破坏早期表现为受累关节软骨及骨组织由病理组织取代,进一步发展为软骨及骨侵蚀,最终导致全身性的骨丢失,破坏关节结构。
OPG/RANKL/RANK信号途径是免疫系统紊乱疾病(包括RA)与骨破坏之间联系的重要通路,破骨细胞(Osteoclast,OC)是参与骨破坏的主要细胞,而OPG/RANKL/RANK系统在OC分化成熟及活性保持中起着重要作用[7]。在正常的骨重建过程中,RANKL蛋白结合RANK,促使破骨细胞的生成,保持其活性,促进骨的吸收功能。当骨的吸收大于骨的形成时,成骨细胞系自动分泌更多的OPG,假性受体竞争结合RANKL,阻止RANKL与受体RANK结合,抑制破骨细胞生成、活化,抑制骨吸收功能,使骨吸收与骨形成又处于一个相对稳定的状态[8]。而骨丢失是RA特征性标志,其丢失程度与病情严重程度有关,本实验采用DXA检查大鼠胫骨整体及兴趣区的骨密度,通过骨密度来评价AA大鼠骨丢失情况。检查测得大鼠骨密度的情况:造模后28天,所有组大鼠的整体骨密度差异无显著性差异。由此可见,大鼠造模后一定时间(28天)内整体胫骨骨密度并不会出现显著降低。而胫骨远端1 cm的骨密度即兴趣区骨密度,模型组兴趣区的骨密度是显著低于正常组的。而与模型组比较,药物干预组即姜黄素组显著升高。姜黄素,化学结构为C21H20O6,研究发现其对免疫、细胞因子、转录因子具有调节作用,因此能够产生广泛的生物学效应。但姜黄素难以溶于水,易于溶于DMSO等有机溶剂,本实验将姜黄素溶解于10%DMSO制成姜黄素溶液后,进行药物干预,目的是为了让大鼠能够更加好的吸收姜黄素,并且同时给予模型组大鼠腹腔注射10%的DMSO,以观察姜黄素对AA大鼠的治疗作用。本实验中观察到在大鼠造模28天内,胫骨远端存在着一定程度的骨丢失,姜黄素能够抑制胫骨远端骨密度的降低。
研究表明[9-11]诸多炎症细胞因子(TNF-α、IL-1、IL-7、IL-17、IL-23、IL-34)能够影响RA的炎症及骨破坏,目前没有有力的证据可以证明这些细胞因子能够直接激活破骨细胞,但有证据表明绝大多数细胞因子是通过RANKL/RANK通路间接调节破骨细胞分化及活性,从而发挥作用。炎性细胞因子通过诱导成骨细胞表达RANK,结合滑膜RANKL,来激活NF-κB或JNK,增强T细胞和DC的协同作用,促进破骨细胞的分化和增殖,最终导致软骨及骨质破坏。本实验采用ELISA法测得大鼠血清RANKL、OPG蛋白的表达,并计算出RANKL/OPG的比值。AA模型大鼠血清RANKL表达明显增加,OPG的表达明显减少,RANKL/OPG的比值明显增加,骨密度检查,兴趣区的骨密度明显低于其它组的大鼠,进一步表明AA炎症发生骨质破坏重要通路为OPG/RANKL通路。姜黄素干预治疗AA模型大鼠后,能降低血清的RANKL的表达,提高OPG的表达,最终RANKL/OPG的比值显著均低于模型组。因此可见,姜黄素能够影响到外周血清RANKL、OPG的含量,最终使得RANKL/OPG的比值显著低于模型组。由此推测,在RA治疗中,姜黄素通过调控RANKL/OPG的比值,来调节OPG/RANKL系统,从而参与到抑制RA骨丢失,防止RA骨破坏。
综上所述,姜黄素对RA具有肯定的治疗作用,通过降低血清RANKL表达,提高血清OPG的表达,降低RANKL/OPG的比值,维护RA骨吸收和骨形成的动态平衡,有效预防骨质破坏,防止关节损伤,提高其骨密度,改善RA的预后。姜黄素是传统中药的有效提取物,具有安全性较高,价格便宜等优点,进一步研究姜黄素,可能成为治疗RA的重要药物。
参考文献
[1]Gulcubuk A,Haktanir D,Cakiris A,et al.Effects of curcumin on proinflammatory cytokines and tissue injury in the early and late phases of experimental acute pancreatitis[J].Pancreatology,2013,13(4):347-354.
[2]Kloesch B,Becker T,Dietersdorfer E,et al.Anti-inflammatory and apoptotic effects of the polyphenol curcumin on human fibroblast-like synoviocytes[J].Int Immunopharmacol,2013,15(2):400-405.
[3]Gan RW,Deane KD,Zerbe GO,et al.Relationship between air pollution and positivity of RA-related autoantibodies in individuals without established RA: a report on SERA[J].Ann Rheum Dis,2013,72(12):2002-2005.
[4]Seferos N,Pantopoulou A,Kotsiou A,et al.The influence of simvastatin in rats mandible and femur bone mass under Freund’s adjuvant arthritis[J].Stomatologija,2012,14(2):46-52.
[5]Salah H,Atfy M,Fathy A,et al.The clinical significance of OPG/sRANKL ratio in thalassemia patients suffering from osteopenia or osteoporosis in Egyptian patients[J].Immunol Invest,2010,39(8):820-832.
[6]何勇,王旭,顾湘杰,等.类风湿性关节炎足部病变的影像学研究[J]. 中国矫形外科杂志,2009,17(5): 348-351.
[7]Teitelbaum S L,Ross F P. Genetic regulation of osteoclast development and function[J]. Nature Reviews Genetics,2003,4(8):638-649.
[8]Schett G,Hayer S,Zwerina J,et al. Mechanisms of disease: the link between RANKL and arthritic bone disease[J]. Nature Clinical Practice Rheumatology,2005,1(1): 47-54.
[9]施青,王美美. IL-17 和 RANKL 在胶原诱导性关节炎大鼠关节滑膜的表达及99Tc-TDP的干预作用[J]. 现代医学,2010,(2):116-122.
[10]Chen Z,Kim SJ,Chamberlain ND,et al.The novel role of IL-7 ligation to IL-7 receptor in myeloid cells of rheumatoid arthritis and collagen-induced arthritis[J].J Immunol,2013,190(10):5256-5266.
[11]Shiozawa S,Tsumiyama K,Yoshida K,et al.Pathogenesis of joint destruction in rheumatoid arthritis[J].Arch Immunol Ther Exp (Warsz),2011,59(2):89-95.
(本文编辑:董历华)
·论著·
作者单位:100853 北京,中国人民解放军总医院中医科
Effect of curcumin on the expression of blood serum osteoprotegerin and receptor activator of nuclear factor-κB ligand protein and bone mineral density in adjuvant arthritis ratsZHAOLing-jie,QIUYan,SHANGWei,etal.DepartmentofIntegratedTraditionalandWesternMedicine,NanjingGeneralHospitalofNanjingMilitaryRegion,Nanjing210002,China
【Abstract】ObjectiveBy observing the effects of curcumin on blood serum osteoprotegerin (OPG) and receptor activator of nuclear factor-κB ligand (RANKL) protein and bone mineral density of adjuvant arthritis (AA) rat models, we try to explore the possible mechanism of curcumin preventing bone destruction in rheumatoid arthritis. Methods30 SD rats were randomly divided into model group, curcumin group and normal group. On day 28 draw blood from abdominal aorta to detect the expression of blood serum RANKL and OPG protein by ELISA method. After drawing blood, rats were sacrificed and stripped the right tibia, to examine bone density. Results(1) Compared with the normal group, the serum RANKL of model group and curcumin group rats were significantly increased (P< 0.01), the serum OPG expression were significantly decreased (P< 0.01), the ratio of RANKL/OPG were significantly increased (P< 0.01); (2) Compared with the model group, the serum RANKL of curcumin group was significantly decreased (P< 0.01), the serum OPG was significantly increased (P< 0.01), the ratio of RANKL/OPG was significantly decreased (P< 0.01); (3) There are no significant differences among the 3 groups’ tibia bone mineral density (P> 0.05). The bone mineral density in region of interest of curcumin group was significantly higher than that of the model group (P< 0.01). ConclusionsCurcumin has a good therapeutic effect on AA rats. Curcumin regulates the expression of blood serum RANKL and OPG, thus regulate the OPG/RANKL pathway, thereby improve bone mineral density in AA rats to inhibit the bone loss.
【Key words】Curcumin;Adjuvant arthritis;Bone mineral density;Osteoprotegerin;Receptor activator of nuclear factor-kappa B ligand
作者简介:窦永起(1965- ),硕士,主任医师,教授,博士生导师。研究方向:中西医结合防治恶性肿瘤。E-mail:dyqi_301@yeah.net
(收稿日期:2014-05-14)
Corresponding author:ZHAO Ling-jie,Email:zhaolingjie68@163.com
【中图分类号】R593.22
【文献标识码】A
doi:10.3969/j.issn.1674-1749.2015.03.013
