扁桃生理落果期不同组织激素浓度的动态变化及其对落果的影响
2015-03-03车玉红郭春苗徐叶挺刘河疆
杨 波,车玉红,郭春苗,龚 鹏*,徐叶挺,孙 涛,刘河疆
(1 新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2 新疆农业职业技术学院,新疆昌吉 831100;3 新疆农业科学院中心实验室,乌鲁木齐 830091)
扁桃生理落果期不同组织激素浓度的动态变化及其对落果的影响
杨波1,车玉红2,郭春苗1,龚鹏1*,徐叶挺1,孙涛3,刘河疆3
(1 新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2 新疆农业职业技术学院,新疆昌吉 831100;3 新疆农业科学院中心实验室,乌鲁木齐 830091)
摘要:为探明扁桃幼果生理脱落与GA3、IAA和ABA等3种激素的关系,以新疆‘纸皮’扁桃为试材,分析新梢、结果枝组、幼果和果柄(包括正常发育幼果和果柄、即将脱落幼果和果柄)中3种内源激素浓度的动态变化规律,并分别涂抹3种外源激素调查其对坐果率的影响。结果表明:(1)‘纸皮’扁桃幼果脱落期和新梢生长期重合,扁桃生理落果期不同组织中3种内源激素浓度变化趋势与新梢生长期和幼果脱落期的动态特征基本一致。(2)扁桃生理落果期间,正常的和即将脱落的幼果及其果柄中内源激素浓度呈规律性变化,即:GA3和IAA浓度表现为正常果和正常果果柄始终大于相应的落果和落果果柄,而内源ABA浓度表现则与之相反,同时对应外源涂抹试验也印证了幼果和幼果果柄中高GA3和IAA浓度、低ABA浓度有利于扁桃坐果。(3)新梢和幼果中对应内源激素之间的浓度平衡关系也是调控扁桃幼果生理脱落的重要因素,即:新梢与幼果的GA3比值和IAA比值增大、而ABA比值减少将会促进幼果脱落,反之则减缓幼果脱落。
关键词:扁桃;幼果;生理脱落;激素
扁桃(AmygdaluscommunisL.)是新疆的特色果树,具有很高的经济价值,近年来栽培面积已达6.67万公顷。然而,坐果率低一直是扁桃产量提高和效益增加的主要限制因素,减少非正常落果,提高坐果率是生产中迫切需要解决的问题。与许多南北方果树一样,扁桃的幼果发育与新梢生长处于同一时期,新梢和幼果均具有合成激素的能力,是果树代谢活动中心,但国内外学者在研究幼果脱落与激素的关系时,都只对比检测了脱落幼果与正常发育幼果间内源激素的含量变化差异[1-6],在幼果发育过程中新梢、结果枝组、幼果(包括正常果和脱落果)等不同组织中的内源激素的含量变化规律还未见研究报道。因此,本研究以新疆主栽扁桃品种‘纸皮’为研究对象,在整个扁桃幼果生理脱落期考察新梢、结果枝组、正常发育幼果和果柄、即将脱落幼果和果柄内吲哚乙酸(indole-3-aceticacid,IAA)、赤霉素(gibberellin,GA3)和脱落酸(abscisic acid,ABA)3种激素的含量变化,以及在不同组织上外源涂抹3种激素对扁桃坐果率的影响,以期进一步从激素的角度揭示扁桃幼果脱落的生理机制。
1材料和方法
1.1材料及试验概况
田间试验于2013年3~6月份在新疆喀什莎车县托木斯塘乡11村扁桃园内进行。土壤质地为沙壤土,其理化性状为:pH 7.9、有机质16.8%、碱解氮74.9 mg/kg、有效磷15.6 mg/kg、速效钾144.2 mg/kg。试验用扁桃品种为‘纸皮’扁桃(AmygdaluscommunisL.cv.Zhipi),2001年定植,株行距6 m×7 m,中等树势,管理较好。在园内随机选取78株生长一致的树,其中30株用于落果规律和新梢生长量的观察及不同组织中内源激素的测定,另外48株用于外源激素涂抹试验。
1.2试验方法
1.2.1新梢生长和生理落果的动态观察和内源激素采样内源激素测定试验所用30株树,于开花前在每株树冠外围中部东南西北4个方向选择挂果量较一致的结果枝进行挂牌、编号,每株挂牌30个结果枝,其中5个结果枝用于调查果实脱落和新梢生长情况,25个结果枝用于取新梢、结果枝、果实样进行内源激素分析。于盛花后(全树75%花已开放,下同)7 d(4月5日)开始到盛花后57 d(5月30日)结束,每隔5 d调查1次新梢长度及落果率,取果样1次,直至幼果脱落期结束。具体取样方法:于上午11:00在每株取样植株上选取发育正常和即将脱落的带果柄的果实各30~50个,新梢尖30个,长5 cm的结果枝30根,置于冰壶中立即带回实验室。样品均用去离子水清洗干净后,分正常果、正常果果柄、落果、落果果柄、结果枝和新梢6部分用液氮-80 ℃保存用于测定内源激素,每个样品重复3 次。
1.2.2外源激素涂抹试验外源激素涂抹试验所用48株树,采用随机区组、单因素三重复试验,于开花前在每株树冠外围中部东南西北4个方向选择挂果量较一致的结果大枝进行挂牌、编号,每株挂牌4个结果枝。于花后7 d(4月5日)调查统计第一次坐果数后,分别用细毛笔在幼果、幼果果柄、结果枝组、新梢4个部位涂抹100 mg/L GA3(分析纯)、50 mg/L IAA(分析纯)和10 mg/L ABA(分析纯),以涂抹清水为对照。在花后14 d(4月12日)重复涂抹1次。在幼果生理脱落期结束后(5月30日)调查统计最终坐果数,计算坐果率。
坐果率(%)=(最终坐果数/第一次坐果数)×100%
1.2.3生理落果率及新梢生长的调查参照Wang等[7]的方法,分别统计相对落果率(%·d-1)=[(Nt-1-Nt)/N0·d]×100%,累积落果率(%)=[(N0-Nt)/N0]×100%。式中,N0为初始坐果数量,Nt-1和Nt分别表示前后相邻2个时期的坐果数量,d是调查的间隔天数。同时,测量留梢树结果枝上的新梢长度,每株测量5条新梢。
1.2.4内源激素含量的测定内源激素测定试验于2013年6~8月在新疆农业科学院实验室进行。具体测定方法参照高启明等[6]的方法(略有改动)。具体实验流程为:称取5 g样品加入经过冷却的80%甲醇溶液50 mL在组织捣碎机上高速匀浆,于4 ℃冷藏过夜。低温离心10 min,上清液倒入离心管。残渣用20%冷却甲醇重复提取1次,离心,上清液合并入离心管。离心管中加入PVPP 1 g,充分摇匀离心10 min,上清液过C18柱,流出液低温浓缩后,氮气吹干,加入5 mL缓冲液溶解(pH 3)漩涡混匀后,分别加入15 mL乙酸乙酯萃取2次,静置10 min,乙酸乙酯层(上层)转入浓缩瓶,低温浓缩至干,加入2 mL甲醇溶解,过0.2 μm滤膜,上机。
实验条件为:采用1200安捷伦液相色谱系统,检测波长为210 nm。所用激素标准品GA3、IAA和ABA均系美国生产,厦门星隆达化学试剂有限公司分装。乙腈和甲醇为TEDIA公司产品。其它试剂均为分析纯,实验用水均为超纯水。
色谱条件为:C18色谱柱,柱温为室温,流动相为甲醇:乙腈:磷酸缓冲液=15:15:70(体积比),流速为1 mL/min,出峰顺序为GA3(3.1 min)、IAA(9.1 min)、ABA(13.0 min)。
1.3数据分析
试验数据统计分析采用DPS 9.50和Excel统计分析软件完成。
2结果与分析
2.1扁桃新梢生长和生理落果的动态特征
田间观测结果(图1)显示,扁桃在3月31日进入盛花期,而此时扁桃叶芽也开始萌发;扁桃盛花后7 d第一次坐果时,结果枝组上新梢平均长度也长到1.28 cm,此后生长开始加速,37 d后基本进入自剪期(顶芽自行凋落),42 d后完成枝条的伸长生长,新梢平均长度为17.8 cm。其中,从盛花后第7天到第22天的15 d内(4月5日到4月20日),新梢从1.28 cm长到了12.11 cm,占到总长度的68.03%,是新梢生长的快速生长期。
图1同时显示,扁桃于盛花后第7天开始出现幼果脱落,到第47天结束,整个生理落果过程持续了40 d,即从4月5日开始到5月15日结束,整个幼果生理脱落期可分为快速脱落期和缓慢脱落期2个阶段。快速脱落期从盛花后第7天至第22天,历经15 d,此期的累计落果率达到63.59%,落果数占总落果数的79.06%,此阶段有明显的落果高峰,即出现在盛花后第17天(4月15日),其相对落果率达到最高值(41.85%),此时的累计落果率达到了55.43%;缓慢脱落期从盛花后第22天至第47天(4月20日到5月15日),历经25 d,此期落果数占总落果数的20.94%,但此阶段没有出现明显的落果高峰。整个扁桃幼果生理脱落期累计落果率达到了80.43%。
另外,从图1还可看出,扁桃的新梢生长期与幼果脱落期基本重合,可分为Ⅰ、Ⅱ 2个阶段。其中,Ⅰ阶段从盛花后第7天到第22天(4月5日到4月20日),累积15 d,既是扁桃新梢生长的快速生长期也是扁桃幼果的快速脱落期;Ⅱ阶段从盛花后第22天到第47天(4月20日到5月15日),共计25 d,既是扁桃新梢生长的缓慢生长期也是扁桃幼果的缓慢脱落期。
2.2扁桃生理落果与不同组织中3种内源激素含量的关系
2.2.1落果与内源GA3含量的关系由表1可见,在扁桃整个幼果生理脱落期内不同组织中GA3浓度不同,从大小顺序始终为新梢、正常果、正常果果柄、结果枝、落果和落果果柄。新梢中GA3的平均浓度为552.57 ng·g-1,分别是正常果、正常果果柄、结果枝、落果和落果果柄的2.01、2.79、4.52、18.95和15.97倍。
同时,在扁桃整个幼果生理脱落期内,新梢、正常果和正常果果柄的GA3含量较高且变化比较剧烈,其余器官的含量低变化幅度小。其中,新梢和正常果中GA3浓度呈先升高后逐渐降低的单峰曲线变化,其峰值均出现在盛花后的第17天(此时处于新梢生长期Ⅰ阶段),新梢和正常果中GA3浓度最高分别达到988.77和445.20 ng·g-1;正常果果柄的GA3含量变化与新梢和正常果稍有不同,其峰值(327.68 ng·g-1)出现在盛花后的第12天。此后新梢、正常果、正常果果柄中GA3的浓度均随着扁桃幼果脱落落果率和新梢生长量的放缓而逐渐降低。同时,结果枝组中GA3浓度在整个生理落果期的变化较为平稳,维持在122.16 ng·g-1左右。
另外,整个扁桃幼果生理脱落期,落果和落果果柄中GA3浓度一直处于低水平,平均值分别为29.16和34.60 ng·g-1,而正常果和果柄则分别为274.31和198.12 ng·g-1,落果与正常果、落果果柄与正常果果柄差异极显著,说明果实和果柄中高水平的GA3浓度有利于坐果。
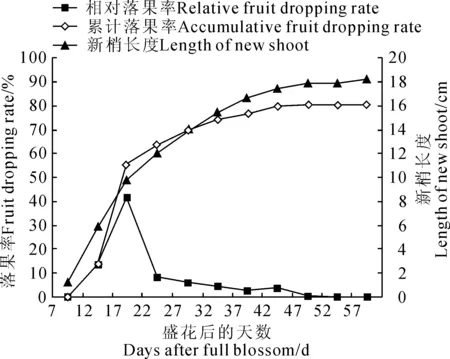
图1 扁桃新梢生长规律和生理落果率的动态变化
2.2.2落果与内源生长素含量的关系由表2可见:在扁桃整个幼果生理脱落期内不同组织中内源生长素(IAA)的浓度不同,并表现为新梢>正常果>正常果果柄、结果枝>落果和落果果柄。新梢中IAA的平均浓度为132.32 ng·g-1,分别是正常果、正常果果柄、结果枝、落果和落果果柄的2.61、3.47、3.44、29.87和26.73倍。
表2同时显示,在扁桃整个幼果生理脱落期内,新梢、正常果、正常果果柄、结果枝组中IAA含量均呈逐渐降低的趋势变化,其峰值均出现在Ⅰ阶段(盛花后第12天,此时正为扁桃落果高峰的前夕),其中新梢、正常果、正常果果柄和结果枝组峰值分别为197.92、87.20、61.12和79.99 ng·g-1;此后随着扁桃幼果脱落落果率和新梢生长量的放缓,不同组织中IAA的浓度逐渐降低,且整个生理脱落期结果枝组和正常果果柄中IAA的浓度大小互有涨落;另外,整个扁桃幼果生理脱落期,落果和落果果柄中IAA的浓度一直处于较低水平,平均值为4.43和4.95 ng·g-1,而正常果和果柄则分别为50.59和38.09 ng·g-1,落果与正常果、落果果柄与正常果果柄IAA浓度差异极显著,说明扁桃果实中高水平的生长素浓度有利于其坐果。
2.2.3落果与内源脱落酸含量的关系扁桃不同组织内源ABA浓度存在差异,在新梢生长Ⅰ阶段表现为落果果柄>新梢>落果>结果枝>正常果果柄和正常果,而在Ⅱ阶段则表现为新梢>落果果柄>结果枝>落果>正常果果柄和正常果(表3)。

表1 扁桃生理落果期不同组织中赤霉素含量的动态变化
注:经邓肯式新复极差法显著性测定,不同大写和小写字母表示组织间差异分别达到0.01和0.05显著水平;下同。
Note:Different capital and normal letters indicate significantly different among tissues at the 0.01 and 0.05 level by Duncan’s multiple range test,respectively.The same as below.

表2 扁桃生理落果期不同组织中生长素含量的动态变化
在扁桃整个幼果生理脱落期内,新梢中ABA浓度呈上升趋势;脱落幼果的果实、果柄、结果枝组中ABA浓度变化呈先快速上升后逐渐降低的单峰曲线变化,其中脱落幼果的果实和果柄中最高值出现在盛花后第17天,正值相对落果率的最高峰。新梢、脱落幼果的果实和果柄中ABA浓度的变化规律基本与新梢生长规律和生理落果率的动态变化曲线(图1)吻合。由此可见,扁桃组织中ABA含量调节了果实发育及新梢生长。
另外,整个扁桃幼果生理脱落期,落果和落果果柄中ABA含量在整个生理落果阶段明显高于正常果和正常果果柄,落果中ABA浓度平均值(17.97 ng·g-1)是正常果(7.12 ng·g-1)的2.52倍,而落果果柄(33.91 ng·g-1)是正常果果柄(8.38 ng·g-1)的4.05倍,差异达到极显著水平。可见,扁桃幼果和果柄中高ABA浓度会导致幼果脱落。
2.3扁桃生理落果期新梢与幼果(正常果和落果)比值的动态变化
进一步分析发现,扁桃幼果整个生理脱落期新梢与正常果中3种激素的浓度比值均呈规律变化,而新梢与落果中3种激素的浓度比值变化不规律(图2)。其中,GA3在新梢生长期Ⅰ阶段,新梢和正常果中GA3浓度都急剧增加,但新梢中GA3浓度增加更为迅速,新梢和正常果的浓度比值差距进一步拉大(盛花后12 d新梢与正常果间GA3浓度比值为1.98,而盛花后17 d的相对落果率高峰出现后,比值则增大到2.22),此后随着扁桃幼果脱落落果率和新梢生长量的放缓,新梢和幼果之间的浓度比值则逐渐达到相对平衡的状态。因此推测:新梢和正常果中GA3浓度比值可能是调节扁桃幼果发育的重要因素,新梢和幼果比值增大促进幼果脱落,比值减小减缓幼果脱落。
IAA比值的变化与GA3类似,在盛花后12 d新梢与正常果间IAA的浓度比值为2.27,到盛花后第22天达到高峰(2.52),而到盛花后42 d于幼果脱落和新梢生长尾声时比值降为2.11;而且随着扁桃幼果脱落落果率和新梢生长量的放缓,新梢与正常果间的IAA比值则逐渐达到相对平衡的状态。这说明新梢与幼果中IAA的浓度比值可能是调节扁桃幼果发育的重要因素,即新梢和幼果比值增大促进幼果脱落,比值减小减缓幼果脱落。

表3 扁桃生理落果期不同组织中脱落酸含量的动态变化

图2 扁桃生理落果期新稍和幼果中激素浓度比值的动态变化

涂抹部位Applyingsite100mg/LGA350mg/LIAA10mg/LABA幼果Youngfruit46.37±14.57aA27.72±0.70bAB18.52±1.41cBC幼果果柄Youngfruitstalk24.84±1.73bA20.84±1.77cC17.05±1.99cC结果枝组Fruitingbranchsection29.35±2.45bA33.4±1.39aA26.35±2.07aA新梢Newshoot23.29±2.81bA23.69±0.45bcBC26.71±0.55aA对照CK22.53±2.80bA22.53±2.80cBC22.53±2.80bAB
而ABA在扁桃幼果整个生理脱落期随着落果的逐渐降低,新梢与正常果的ABA含量比值也逐渐增加大。经计算,盛花后12 d新梢与正常果间ABA浓度比值为2.74,而到盛花后42 d幼果脱落和新梢生长尾声时,比值升高为8.77。这表明新梢和幼果中ABA浓度比值可能是调节扁桃幼果发育的重要因素,新梢和幼果比值减小促进幼果脱落,比值增大减缓幼果脱落。
2.4外源激素涂抹不同组织对扁桃坐果率的影响
由表4可知,各类激素涂抹处理对扁桃坐果率的影响也不同。其中,GA3涂抹在幼果上时坐果率显著增加(为对照的1.06倍),而涂抹在幼果果柄、结果枝组及新梢部位时,虽然坐果率与对照相比有所增加,但差异不显著。同时,IAA涂抹在幼果上时坐果率极显著增加了48%,涂抹在结果枝组上时坐果率显著增加了23%,而涂抹在幼果果柄和新梢部位时与对照差异不显著,当涂抹在幼果果柄时甚至与对照相比坐果率有所降低。以上研究结果与前人在甜椒[8]、石榴[9]、柿子[10]上外源施用GA3、IAA等激素有利于坐果的研究结果一致。另外,ABA涂抹在幼果和幼果果柄上时坐果率分别极显著降低了17.80%和24.32%,而涂抹在结果枝组合新梢部位时,虽然坐果率与对照相比有所增加,但差异不显著。以上结果说明幼果中赤霉素和的生长素含量对减少幼果脱落起主要作用,而幼果和果柄中脱落酸的含量对幼果脱落起主要作用。
3讨论
已有的研究表明新梢的生长与果实的发育之间存在碳水化合物竞争:如有研究发现桃[11]、澳洲坚果[12]、荔枝[13]等果树碳素营养可在新梢及果实间转运,也有研究发现澳洲坚果[14]、苹果[15-16]上的新梢生长则会消耗果实碳素营养。本研究中‘纸皮’扁桃的幼果脱落期和新梢生长期基本重合,整个过程持续了40 d左右,已有研究发现这一时期扁桃幼果生长最为迅速,果实生长体积占总生长体积量90%左右[17-18],而新梢也在这一时期完成了营养生长,说明扁桃幼果的发育和新梢生长间营养竞争十分激烈,可见这一时期(盛花后的7~47 d)是“纸皮”扁桃田间管理的关键时期。另外,本研究中在扁桃的生理脱落期,不同组织中3种激素(IAA、GA3和ABA)含量的变化趋势与新梢生长和幼果脱落的变化规律基本吻合,证明激素在调节营养生长与生殖生长间的平衡间起着重要作用。
有关在枣[1]、龙眼[2]、荔枝[3]、脐橙[5]、扁桃[6]上的研究认为,幼果中低含量的IAA和高含量的ABA是导致生理落果的原因之一。而本研究结果表明:扁桃生理落果期间,不同组织中GA3浓度表现为:新梢>正常果>正常果果柄>结果枝>落果和落果果柄,IAA浓度则为:新梢>正常果>正常果果柄、结果枝>落果和落果果柄,而ABA浓度为落果果柄>新梢>落果>结果枝>正常果果柄和正常果(Ⅰ阶)和新梢>落果果柄>结果枝>落果>正常果果柄和正常果(Ⅱ阶段)。 由此可见,脱落幼果及其果柄内GA3和IAA浓度均明显低于正常发育幼果,而其ABA浓度则明显高于正常发育幼果,这与前人的研究结果一致。另外,本研究的外源激素涂抹试验结果表明,幼果上涂抹GA3和IAA可提扁桃高坐果率,涂抹ABA则降低了坐果率,从而进一步印证了上述结论。
本研究中生理落果还决定于不同组织间各种内源激素之间的浓度平衡关系。Ⅰ阶段是新梢和幼果中3种内源激素含量变化最为激烈的时期,这一时期新梢与发育正常幼果之间的GA3、IAA的浓度比值都比较大,而其间的ABA的比值较小,且最大和最小值均出现在相对落果率的最高峰(盛花后第17天),而激素信号与碳信号间存在着网联作用[19],新梢中高浓度的GA3和IAA、低浓度的ABA诱导树体内营养物质向新梢流动,导致大量幼果脱落;Ⅱ阶段内新梢和幼果等各组织中3种内源激素含量变化则相对平缓,这一时期新梢和发育正常幼果中GA3、IAA浓度比值都变小,而ABA比值变大,且最小和最大值均出现在相对落果率的末期(盛花后第42天),新梢中低浓度GA3和IAA、高浓度ABA诱导树体内和叶片中营养物质向幼果流动,减缓幼果的脱落,促进果实的发育。
综上所述,本试验结果进一步表明,在扁桃的幼果发育期,新梢和幼果中内源激素之间的浓度平衡关系是导致扁桃幼果生理脱落的重要原因:GA3和IAA浓度在新梢与幼果之间的比值增大则促进幼果脱落,比值减小则减缓幼果脱落,而ABA浓度在新梢与幼果之间的比值减小则促进幼果脱落,比值增大则减缓幼果脱落。
参考文献:
[1]HU F M(胡芳名),XIE B X(谢碧霞),LIU J J(刘佳佳),etal.Researchonthe changes of endogenous hormones during growth and development of Jujube fruit[J].JournalofCentralSouthForestryUniversity(Nat.Sci.Edi.)(中南林业科技大学学报·自然科学版),1998,18(3):32-36(in Chinese).
[2]SU M H(苏明华),LIU ZH CH(刘志成),ZHUANG Y M(庄伊美).Effeets of endogenous hormoneson fruit in the fruit in‘Shuizhang” longan on fruit abscission[J].ChineseJournalofTropicalCrops(热带作物学报),1998,19(1):64-69(in Chinese).
[3]ZHOU B Y(周碧燕),JI Z L(季作梁),YE Y CH(叶永昌),etal.Changes of endogenous hormones in litchi fruits during fruit development[J].ActaHorticulturaeSinica(园艺学报),1998,25(3):236-240(in Chinese).
[4]GARCIA-PAPI M A,GARCIA-MARTINEZ J L.Endogenous plant growth substances content in young fruit of seeded and seedless clementine mandarin as related to fruit set and development[J].Sci.Hortic.,1984,22:265-274.
[5]姚珍珍.晚熟脐橙落花落果生态影响因子及生理机制研究[D].重庆:西南大学,2012.
[6]LUO SH P(罗淑萍),GAO Q M(高启明),LI J(李疆).Changes in endogenous hormones during young fruit development of almond[J].PlantPhysiologyCommunications(植物生理学通讯),2007,43(2):355-359(in Chinese).
[7]WANG Y C,LI T L,MENG H Y,etal.Optimal and spatial analysis of hormones degrading enzymes and isozyme profiles in tomato pedicel explants during ethylene-induced abscission[J].PlantGrowthRegulation,2005,46:97-107.
[8]APARNA T,REMKO O,EP H.Auxin-induced fruit set inCapsicumannuumL.requires downstream gibberellin biosynthesis[J].PlantGrowthRegul.,2012,31:570-578.
[9]AZIZ R A,NAIRA A,MOIEZA A.Effect of plant biostimulants on growth,chlorophyll content,flower drop and fruit set of pomegranate cv.Kandhari Kabuli[J].Environment&Biotechnology,2013,6(2):305-309.
[10]CHIJIWA H,ASAKUMA H,ISHIZAKA A.Development of seedless PCNA persimmon(DiospyroskakiThunb.) cv.‘Fukuoka K1 Gou’ and the effect of gibberellin spray and/or disbudding on fruit set[J].EngeigakuKenkyu,2013,12(3):263-267.
[12]TRUEMAN S J,TURNBULL C G N.Fruit set abscission and dry matter accumulation on girdled branches of macadamia[J].AnnalsofBotany,1994,74(6):667-674.
[13]HIEKE S,MENZEL C M,DOOGAN V J,etal.The relationship between fruit and leaf growth in lychee(LitchichinensisSonn.)[J].JournalofHorticulturalScienceandBiotechnology,2002,77:320-325.
[14]MCFADYEN L M,ROBERTSON D,SEDGLEY M,etal.Post-pruning shoot growth increases fruit abscission and reduces stem carbohydrates and yield in macadamia[J].AnnalsofBotany,2011,107(6):993-1 001.
[15]DAL C V,BOSCHETTI A,DORIGONI A,etal.Benzylaminopurine application on two different apple cultivars(Malusdomestica) displays new and unexpected fruitlet abscission features[J].AnnalsofBotany,2007,99(6):1 195-1 202.
[17]MEI L X(梅立新),GUO CH H(郭春会),SHEN Y H(申烨华).Characteristicsof introduced almond varieties[J].JournalofFruitScience(果树学报),2003,20(3):236-238(in Chinese).
[18]QIAO J CH(乔进春),ZHU M L(朱梅玲),YANG M SH(杨敏生),etal.Study on the properties of blooming and bearing for almond[J].JournalofFruitScience(果树学报),2002,19(3):167-170(in Chinese).
[19]CHEN J W(陈俊伟),XIE M(谢鸣),QIN Q P(秦巧平).Connections of sugar and hormone signaling in plants[J].PlantPhysiologyCommunications(植物生理学通讯),2005,41(3):279-286(in Chinese).
(编辑:裴阿卫)
Dynamic Change of Hormones in the Different Tissue of Almond
during the Physiological Fruit Drop and Its Effect on Fruit Drop
YANG Bo1,CHE Yuhong2,GUO Chunmiao1,GONG Peng1*,
XU Yeting1,SUN Tao3,LIU Hejiang3
(1 Institute of Horticulture,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;2 Xinjiang Agricultural Professional Technology College,Changji,Xinjiang 831100 China;3 Center Laboratory,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China)
Abstract:In order to make clear the relationship between physiological fruit drop and 3 kinds of hormones IAA,GA3and ABA,we used Xinjiang Zhipi almond to study the dynamic change of three kinds of endogenous hormones in new shoots,fruiting branch sections,young fruits and fruit stalks of the normal fruits and fruits which was about to fall.The fruit setting rate was also tested by applying these three hormones on different tissues,respectively.The results showed that:(1)The changing tendency of three kinds of endogenous hormones in different tissues were consistent with the growing of new shoots and physiological fruit drop.(2)During the physiological fruit drop,GA3and IAA in the normal fruits was always greater than that of the fruits which was about to fall.The hormones in the fruit stalks of normal ones were also greater than that in fruit stalks of the dropping ones.Changes of ABA were just the opposite.(3)It was proven by the internal analysis and external applying of these hormones that high level of GA3and IAA,and low level of ABA in young fruits and their stalks were helpful to fruit set;Concentration ratio between endogenous hormones in new shoots and young fruits was an important factor for the regulation of physiological fruit drop in almond.High level of GA3(new shoots )/GA3(young fruits),IAA(new shoots)/IAA(young fruits) and low level of ABA (new shoots)/ABA(young fruits) would induce fruit drop,vice versa.
Key words:almond;young fruit;physiological fruit drop;endogenous hormones
中图分类号:Q945.6+4
文献标志码:A
作者简介:杨波(1982-),男,助理研究员,主要从事果树栽培与生理研究。E-mail:yangboyys@163.com*通信作者:龚鹏,研究员,主要从事果树栽培与生理研究。E-mail:gongpeng0923@sina.cn
基金项目:国家自然科学基金(31460497);新疆农业科学院优秀青年人才基金(xjnky-2012-035);新疆维吾尔自治区高技术项目(201111121)
收稿日期:2014-08-13;修改稿收到日期:2014-10-16
文章编号:1000-4025(2015)01-0118-07
doi:10.7606/j.issn.1000-4025.2015.01.0118
