罗汉果花芽分化过程中形态及其激素水平变化特征
2015-03-03莫长明涂冬萍马小军潘丽梅
莫长明,涂冬萍,黄 杰,马小军*,潘丽梅,
姚绍嫦1,冯世鑫1,白隆华1
(1 广西药用植物园,南宁 530023;2 广西大学 农学院,南宁 530004;3 中国医学科学院 药用植物研究所,北京 100193;4 广西中医药大学,南宁 530001)
罗汉果花芽分化过程中形态及其激素水平变化特征
莫长明1,2,涂冬萍3,黄杰4,马小军3*,潘丽梅1,
姚绍嫦1,冯世鑫1,白隆华1
(1 广西药用植物园,南宁 530023;2 广西大学 农学院,南宁 530004;3 中国医学科学院 药用植物研究所,北京 100193;4 广西中医药大学,南宁 530001)
摘要:采用石蜡切片和酶联免疫法(ELISA)对罗汉果雄性、雌性、两性花芽分化过程的形态和激素水平变化进行观测,为罗汉果开花调控和品种选育提供科学依据。结果表明:(1)罗汉果雄性、雌性、两性花的花芽分化过程均可分为花芽未分化期、花芽分化初期、花序分化期、萼片原基分化期、花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化期7个阶段。雄蕊原基分化期前,3种花芽分化过程无明显差异,各时期形态特征均依次为:茎端呈圆锥状(花芽未分化期)→茎端经半球形变成扁平状(花芽分化初期)→距茎端5~7节位处分化出穗状花序(花序分化期)→小花原基周围形成5个萼片原基(萼片原基分化期)→萼片原基内侧形成5个花瓣原基(花瓣原基分化期)。雄蕊和雌蕊原基分化期,3种花芽分化过程存在明显差异,雄蕊原基内侧出现雌蕊原基后,雄花芽雄蕊原基继续发育成雄蕊,雌蕊原基停滞生长,退为一个小突起;雌花芽雌蕊原基继续发育成雌蕊,雄蕊原基生长缓慢,退化为小花丝;两性花芽雌蕊和雄蕊原基均继续发育,形成外观正常的雌蕊和雄蕊。(2)内源激素脱落酸(ABA)、赤霉素(GAs)和玉米素核苷(ZR)含量在3种花芽分化过程中变化规律相似,即ABA含量在花芽生理分化期降低,花芽形态分化期升高,而GAs和ZR含量则基本保持不变;吲哚乙酸(IAA)含量在3种花芽分化过程中变化存在明显差异,雌花芽IAA含量在花芽生理分化期升高,花芽形态分化期逐渐降低,而雄性和两性花芽的IAA含量则基本保持不变。ABA/GAs、ABA/IAA、ZR/IAA和ZR/GAs激素含量比值在3种花芽分化过程中变化规律相似,ABA/GAs在花芽生理分化期降低,花芽形态分化期升高,而BA/IAA、ZR/IAA和ZR/GAs则基本保持不变。研究认为,罗汉果花芽分化过程经历一个“两性期”,高ABA含量和ABA/GAs比值有利于罗汉果花芽分化,IAA可能对罗汉果花性分化具有重要作用。
关键词:罗汉果;花芽分化;形态变化;内源激素
开花和性别是植物的两个重要生物性状,与作物产量和品质密切相关,一直以来是国内外学者研究的热点。花芽分化则是植物开花和性别决定的重要发育阶段。罗汉果(SiraitiagrosvenoriiSwingle C.Jeffrey)为葫芦科药用和甜料植物,具止咳祛痰、润肠通便[1]、抗氧化[2]、抗癌[3]、免疫调节[4]、降血糖[5]等功效,其主要活性成分甜苷Ⅴ[6]还是低热[7]、无毒[8]、高甜度[9]、不引发龋齿[10]的纯天然甜味剂,可为糖尿病和肥胖病患者食用,开发应用受到广泛关注。然而,罗汉果通常雌雄异株,后代群体中雌雄比例约为3:7,苗期性别无法鉴定,致使其育种研究浪费资金和土地严重,阻碍了相关工作开展。另外,罗汉果花芽分化期,遭遇阴雨天,易出现徒长和成花逆转现象,常造成大面积减产甚至绝收。为此,通过数量性状[11]、DNA标记[11-12]、同工酶标记[13]鉴定罗汉果性别和激素诱导其雌花分化[14]等研究相继开展并受到重视,但罗汉果成花转变和性别分化的形态建成、激素诱导、基因调控等机制仍不清楚,以致最佳鉴定与调控时间不确定,有效标识物较缺乏,因而尚未建立有效的性别鉴定和开花调控方法。因此,本研究对罗汉果雄性、雌性、两性花芽分化过程形态和激素变化规律进行全面系统分析比较,为罗汉果开花调控和品种选育提供科学依据。
1材料和方法
1.1材料
选择广西药用植物园种质库保存的罗汉果雄性株系M52、雌性株系F17和两性株系F56为试验材料,2013年4月17日种植于南宁市广西药用植物园科研试验基地。
1.2方法
1.2.1花芽分化解剖观察罗汉果蔓长至20 cm左右时,采集3.5 cm长一级蔓茎尖,此后每3 d采集1次3.5 cm长的二级蔓茎尖,直至现蕾。采集的茎尖放入FAA固定液固定。固定好的材料,按常规石蜡切片法制成厚度8 μm片,于LAICA DM2500数码生物显微镜下观察拍照。另外,不同性别花外观形态采用OLYMPUS SZX7体视显微镜和相机进行观察拍照。
1.2.2内源激素含量测定采样方式同花芽解剖观察试验。采集的茎尖去除叶片后,用剪刀剪取顶端,称取0.2 g茎尖样品,经液氮速冻后,于Thermo 706超低温冰箱-80 ℃保存备用。生长素(IAA)、赤霉素(GAs)、玉米素(ZR)和脱落酸(ABA)测定采用酶联免疫吸附法(ELISA),提取、分离和检测按照中国农业大学王保民博士提供试剂盒的说明进行,检测波长为490 nm。每个时期样品随机采集3个生物学重复,每个生物学重复样品平行测定3次。
1.2.3数据处理试验数据采用Excel 2007软件进行数据整理和作图分析。
2结果与分析
2.1罗汉果花芽分化时期与特征
2.1.1雄花芽形态分化过程雄花芽形态分化过程可分为花芽未分化期、花芽分化初期、花序分化期、萼片原基分化期、花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化及退化等7个时期,各时期主要形态特征如下:
(1)花芽未分化期罗汉果雄株营养茎,茎端呈圆锥状,具有明显的原套、原体结构和细胞组织学分区界限,外面原套为2层排列整齐的细胞,内部原体细胞排列不规则成团状。茎端下方两侧有不同发育阶段的腋芽原基(图版Ⅰ,A)。
(2)花芽分化初期随着植株不断生长,营养茎端发生一系列形态和内部细胞组织学变化,除原套仍保持2层排列整齐的细胞外,生长锥纵向分裂大于横向分裂,原体排列不规则的细胞明显增多,从而宽度增加而高度减少,逐渐增大成半球形(图版Ⅰ,B),最终宽度大于高度转变成宽平的生殖茎端,下方两侧有不同发育阶段的花原基(图版Ⅰ,C),标志着植株由营养生长转变成生殖生长。
(3)花序分化期随着生殖茎端的生长,距顶端5~7节位处花原基延伸为花序轴,按先产生叶状苞片原基,再在其腋内出现半球状小花原基的顺序,依次向上在花序轴两侧互生逐渐减小的叶状苞片原基、小花原基(图版Ⅰ,D),从而形成一个穗状花序。花序上的小花原基从顶端往下逐渐成熟,发育相差至少一个时期(图版Ⅰ,E)。
(4)萼片原基分化期半球状小花原基逐渐变成扁圆形,周围细胞分裂较快,形成5个萼片原基,纵切面仅见2个突起(图版Ⅰ,F)。萼片原基逐渐伸长形成镊合排列的萼片,花开放后萼片大小一致、向外伸展。
(5)花瓣原基分化期随着萼片的伸长,在萼片内侧基部,形成5个与萼片相间的小突起,即花瓣原基(图版Ⅰ,G、H),最终发育成重覆瓦状排列的花瓣,花开放后呈钟状花冠。
(6)雄蕊原基分化期花瓣原基分化后,在其内部基部出现3个雄蕊原基(图版Ⅰ,I)。雄蕊原基基部分生组织,经居间生长,延伸成花丝,顶端膨大形成“S”形花药(图版Ⅱ,F),其中2个雄蕊基部合生顶部分裂,最终形成(2)+(2)+1的“两大一小”三体雄蕊(图版Ⅱ,O)。
(7)雌蕊原基分化及退化雄蕊原基分化后不久,其内侧凹入部分突起3个雌蕊原基。随着雄蕊原基迅速生长发育,雌蕊原基停滞生长,从而相对更显得逐渐缩小,最后退化为一个突起痕迹(图版Ⅰ,J,图版Ⅱ,S)。
2.1.2雌花芽形态分化过程(1)雄蕊原基分化期前罗汉果雄蕊原基分化期前,雌花芽与雄花芽分化过程形态变化相同。即花芽未分化期,营养茎端呈圆锥状(图版Ⅰ,K);花芽分化初期,茎端先呈半球状(图版Ⅰ,L),随后由于细胞不断分裂和分化,顶端扩大变平(图版Ⅰ,M);花序分化期,距顶端5~7节位处花原基延伸,依次向上分化出互生叶状苞片原基与小花原基,形成一个穗状花序(图版Ⅰ,N),花序上的小花原基发育也相差至少一个时期(图版Ⅰ,O);萼片原基分化期,小花原基顶端周围首先出现萼片原基(图版Ⅰ,P);花瓣原基分化期,5个萼片原基形成后,花瓣原基继续在萼片内面突起(图版Ⅰ,Q、R),与萼片交互排列;花瓣原基分化后,在其内部基部3个雄蕊原基(图版Ⅰ,S)和雌蕊原基(图版Ⅰ,T)陆续出现。
(2)雄蕊原基分化期花瓣原基分化早期,在其内侧出现3个突起的雄蕊原基(图版Ⅰ,S)。此后,雄蕊原基分生组织经居间生长,缓慢延伸生长,但顶端不膨大,无花药产生,最终发育成(2)+(2)+1的“两大一小”三体退化小花丝(图版Ⅱ,G~I,图版Ⅱ,Q)。
(3)雌蕊原基分化期雌蕊原基比雄蕊原基分化相对晚些。随着雄蕊原基缓慢生长,其内侧向下凹陷形成下位子房,凹入部分作不等速细胞分裂,分化出3个雌蕊原基(图版Ⅰ,T、U)。半球形雌蕊原基迅速向上分生,下部各相邻两侧边缘不断发育扩张,最后彼此相连愈合形成1室子房,上部镊合成浅裂柱头(图版Ⅰ,V;图版Ⅱ,E)和花柱(图版Ⅱ,Q)。
(4)胚胎原基分化子房发育早期,最先分化出3个伸向子房腔的胎座原基,以后发育成3个各向两侧扩展的侧膜胎座(图版Ⅰ,W、X)。
2.1.3两性花芽形态分化过程罗汉果雄蕊原基分化期前,两性花芽分化过程形态变化与雄花芽、雌花芽相同。此后,雄蕊原基分化同雄花芽,雌蕊原基分化同雌花芽,最终发育成具有外观正常雄蕊和雌蕊的两性花(图版Ⅰ,Y)。两性花是雄花和雌花的组合体,子房、胚胎(图版Ⅱ,A~C、J~L)和雌蕊(图版Ⅱ,P~R)外形同雌花,只是早期雌蕊包裹在雄蕊内部(图版Ⅱ,D~F);萼片、花冠(图版Ⅱ,J~L)和雄蕊(图版Ⅱ,M~R)外形同雄花,不同的是两性花雄蕊无花粉形成。
2.2罗汉果花芽分化过程内源激素含量及比例变化特征
2.2.1雄花芽图1,A显示,雄花芽分化期为9 d左右(6月28日~7月7日)。雄花芽分化期间,茎端中各激素含量从高到低依次为ABA、IAA、ZR、GAs;ABA含量呈现明显波动变化特征,IAA、GAs和ZR含量基本保持不变。其中,ABA含量在一级蔓营养茎端中(6月28日)相对较高,而在花芽生理分化期二级蔓茎端中(7月1日)降低,后又在花芽形态分化期二级蔓茎端中(7月4日~7月7日)迅速升高,并最终达到最高含量。图1,B显示,雄花芽分化期间,茎端中激素比值ABA/GAs最高,ABA/IAA和ZR/GAs次之,ZR/IAA最低;ABA/IAA、ZR/IAA和ZR/GAs比值基本保持不变,ABA/GAs比值呈现明显波动变化特征,比值先降低后升高。
2.2.2雌花芽图2,A显示,雌花芽分化期为15 d左右(6月28日~7月13日)。雌花芽分化期间,茎端中ABA、IAA含量均高于GAs与ZR含量,GAs与ZR含量基本保持不变,ABA与IAA含量呈现明显波动变化。其中,ABA含量呈现先降低后升高的趋势,其首先在一级蔓营养茎端中相对较高(6月28日),而在花芽生理分化期(6月28日~7月4日)二级蔓茎端中降低,随后在花芽形态分化期(7月4日~7月13日)二级蔓茎端中又逐渐升高,并于现蕾二级蔓茎端中最高;IAA含量则先升高后逐渐降低,其先在一级蔓营养茎端中相对较高(6月28日),并在花芽生理分化期(7月1日)二级蔓茎端中升到最高,随后在花芽形态分化期(7月4日~7月13日)二级蔓茎端中逐渐降低,并在现蕾二级蔓茎端中最低。
图2,B显示,雌花芽分化期间,茎端中各激素比值以ABA/GAs最高,ABA/IAA和ZR/GAs次之,ZR/IAA最低;ABA/IAA、ZR/GAs与ZR/IAA比值基本不变,ABA/GAs比值呈现明显波动变化。ABA/GAs比值在营养生长期(6月28日)至花芽生理分化期(7月1日)降低,于花芽生理分化期(7月1日)至花芽形态分化期(7月4日~7月13日)又逐渐升高,并在现蕾二级蔓茎端中达到最高值。
2.2.3两性花芽图3,A显示,罗汉果两性花芽分化期为12 d左右(6月28日~7月10日)。两性花芽分化期间,茎端中ABA、IAA含量均高于GAs和ZR含量,GAs、IAA和ZR含量基本保持不变,而ABA含量呈现明显波动变化。ABA含量先降低,然后迅速升高,最后保持在一个较高水平。其中,ABA含量在一级蔓营养茎端中相对较高(6月28日),而后在花芽生理分化期(7月1日)二级蔓茎端中大幅降低,随后在花芽形态分化期(7月4日~7月10日)二级蔓茎端中又迅速升高,最后于现蕾二级蔓茎端中维持在较高水平。图3,B显示,罗汉果两性花芽分化期间,茎端中各激素比值以ABA/GAs最高,ABA/IAA和ZR/GAs次之,ZR/IAA最低;ABA/GAs比值呈现明显波动变化,而ABA/IAA、ZR/GAs和ZR/IAA比值则基本保持不变。ABA/GAs比值于罗汉果营养生长期(6月28日)至花芽生理分化期(7月1日)之间迅速降低,随后在花芽生理分化期(7月1日)至花芽形态分化期(7月7日)之间逐渐升高,并于现蕾二级蔓茎端中基本保持不变(7月13日)。

图1 雄花芽分化过程内源激素含量(A)及其比例(B)变化

图2 雌花芽分化过程内源激素含量(A)及其比例(B)变化
以上实验结果表明,雄性、雌性和两性花芽分化过程均可分为花芽未分化期、花芽分化初期、花序分化期、萼片原基分化期、花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化期,期间需经历一个“两性期”(雌蕊原基分化期);3种花芽分化过程形态变化,雄蕊原基分化期前无明显区别,雄蕊和雌蕊原基分化期则存在明显差异;高ABA含量和ABA/GAs比值有利于3种花芽分化,IAA可能对罗汉果花性分化具有重要作用。
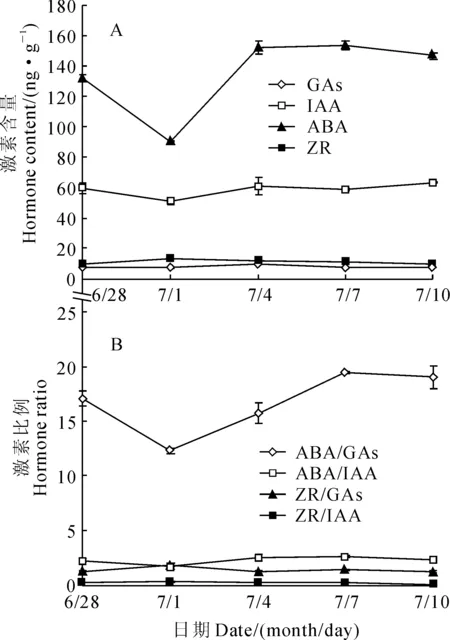
图3 两性花芽分化过程内源激素含量(A)及其比例(B)变化
3讨论与结论
葫芦科植物花芽分化通常为由外向内进行。罗汉果花芽分化依次经过花芽未分化期、花芽分化初期、花萼原基分化期、花瓣原基分化期、雄蕊原基分化期、雌蕊原基分化期,属于由外向内分化型,与南瓜[15]、薄皮甜瓜[16]、油瓜[17]、白兰瓜[18]等葫芦科植物一致。同时,南瓜[15]、西葫芦[19]花芽分化过程无“两性期”,油瓜[17]、白兰瓜[18]、苦瓜[20]与黄瓜[21]花芽分化过程则首先经历一个“两性期”,再分别向雄花或雌花方向发育。本研究的罗汉果雄花中发现有退化的雌蕊原基突起,雌花中发现有退化雄蕊花丝,两性花中发育出外形正常的雄蕊和雌蕊,仅雄蕊花药中花粉败育,表明罗汉果花芽分化首先经历“两性期”,性器官原基再选择性诱导发育或败育,形成雄花、雌花或两性花,与苦瓜和黄瓜花芽分化过程一致。罗汉果祖先应该是一种两性花,其两性花突变属于一种返祖现象。另外,罗汉果3个心皮连合生长,形成无缝隙一室子房,无心皮结合遗留痕迹,与南瓜[15]、白兰瓜[18]、西葫芦[19]和甜瓜[22]中的观察结果一致,与油瓜的3个心皮边缘向两侧扩张、联合形成遗留明显缝隙的一室子房不同[17]。
本研究中,罗汉果雄性、雌性、两性花芽分化成长持续时间不同,雄花为9 d左右,雌花为15 d左右,两性花为12 d左右;从营养生长(6月28日一级蔓摘心)进入至花芽分化初期(7月4日花芽顶端变得宽平),三者所需时间均为3~6 d左右,此后(7月4日)为花芽形态分化期。可见,罗汉果花芽分化生理期为3~6 d左右,雄花通常比雌花现蕾早1周左右,两性花现蕾期则介于二者之间。
目前,关于植物花芽分化研究表明,赤霉素具有抑制作用,且与其浓度和种类有关,高浓度和GA3、GA7具有抑制作用,低浓度和GA4则具有促进作用;细胞分裂素则具有促进作用;生长素具有双重作用,低浓度是开花所必需的,高浓度则抑制开花[23]。脱落酸是否参与植物花芽分化存在争议,除有的认为与诱导开花和花器官发育(尤其早期花器官发育)有关外,也有认为对成花具有促进和抑制双重作用,还有的认为同茎梢的停止生长有关而与成花无关。激素诱导成花的机制尚不清楚,大多数学者认为不是单一激素调控决定的,而是激素间相互作用的结果,并提出“激素平衡假说”[23]。大量研究结果显示,较高的CTKs/GAs、CTKs/IAA、ABA/GAs、ABA/IAA比值有利于花芽分化和形成[24]。本研究发现,在罗汉果雄性、雌性和两性花芽分化过程中,花芽形态分化期ABA含量均大幅累积增加,ABA/GAs比值也均明显升高,说明ABA含量和ABA/GAs比值升高有利于罗汉果花芽分化,与覃喜军等研究结果相近;同时,IAA含量在雌花芽分化过程中出现明显下降,而在雄花芽、两性花芽分化过程中则基本保持不变,表明IAA对罗汉果花性分化可能具有重要作用,有望作为雌株鉴定的标识物。
参考文献:
[1]中华人民共和国药典委员会.中华人民共和国药典(第1部)[S].北京:中国医药科技出版社,2010:197.
[2]QI X Y(戚向阳),CHEN W J(陈维军),ZHANG L Q(张俐勤),etal.Study on the inhibitory effects of natural sweetner mogrosides on radical and lipid peroxidation[J].ScientiaAgriculturaSinica(中国农业科学),2006,39(2):382-388(in Chinese).
[3]TAKASAKI M,KONOSHIMA T,MURATA Y,etal.Anticarcinogenic activity of natural sweeteners cucurbitane glycosides fromMomordicagrosvenori[J].CancerLetters,2003,198(1):37-42.
[4]CHEN W J(陈维军),SONG F F(宋方方),LIU L G(刘烈刚),etal.Effects of mogroside extract on cellular immune functions in alloxan-induced diabetic rats[J].ActaNutrimentaSinica(营养学报),2006,28(3):221-225(in Chinese).
[5]QI X Y(戚向阳),CHEN W J(陈维军),SONG Y F(宋云飞),etal.Efficacy study onSiraitiagrosvenoripowder and its extracts on reducing blood glucose in diabetic rabbits[J].FoodScience(食品科学),2003,24(12):124-127(in Chinese).
[6]LIU T(刘婷),WANG X H(王旭华),LI CH(李春),etal.Study on the antitussive,expectorant and antispasmodic effects of saponin Ⅴ fromMomordicagrosvenori[J].ChinesePharmaceuticalJournal(中国药学杂志),2007,42(20):1 534-1 536,1 590(in Chinese).
[7]YASUSHI A.S,YUJI M,HIROSHI I,etal.Triterpene glycosides ofSiraitiagrosvenoriinhibit rat intestinal maltase and suppress the rise in blood glucose level after a single oral administration of maltose in rats[J].J.Agric.FoodChem.,2005,53:2 941-2 946.
[8]JIN M,MUGURUMA M,MOTO M,etal.Thirteen-week repeated dose toxicity ofSiraitiagrosvenoriextract in wistar hannover (GALAS) rats[J].FoodChem.Toxicol.,2007,45:1 231-1 237.
[9]RYOJI K,NIE R L,KENJI N,etal.Sweet cucurbitane glycosides from fruits ofSaraitiasiamensis(chi-ziluo-han-guo).A Chinese folk medicine[J].Agric.Biol.Chem.,1989,53:3 347.
[10]KINGHORN A D,KANEDA N,BAEK N I,etal.Noncariogenic intense natural sweeteners[J].Med.Res.Rev.,1998,18(5):347-360.
[11]TAO L(陶莉),WANG Y J(王跃进),YOU M(尤敏),etal.Construction of AFLP fingerprints and seedling sex discrimination ofSiraitiagrosvenori(Swingle)[J].JournalofWuhanBotanicalResearch(武汉植物学研究),2005,23(1):77-80(in Chinese).
[12]QIN X M(秦新民),HUANG X Y(黄夕洋),JIANG SH Y(蒋水元).RAPD markers linked to sex inSiraitiagrosvenori(Swingle) C.Jeffrey[J].JournalofGuangxiNormalUniversity(Nat.Sci.Edi.)(广西师范大学学报·自然科学版),2007,25(3):109-112(in Chinese).
[13]LI H M(李惠敏),HUANG X Y(黄夕洋),GAO CH W(高成伟),etal.Sex identification ofSiraitiagrosvenoriby isozyme analysis[J].Guihaia(广西植物),2007,27(5):792-795(in Chinese).
[14]QIN X J(覃喜军),HUANG X Y(黄夕洋),JIANG SH Y(蒋水元),etal.Changes in endogenous hormones during floral bud differentiation ofSiraitiagrosvenorii(Swingle) C.Jeffrey[J].PlantPhysiologyCommunications(植物生理学通讯),2010,46(9):939-942(in Chinese).
[15]QIN J F(秦俊芬),GE Y(葛宇),QU SH P(屈淑平),etal.Anatomy of flower bud differentiation in pumpkin[J].JournalofNortheastAgriculturalUniversity(东北农业大学学报),2011,42(10):66-69(in Chinese).
[16]HAO J H(郝敬虹),QI H Y(齐红岩),YAN N(阎妮).Morphology and anatomy of flower bud differentiation in melon[J].JournalofShenyangAgriculturalUniversity(沈阳农业大学学报),2007,38(4):602-604(in Chinese).
[17]YANG X H(杨兴华).Study on the development pistillate flowers and staminate flowers inHodgsoniamacrocarpaCogn[J].ActaBotanicaSinica(植物学报),1978,20(4):314-322(in Chinese).
[18]KANG W J(康文隽),SUN B(孙彬).Study of the development of floral bud of Bailan melon[J].JournalofLanzhouUniversity(Nat.Sci.Edi.)(兰州大学学报·自然科学版),1985,12:93-99(in Chinese).
[19]KANG W J(康文隽).Study of the development of floral bud ofCucurbitapepoL.[J].JournalofLanzhouUniversity(Nat.Sci.Edi.)(兰州大学学报·自然科学版),1987,23(1):93-100.
[20]WANG Q M(王俏梅),ZENG G W(曾广文).Studies on expression of sex differentiation program inMomrdicacharantiaL.[J].JournalofZhejiangUniversity(Agric & Life Sci)(浙江大学学报·农业与生命科学版),2002,28(3):243-248(in Chinese).
[21]YUAN G F(袁高峰),ZHAO P Q(赵普庆),SUN H Y(孙海燕),etal.Micromorphlogical analysis of sex organ development and SDS-PAGE profile of male flowers at their later developmental stages in cucumber(CucumissativusL.)[J].JournalofZhejiangUniversity(Agric & Life Sci)(浙江大学学报·农业与生命科学版),2005,31(2):145-150(in Chinese).
[22]KANG W J(康文隽),SUN B(孙彬),CHEN R J(陈汝进).Study of the development of floral bud of lantian 5 melon[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),1986,6(3):177-181(in Chinese).
[23]QU B(曲波),ZHANG W(张微),CHEN X H(陈旭辉),etal.Research progress of flower bud differentiation mechanism of plants[J].ChineseAgriculturalScienceBulletin(中国农学通报),2010,26(24):109-114(in Chinese).
[24]CAO SH Y(曹尚银),ZHANG Q M(张秋明),WU SH(吴顺).Advances of in research on the mechanism of flower-bud differentiation of fruit trees[J].JournalofFruitScience(果树学报),2003,20(5):345-350(in Chinese).
Explanation of plate:
Plate ⅠMorphological differentiation of male,female and bisexual flower buds ofS.grosvenorii
GP.Grown primordium;ABP.Axillary bud primordium;TU.Tunica;CO.Corpus;LP.Leaf primordium;IP.Inflorescence primordium;BL.Bracteal leaf primordium;SFP.Small floral primordium;SE.Sepal primordium;PE.Petal primordium;SP.Stamen primordium;PI.Pistil primordium;CA.Carpel
Fig.A.Flower bud undifferentiation phase of male flower buds,×40;Fig.B,C.Flower bud initial differentiation phase of male flower buds,×100;Fig.D,E.Inflorescence differentiation phase of male flower buds,×100;Fig.F.Sepal primordial differentiation phase of male flower buds,×200;Fig.G,H.Petal primordial differentiation phase of male flower buds,×100;Fig.I.Stamen primordial differentiation phase of male flower buds,×100;Fig.J.Pistil primordial differentiation phase of male flower buds,×100;Fig.K.Flower bud undifferentiation phase of female flower buds,×40;Fig.L,M.Flower bud initial differentiation phase of female flower buds,×100;Fig.N,O.Inflorescence differentiation phase of female flower buds,×100;Fig.P.Sepal primordial differentiation phase of female flower buds,×100;Fig.Q,R.Petal primordial differentiation phase of female flower buds,×100;Fig.S.Stamen primordial differentiation phase of female flower buds,×100;Fig.T-V.Pistil primordial differentiation phase of female flower buds,×40;Fig.W.Embryonic primordial differentiation phase of female flower buds,×1.6;Fig.X.Embryonic primordial differentiation phase of female flower buds,×10;Fig.Y.Pistil primordial differentiation phase of bisexual flower buds,×40.
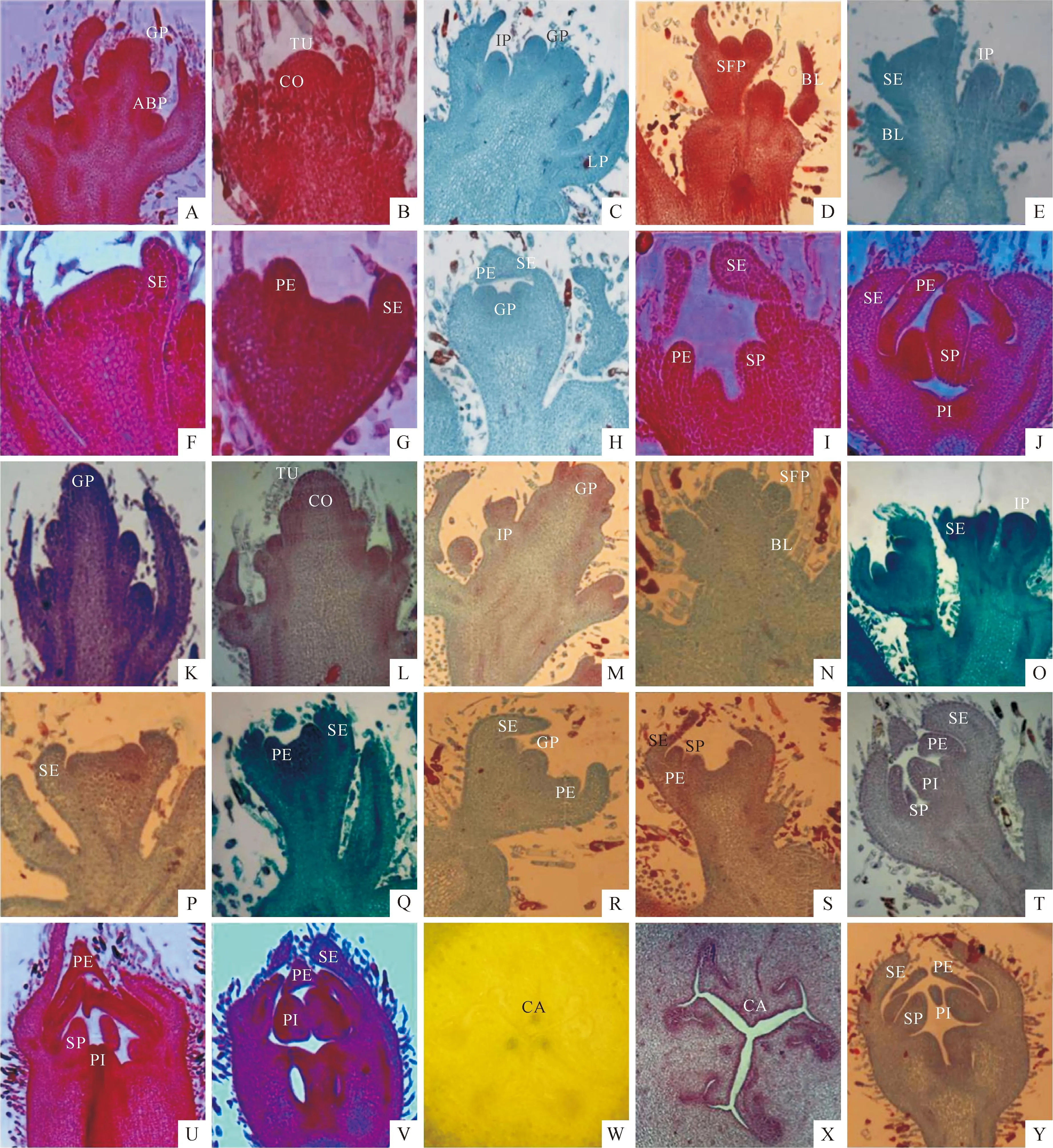
图版 Ⅰ罗汉果雄性、雌性与两性花芽分化过程形态变化
GP.生长锥;ABP.腋芽原基;TU.原套;CO.原体;LP.叶原基;IP.花序原基;BL.苞片原基;SFP.小花原基;SE.萼片原基;PE.花瓣原基;SP.雄蕊原基;PI.雌蕊原基;CA.心皮
A.雄花芽未分化期,×40;B、C.雄花芽分化初期,×100;D、E.雄花芽花序分化期,×100;F.雄花芽萼片原基分化期,×200;G、H.雄花芽花瓣原基分化期,×100;I.雄花芽雄蕊原基分化期,×100;J.雄花芽雌蕊原基分化期,×100;K.雌花芽未分化期,×40;L、M.雌花芽分化初期,×100;N、O.雌花芽花序分化期,×100;P.雌花芽萼片原基分化期,×100;Q、R.雌花芽花瓣原基分化期,×100;S.雌花芽雄蕊原基分化期,×100;T~V.雌花芽雌蕊原基分化期,×40;W.雌花芽胚胎原基分化,×1.6;X.雌花芽胚胎原基分化,×10;Y.两性花芽雌蕊原基分化期,×40。

图版 Ⅱ罗汉果两性花、雌花和雄花器官形态比较
A~C.两性、雌性和雄性花蕾纵切面;D~F.两性、雌性和雄性花蕾雌雄蕊表观;G~I.两性、雌性和雄性花蕾雌雄蕊横切面;J~L.两性、雌性和雄性成熟花萼片与花冠外观;M~R.两性、雌性和雄性成熟花雌蕊与雄蕊外观;S.雄性成熟花退化雌蕊。
Plate ⅡOrgan comparison of bisexual,female and male flowers ofS.grosvenorii
Figs.A-C.Longitudinal section of bisexual,female and male flower buds;Figs.D-F.Top view of the stamen and pistil in bisexual,female and male flower buds;Figs.G-I.Transverse section of the stamen and pistil in bisexual,female and male flower buds;Figs.J-L.Sepal and petal appearance of bisexual,female and male opening flowers;Figs.M-R.Stamen and pistil appearance in bisexual,female and male opening flowers;Fig.S.Pistillode in male opening flowers.
(编辑:裴阿卫)
Morphological and Endogenous Hormones Characteristics of
Flower Bud ofSiraitiagrosvenoriiduring Its Differentiation
MO Changming1,2,TU Dongping3,HUANG Jie4,MA Xiaojun3*,PAN Limei1,
YAO Shaochang1,FENG Shixin1,BAI Longhua1
(1 Guangxi Botanical Garden of Medicinal Plant,Nanning 530023,China;2 Agricultural College,Guangxi University,Nanning 530004,China;3 Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences,Beijing 100193,China;4 Medicinal College,Guangxi University of Chinese Medicine,Nanning 530001,China)
Abstract:Morphological changes were observed by the paraffin section method,and the content changes of endogenous hormones were determined by ELISA for male,female and bisexual flower buds ofSiraitiagrosvenorii.The results showed that:First,the whole process of their flower bud differentiation could be divided into seven phases,including flower bud undifferentiation phase,flower bud initial differentiation phase,inflorescence differentiation phase,sepal primordial differentiation phase,petal primordial differentiation phase,stamen primordial differentiation phase and pistil primordial differentiation phase.Morphological characters of three kinds of flower buds were same before the stamen primordial differentiation phase,that stem apical were conical in flower bud undifferentiation phase,stem apical changed into flat from hemispherical in flower bud initial differentiation phase,spikes were initiated at 5-7 bits away from the stem apical in inflorescence differentiation phase,five sepal primordial were initiated around the small flower primordial in sepal primordial differentiation phase.While in the phase of stamen and pistil primordial differentiation,there were significant differences in morphological characters of the three kinds of flowers bud differentiation.After the pistil appeared inside of the stamen primordial,stamen primordial continued to develop into stamens and female primordial stopped growth then reduced to a small projection in male flower buds.The pistil primordial continued to develop into pistils and the stamen primordial grew slowly then reduced to small filaments in female flower buds.But,both the stamen and pistil primordial continued to develop into the normal stamens and pistils in bisexual flower buds.Second,the variations of endogenous hormones ABA,GAs and ZR contents were similar in the course of the three flower bud differentiation.ABA content decreased in flower bud physiological differentiation period and increased in flower bud morphological differentiation period,while the contents of GAs and ZR were maintained.There were significant differences of the IAA content in the course of the three flower bud differentiation,increased in flower bud physiological differentiation period and decreased in flower bud morphological differentiation period of the female flower buds,while the content was maintained in male and bisexual flower buds.The endogenous hormone ratios of ABA/GAs,ABA/IAA,ZR/IAA and ZR/GAs had the similar variation in the three kinds of flower bud differentiation.ABA/GAs decreased in flower bud physiological differentiation period and increased in flower bud morphological differentiation,while the ratios of BA/IAA,ZR/IAA and ZR/GAs were maintained.The studies suggested that the flower bud differentiation processed through hermaphrodite primordium phase,and high ABA content and the ratio of ABA/GAs were beneficial to flower bud differentiation inSiraitiagrosvenorii.IAA possibly made an important role during sex differentiation ofSiraitiagrosvenorii.
Key words:Siraitiagrosvenorii;flower bud differentiation;morphological change;endogenous hormones
中图分类号:Q944.58;Q945.6
文献标志码:A
作者简介:莫长明(1977-),男,硕士,副研究员,主要从事罗汉果遗传育种。E-mail:mochming@126.com*通信作者:马小军,教授,博士生导师,主要从事药用植物遗传育种。E-mail:xjma@public.bta.net.cn
基金项目:“十二五”国家科技支撑项目(2011BA101B03);广西自然科学基金项目(2012GXNSFAA053043);广西自然科学基金重点项目(2013GXNSFDA019021);中国医学科学院药用植物研究所创新团队发展计划(121306)
收稿日期:2014-08-21;修改稿收到日期:2014-11-08
文章编号:1000-4025(2015)01-0098-09
doi:10.7606/j.issn.1000-4025.2015.01.0098
