肾细胞癌基因改变和相关肿瘤疫苗治疗进展
2015-03-03曾进陈忠
曾进 陈忠
·专家论坛·
肾细胞癌基因改变和相关肿瘤疫苗治疗进展
曾进 陈忠
一、肾细胞癌基因改变
肾细胞癌(renal cell carcinoma,RCC)分为遗传性和散发性两类,其中Von Hippel-Lindau Disease(VHLD) RCC具有遗传性。VHLD患者中RCC的发病率高达45%,近1/3的患者死于RCC。有文献报道三代中共有10人患RCC,其3与8、3与11号染色体间平衡交互易位,此种易位可能激活myc基因[1]。
近年来研究证实,几乎80%的散发性RCC在遗传学上呈现出多态性。7、17号3倍染色体及Y染色体丢失为其最早的核型改变,染色体3P的缺失或易位与RCC的发生有密切的关系[1]。有报道对58例RCC组织染色体进行了分析,发现88%患者有染色体3P杂合性缺失,且该区域接近VHL基因。资料显示,92%的RCC患者VHL基因出现变异;而在该基因没有变异的患者中,约40%患者的TCEB 1基因出现了变异。研究还现,BAP 1基因变异增加RCC患者的死亡风险,SETD 2基因变异则会提高RCC的转移风险[2]。
肾透明细胞癌和乳头状RCC(papillary renal cellcarcinoma,PRCC)Ⅰ、Ⅱ型占RCC的大部分(分别占70%~80%、15%~20%)。研究表明,约60%肾透明细胞癌及其细胞系都有VHL基因突变,而PRCC与VHL基因突变关系不大。已知,RCC是一类多基因相关的肿瘤,不同组织病理学类型的RCC有相对特殊的基因改变, 如肾透明细胞癌涉及VHL、PBRM 1 等基因;PRCC涉及3q、7、12、16、17、20、Y等基因,其中Ⅰ型PRCC涉及MET 基因,Ⅱ型PRCC涉及FH 基因;肾嫌色细胞癌涉及1、2、6、10、13、17、21以及BHD 基因;肾集合管癌涉及1q、6p、8p、13q、21q等[1]。
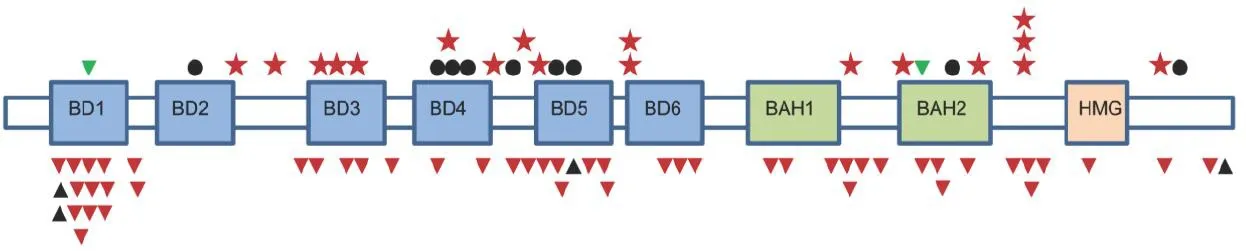
图1 PBRM 1基因突变
近来,癌基因组图谱确定了PRCCⅠ型和Ⅱ型的分子特征,Ⅰ型和Ⅱ型之间存在一些特异的分子差异以及Ⅱ型PRCC的3种不同亚型。而且,每一种具有不同的分子改变和特征,其中一种亚型的特点为整个基因组数千基因超甲基化。DNA甲基化是一种DNA分子修饰,可以控制基因的开启或关闭,一旦出现差错会导致肿瘤发生。这种Ⅱ型PRCC的新亚型叫做CpG岛甲基化表型(CIMP),在所有PRCC类型中其总生存率最低,可能与参与代谢的某基因发生改变有关,从而导致CIMP肿瘤细胞的代谢发生变化,由此支持了它们的快速生长与存活。
近期研究发现,在肾透明细胞癌患者中还存在着数种反复发生的基因突变,包括位于 3p 位点的基因突变。Polybromo 1(PBRM 1)基因变异(图1)就是其中之一[2],在 40% 的肾透明细胞癌患者中会出现 PBRM 1 的截短突变(truncating mutation)[3]。PBRM 1 编码 Baf180 蛋白,后者与转录器中 SWI/WNF 染色质重塑复合物的亚单位相关。同样位于 3p 的 BAP 1 在 15% 的肾透明细胞癌患者中发生突变,它编码的蛋白与脱泛素相关,后者是泛素介导的蛋白质水解旁路(UMPP)的一部分,该旁路具有包括 VHL 在内的 135 个基因。编码 UMPP 的基因与缺氧诱导因子过度表达相关。研究结果显示,与 PBRM 1 突变的肿瘤患者相比,BAP 1 突变的肿瘤患者更容易出现侵袭性病变和表现不良的病理学特征,从而导致患者生存率的显著不同。国内学者发现,肾透明细胞癌中PBRM 1基因突变率较高,突变主要位于第15、17外显子,PBRM 1基因突变可能是肾透明细胞癌患者预后不良的危险因素[4]。
目前认为,PBRM 1基因突变是除VHL变异基因外最重要的发现,绝大多数RCC都与这两个基因的变异相关[5]。然而,PBRM 1基因损坏或被关闭的确切原因至今尚不清楚。
二、相关肿瘤疫苗
目前,肿瘤疫苗的研究得到了人们越来越多的关注,新的肿瘤疫苗靶向成为治疗转移性肾细胞癌(metastatic renal cell carcinoma,mRCC)的新思路,取得了令人满意的临床效果。
1.基因疫苗:又称DNA疫苗,是利用基因工程技术将编码肿瘤特异性抗原的基因结合于表达载体上(重组病毒或质粒DNA),再将疫苗直接注入机体,借助载体本身和机体内的基因表达系统表达出期望的抗原,从而诱导特异性的细胞免疫应答。因此,如何确定针对性强的肿瘤相关抗原编码基因,以及如何有效保证目的基因在体内充分表达,是基因疫苗的研究重点[6]。目前,RCC-DNA疫苗尚未进入临床试验阶段。
2.个体化多肽疫苗(personalized peptide vaccination,PPV):是指根据肿瘤患者的个体遗传基因结构和功能差异,从一系列候选多肽中选出至多4种与人类白细胞抗原A1亚型(HLA-A1)匹配的多肽,制作成肿瘤疫苗,从而激发患者体内对肿瘤的特异性免疫应答,延长其生存时间[7]。多肽疫苗 IMA901由10种肿瘤相关多肽(TUMAPs)构成,mRCC患者在注射IMA901后会表达出一种特定抗原,主要是通过激活体内T细胞来杀死肿瘤细胞,从而促使人体自身免疫系统抵抗癌症。Kirner等[7]发现,IMA901用于96例mRCC患者,患者体内表达出一种特定抗原,能够在HLA-A抗原表达的患者体内诱发免疫应答。研究表明,IMA901作为一种特异性靶点疫苗,通过动员自身免疫反应对抗癌症的治疗和化疗有本质上的区别,成功率更高、不良反应更小;可延长患者的总生存期,且安全、可靠,无疑为其他疗法无效的mRCC患者带来了新的希望[7-8]。
3.树突状细胞(dendritic cell,DC)疫苗:DC是体内最强大的抗原呈递细胞(antigen presenting cell,APC), DC在启动抗肿瘤免疫的抗原呈递中发挥出强大的功能。可在体内外向T细胞提呈肿瘤细胞的抗原,并诱发CTL,从而发挥抗肿瘤作用。在体内外用现代分子生物学技术, 将肿瘤细胞、裂解的肿瘤细胞成分或肿瘤细胞的凋亡产物、肿瘤mRNA或DNA等修饰DC制成瘤苗,为mRCC患者的治疗开辟了一条新途径[9]。
Ⅰ期临床试验表明,没有剂量限制性毒性或疫苗相关不良反应,包括自身免疫反应。7例mRCC患者中有6例可检测出肿瘤特异性T细胞扩增。疫苗诱导的T细胞反应直接针对肾肿瘤相关抗原,但不针对正常肾组织表达的自身抗原。该研究证实仅有很低的肿瘤相关死亡率。患者平均随访22个月后,3例患者因肿瘤进展死亡[10]。
4.其他
近期研究证实,RCC的一种新型病毒基因(Ad.5/3-mda-7/IL-24)疗法不仅可以杀死原发肿瘤部位的肿瘤细胞,而且可以杀死未直接受到病毒感染的远端肿瘤细胞[11-12],对mRCC患者已进入Ⅱ期临床试验阶段。根据新发现的表观基因组指纹可帮助识别更多的侵袭性癌症并可能阻止mRCC的进展,表观基因组指纹H3K36me3缺失或许能为mRCC患者的进一步个性化疫苗靶向治疗找到更好的药物。
[1] 曾进. 乳头状肾细胞癌的诊断和预后[J]. 临床泌尿外科杂志,2003,18(7):387-389.
[2] Varela I, Tarpey P, Raine K, et al. Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal cell carcinoma[J]. Nature,2011,469(7331):539-542.
[3] Ignacio Varela, Patrick Tarpey, Keiran Raine. Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal carcinoma[J]. Nature,2011,469(7331):539-542.
[4] 李强,孔燕,毛丽丽,等. 53例国人肾透明细胞癌中PBRM1基因的突变分析[J]. 临床肿瘤学杂志,2012,17(7):621-625.
[5] Elfiky AA,Sonpavde G. Novel molecular targets for the therapy of renal cell carcinoma[J]. Discov Med,2012,13(13):461-471.
[6] 赵莲君,李琳,邹征云. 恶性肿瘤个体化多肽疫苗的原理与临床研究[J]. 现代肿瘤医学,2014,(3):676-679.
[7] Kirner A, Mayer-Mokler A, Reinhardt C. IMA901: a multi-peptide cancer vaccine for treatment of renal cell cancer[J]. Hum Vaccin Immunother,2014,10(11):3179-3189.
[8] 王同国,史斌. 树突状细胞疫苗的研究进展[J]. 国际免疫学杂志,2007,30(3):151-154.
[9] Su Z,Dannull J,Heiser A,et al. Immunological and clinical responses in metastatic renal cancer patients vaccinated with tumor RNA-transfected dendritic cells[J]. Cancer Res,2003,63(9):2127-2133.
[10] Park MA,Hamed HA,Mitchell C, et al. A serotype 3/5 adenovirus MDA-7/IL-24 Infects renal carcinoma cells and promotes toxicity of agents that increase ROS and ceramide levels[J]. Mol Pharmacol,2011,71(3):368-380.
[11] Hamed HA,Das SK,Sokhi UK,et al. Combining histone deacetylase inhibitors with MDA-7/IL-24 enhances killing of renal carcinoma cells[J]. Cancer Biol Ther,2013,14(11):1039-1049.
[12] Shinagare AB, Vikram R, Jaffe C, et al. Radiogenomics of clear cell renal cell carcinoma:preliminary findings of the cancer genome atlas renal cell carcinoma(TCGA-RCC) imaging research group[J]. Abdominal Imaging,2015,40(6):1684-1692.
(本文编辑:徐汉玲)
·国外医学文摘·
一项帕唑帕尼对局限性肾细胞癌患者肾实质最大限度保护的Ⅱ期研究
〔Rini BI, et al. J Urol,2015,194(2):297-303〕
手术治疗局限性肾细胞癌时需优先考虑保留肾脏功能。既往研究表明血管内皮生长因子(VEGF)靶向药物能缩小转移性肾细胞癌的瘤体。那么VEGF或许对局限性肾细胞癌亦有此疗效,从而达到在肾部分切除术时对肾功能进行最大限度保护。为验证这一假设,研究者对局限性肾透明细胞癌患者进行了一项前瞻性Ⅱ期临床试验。纳入研究的患者需满足下列条件之一或全部:肾根治性或部分切除术后可能会导致GFR<30 ml/(mim·m2);由于肿瘤高复杂性(R.E.N.A.L.肾肿瘤评分10~12)或邻近肾蒂血管而使得肾部分切除术风险增大。对上述患者给予口服帕唑帕尼(800 mg,每日一次)8~16周,在治疗结束后予以影像学复查,然后行手术治疗。纳入研究的共有25例患者,肿瘤大小的中位数为7.3 cm,R.E.N.A.L.肾肿瘤评分中位数为11,肿瘤病灶的80%为高复杂性,其中56%患者为孤立肾。患者接受帕唑帕尼治疗的中位值为8周。从治疗开始到手术的时间间隔中位值为10.6周。结果显示:71%的患者R.E.N.A.L.肾肿瘤评分降低,92%的患者肿瘤体积缩小,13例无法行肾部分切除术的患者经治疗后有6例可行肾部分切除。手术可能保存的平均肾实质体积从预期的107 cc增加到173 cc(P=0.001 5)。5例患者术后出现漏尿,行保守治疗;7例患者术中需输血,其中1例进行了栓塞治疗。研究者由此认为,行新辅助帕唑帕尼治疗能缩小局限性肾细胞癌的体积,提高对肾脏的保护,并为需行根治性肾切除的患者提供了一个行部分切除的机会。
(陈璐摘译 杨为民校)
430030武汉,华中科技大学同济医院泌尿外科
陈忠,E-mail:chenzhongtj@163.com
10.3870/j.issn.1674-4624.2015.06.001
2015-10-29)
