绿色荧光蛋白标记兔BMSCs体外成骨的定量能谱分析
2015-03-03宁寅宽蔡伟良武成聪陈佳滨石正松
宁寅宽,李 强,蔡伟良,武成聪,陈佳滨,石正松
绿色荧光蛋白标记兔BMSCs体外成骨的定量能谱分析
宁寅宽,李 强,蔡伟良,武成聪,陈佳滨,石正松
摘要目的 观察绿色荧光蛋白(GFP)标记的兔骨髓间充质干细胞(BMSCs)成骨诱导后形态学改变和体外骨生成中矿化钙结节的形成,并结合扫描电镜和X射线能谱分析技术(SEM/EDS)对矿化钙结节元素进行定量能谱分析。方法用携带GFP基因的腺病毒转染兔BMSCs进行示踪标记,并诱导细胞向成骨方向分化,通过倒置荧光显微镜、钙结节茜素红染色观察成骨诱导后细胞形态改变和矿化钙结节的形成,结合SEM/EDS技术观测矿化钙结节的表面微观结构及其元素构成。结果 腺病毒介导GFP基因(Ad-GFP)转染兔BMSCs后在荧光显微镜下观察到绿色荧光,经成骨诱导后细胞形态向成骨方向分化,并形成不透光的矿化钙结节,钙结节茜素红染色见红色矿化结节,SEM下见矿化钙结节散布于细胞中,细胞重叠生长,分泌基质旺盛。EDS分析显示矿化钙结节主要组成元素与正常骨组织相同,其钙磷比(Ca/P)为1.55,接近正常骨组织钙磷比1.49。结论 Ad-GFP能成功转染并标记兔BMSCs,成骨诱导后BMSCs向成骨方向分化,具备较好的骨生成能力,BMSCs体外矿质化成骨过程与体内基本相同。
关键词重组腺病毒;绿色荧光蛋白;骨髓间充质干细胞;扫描电镜;能谱分析
2014-12-31接收
作者单位:桂林医学院附属医院四肢创伤手外科,桂林 541001
在观察骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)体外诱导成骨时,一般通过生物化学检测方法检测所培养BMSCs内碱性磷酸酶活性,Ⅰ型胶原、成骨特异性蛋白和成骨分化调控因子的表达等,但这些生物化学检测方法仅能间接地反映BMSCs体外成骨分化的生物特性,而对BMSCs体外骨生成的直接观测方法较少[1]。绿色荧光蛋白(green fluorescent protein,GFP)基因标记是一种细胞示踪技术,用GFP标记BMSCs可直接观察细胞的形态改变和空间分布[2]。该实验以腺病毒为表达载体,介导GFP基因标记兔BMSCs,在即时动态观察成骨诱导后细胞形态学改变的同时,并结合扫描电镜和X射线能谱分析(scanning electron microscope and energy dispersive spectrometer,SEM/EDS)技术直接观测BMSCs成骨分化中矿化钙结节的表面微观结构及其钙、磷元素含量,定量研究BMSCs体外骨生成中矿化钙结节元素组成。
1 材料与方法
1.1 实验材料
1.1.1 腺病毒载体 Ad-GFP表达载体由美国英潍捷基(上海)贸易有限公司构建、鉴定和提供。采用免疫法检测腺病毒滴度,病毒滴度为2×1010pfu/ml。
1.1.2 兔BMSCs 本课题组前期实验已完成了兔
BMSCs的原代获取、传代培养及鉴定,并取第5代细胞液氮冻存备用[3]。本次实验细胞为第5代冻存细胞复苏后传代至第10代的BMSCs。
1.1.3 实验动物 健康雄性成年新西兰大白兔1只,7月龄,3.5 kg,清洁级,购于桂林医学院动物实验中心,实验过程中对动物的处置符合医学伦理学标准。
1.1.4 主要试剂和仪器 低糖DMEM、胰蛋白酶、胎牛血清(美国Hyclone公司);维生素C、β-磷酸甘油、地塞米松(韩国Biosharp公司);茜素、戊二醛(美国Sigma公司);CO2细胞培养箱(美国Thermo Scientifc公司);生物安全柜(中国苏净安泰公司);倒置荧光显微镜(日本Olympus公司);场发射SEM(荷兰飞利浦公司);EDS仪(英国牛津公司)。
1.2 实验方法
1.2.1 兔BMSCs的复苏和传代培养 将待复苏的兔BMSCs冻存管迅速解冻,转移至含有3倍于冻存保护液体积的L-DMEM离心管中离心,弃上清液,细胞沉淀中加入5 ml完全培养基,充分吹打细胞悬液至细胞分布均匀,以含15%血清的L-DMEM完全培养基(含100 IU/ml青霉素、100 IU/ml链霉素)接种于25 cm2塑料培养瓶,置于37℃、5%CO2饱和湿度环境中培养,细胞复苏24 h后换液。各代BMSCs体外培养至单层细胞汇合约80%,用0.25%胰蛋白酶消化,行1∶2~3传代培养,细胞传至第10代进行实验。
1.2.2 兔BMSCs的转染和成骨诱导 设置转染复数(MOI=100),用重组腺病毒Ad-GFP转染细胞,转染24 h后换液。转染后第3天,更换成骨诱导液(含10 nmol/L地塞米松、15 mmol/L维生素C、10 mmol/L β-磷酸甘油、pH 7.3、含15%血清的LDMEM)培养细胞,以后每3 d更换1次成骨诱导液,培养1周后,更换完全培养基培养。在倒置荧光显微镜下逐日观察转染及诱导后细胞形态及生长情况。
1.2.3 钙结节茜素红染色观察钙化斑的形成 兔BMSCs以1×105个/孔接种6孔板进行细胞爬片处理,接种前每孔预先放置已消毒的20 mm盖玻片。经转染及成骨诱导液培养后,在倒置显微镜下观察矿化钙结节的形成,并于第21天随机细胞爬片,用PBS漂洗3次,95%乙醇固定10 min,蒸馏水冲洗3次,滴加0.1%茜素红染液,常温染色1 h,蒸馏水冲洗,干燥,直接镜下观察。
1.2.4 SEM观察和EDS分析 第21天随机取细胞爬片,用2.5%戊二醛固定,梯度丙酮脱水,真空干燥,喷金镀膜,在Quanta 200 FEG场发射环境SEM和EDS仪上进行测试。在SEM下观察细胞及钙结节微表面微观形貌。然后获取检测微区,用EDS仪测定微区主要元素(C、O、Ca、P)的重量百分比和原子百分比百分含量,重复3次。能谱仪技术指标:电压10 kV、电子束6.0、工作距离10.0 mm。取成年新西兰大白兔髂骨骨皮质,经同样方法处理后在相同条件下进行观测。
2 结果
2.1 转染及成骨诱导后兔BMSCs形态学观察和钙结节茜素红染色 腺病毒介导GFP基因转染兔BMSCs(MOI=100)后,未见细胞明显死亡,转染后24 h后即可看到细胞表达绿色荧光,随着时间推移荧光表达渐强,48 h达到顶峰,转染效率约90%。成骨诱导液培养后做不传代培养,第7天,细胞增殖较前缓慢,细胞形态为长梭形或立方状;第14天,细胞荧光表达较前减弱,细胞形态为短梭形、三角形或多角形,旋涡状排列,胞质丰富,内有高折射性空泡和深色颗粒,细胞分泌基质。见图1。随时间延长,细胞逐渐变为多层,重叠生长,无接触抑制现象,并形成结节状,最终形成不透光的矿化结节;第21天细胞爬片钙结节茜素红染色后为红色钙结节。见图2。
2.2 SEM观察和EDS分析 SEM下见钙化灶点状散布于细胞中,相互连接成小片状,稍凸出于重叠细胞层之上,分泌基质旺盛,钙化斑结构疏松、粗糙,呈水泥状。用EDS分析仪检测SEM扫描微区得出分析图谱,同时计算机由谱峰强度自动换算为所测主要元素(C、O、Ca、P)的相对含量。见表1。数据显示钙化斑区钙磷比(Ca/P)为1.55,接近羟基磷灰石钙磷比1.67,说明钙化斑块表面有钙、磷沉积物产生,可能为磷酸钙盐。数据显示正常骨组织钙磷比1.49,且正常骨组织与钙化斑内主要组成元素相同,均为钙和磷元素。但是钙化斑内钙、磷元素含量较正常骨组织低,表现为能谱图中元素峰覆盖面积积分值比正常骨组织偏低。钙化斑区和正常骨组织分析图见图3。
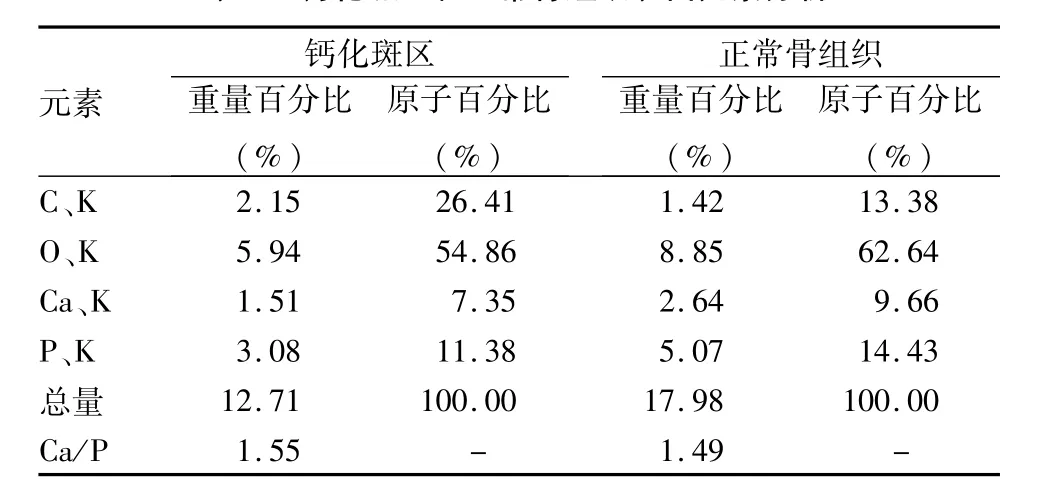
表1 钙化斑区和正常骨组织表面元素分析
3 讨论
BMSCs能较稳定地保持干细胞特性,有多向分化潜能,能在特定的环境下分化为成骨细胞,是骨组织工程中首选种子细胞。同时,其体外高增殖能力为多种载体携带目的基因的转染奠定了基础[4]。GFP已成为示踪目的基因表达、细胞蛋白定位和完整活细胞形态和空间分布的重要报告基因,在生物医学领域的应用日益广泛[2]。重组腺病毒是一种安全、高效的基因载体,能够高水平瞬时表达外源基因,克隆的细胞不表达目的基因[4]。本实验以腺病毒为表达载体,介导GFP基因标记兔BMSCs,在倒置荧光显微镜下直接动态即时观察BMSCs的成骨分化过程中的细胞形态改变和空间分布。显示兔BMSCs经成骨诱导液培养后,细胞增殖速度开始减慢,细胞形态向成骨方向分化,细胞形态由旋涡状单层排列的长梭形、立方状逐渐变为短梭形、三角形或多角形。细胞逐渐变为多层并重叠生长,不出现接触抑制现象,形成细胞团块并逐渐增大,最终形成不透光的矿化钙结节。培养至14 d过程中观察到绿色荧光表达较前逐渐减弱,可能是GFP表达减弱和细胞大量克隆增殖、重叠生长的共同结果。
BMSCs在特定的化学物质诱导下向成骨方向分化,主要包括地塞米松、β-磷酸甘油、维生素C等。其发生机制可能为地塞米松促进BMSCs早期调节成骨分化基因的表达,并增强碱性磷酸酶的活性,增加细胞外胶原基质合成,最终在成骨分化后期形成矿化钙结节。β-磷酸甘油为细胞提供足够的碱性磷酸酶作用的底物,使生长环境中有机磷转变为无机磷,并加速钙盐沉积使细胞及基质骨化,生成矿化钙结节。维生素C诱导BMSCs合成胶原蛋白,使碱性磷酸酶保持较高活性。细胞外基质钙化及无机钙、磷沉积是BMSCs终末期成骨分化的表现[5-6]。本实验以地塞米松、β-磷酸甘油、维生素C作为成骨诱导培养液体外培养BMSCs,表明BMSCs能形成矿化的细胞外基质,并形成矿化钙结节,经茜素红染色后呈红色。提示细胞已经向终末期成骨分化。矿化钙结节在SEM下散布于细胞中,相互连接成片,结构疏松、粗糙。EDS分析数据显示矿化钙结节可能为钙、磷沉积所形成的磷酸钙盐,为类羟基磷灰石。钙化斑内主要组成元素与正常骨组织相同,其钙磷比接近正常骨组织钙磷比,可以从钙磷比变化初步说明BMSCs体外矿质化成骨过程与体内基本相同。随着矿化钙结节的改建和骨基质中有机胶原成分的增加,体外所生成骨组织将逐渐趋向成熟,钙磷比值将恢复到正常骨组织比值水平[7]。
骨的钙化是指无机盐有序沉积于有机质内的过程。在骨的钙化过程中,细胞和基质发挥着重要的作用,是成核作用的核心部位,是骨形成的基础。细
胞和基质成分与羟基磷灰石混合在一起,形成矿化钙结节[7-8]。骨基质中有机质90%为Ⅰ型胶原蛋白,无机质主要为磷酸钙盐,以结晶状态沉积于胶原上[9]。实验[10]证实BMSCs经成骨诱导液体外培养后,检测有Ⅰ型胶原蛋白生成。本实验在SEM下观察见细胞重叠生长,分泌基质旺盛,矿化钙结节散布于细胞中,相互连接成片。说明细胞通过分裂增殖后,大量分泌细胞基质,随后被自身分泌的基质所包绕,磷酸钙盐沉积在细胞基质局部,最终形成矿化钙结节。再一次证实成骨诱导BMSCs体外矿质化成骨过程与体内基本相同。
参考文献
[1] 程 谷,李祖兵.骨组织工程中的检测方法及其效果评估展望[J].国际口腔医学杂志,2010,35(5):593-6.
[2] Nojima T,Kaneda S,Kimura H,et al.Application of cell-free expression of GFP for evaluation of microsystems[J].Front Biosci,2012,17(1):1931-9.
[3] 武成聪,李 强,陈佳滨,等.短期冻存兔骨髓间充质干细胞对其生物特性的影响[J].重庆医学,2014,43(4):459-61+64.
[4] Evans C H.Gene therapy for bone healing[J].Expert Rev Mol Med,2010,12(18):1010-7.
[5] Harris N L,Huffer W E,von Stade E,et al.The effect of plateletrich plasma on normal soft tissues in the rabbit[J].J Bone Joint Surg Am,2012,94(9):786-93.
[6] 裴雪涛.再生医学:理论与技术[M].北京:科学出版社.2010:36-7.
[7] Bonucci E.Bone mineralization[J].Front Biosci,2012,17(1):100-28.
[8] Fukumoto S.Ectopic calcification[J].Clin Calcium,2014,24 (2):185-9.
[9] Price P A,Toroian D,Chan W S.Tissue-nonspecific alkaline phosphatase is required for the calcification of collagen in serum:a possible mechanism for biomineralization[J].J Biol Chem,2009,284(7):4594-604.
[10]陈佳滨,李 强,茹 嘉,等.BMP-2和EGFP重组腺病毒体外转染兔骨髓间充质干细胞的研究[J].重庆医学,2014,43(2):193-5+9.
Quantitative energy spectrum analysis on osteogenesis of rabbit bone-marrow mesenchymal stem cells labeled by green fluorescent protein in vitro
Ning Yinkuan,Li Qiang,Cai Weiliang,et al
(Dept of Limb Trauma Surgery,The Affilated Hospital of Guilin Medical University,Guilin 541001)
AbstractObjective To observe the morphological changes of rabbit bone-marrow mesenchymal stem cells(BMSCs)after osteogenic induction and calcified plaque formation of osteogenesis of rabbit BMSCs labeled by green fluorescent protein(GFP)in vitro and quantitatively analyze the elements of calcified plaque by scanning electron microscope and energy dispersive spectrometer(SEM/EDS).Methods The rabbit BMSCs were traced by adenovirus with GFP(Ad-GFP)gene,and then cells were induced differentiation to osteogenesis.Inverted fluorescence microscope and alizarin red staining were applied to observe morphological changes of cells after transfection and calcified plaque formation and SEM/EDS were employed to study the surface microstructure and element composition of calcified plaque.Results Fluorescence microscope showed rabbit BMSCs after Ad-GFP transfection gave green light and the cell morphology differentiated to osteogenic accompanied with opaque mineralized calcium nodule.Alizarin red staining exhibited red mineralized nodules.From SEM,punctate mineralization calcium nodules scattered among cells and cells grew overlapply strongly secreted matrix.EDS confirmed that the main elements of mineralized calcium nodules were analogous to normal bone tissue and ratio of calcium to phosphorus(Ca/P)was 1.55,close to normal ratio 1.49.Conclusion Rabbit BMSCs can be successfully transfected and labeled by Ad-GFP and trend to osteogenic differentiation after osteogenesis induction.BMSCs have a preferable osteogenic capability and the process of biological mineralization in vitro is the same with in vivo.
Key wordsadenovirus;green fluorescent protein;bone-marrow mesenchymal stem cells;scanning electron microscopy;spectrum analysis
作者简介:宁寅宽,男,硕士研究生;李 强,男,教授,主任医师,硕士生导师,责任作者,E-mail:li.q12251970@163.com
基金项目:国家自然科学基金资助项目(编号:31160199)
文献标志码A
文章编号1000-1492(2015)04-0415-04
中图分类号R 687.34
