副猪嗜血杆菌oppA基因的克隆、表达及间接ELISA检测方法的建立
2015-03-02车勇良陈如敬王隆柏吴学敏庄向生周伦江福建省农业科学院畜牧兽医研究所福建福州350013
车勇良,陈如敬,江 斌,王隆柏,魏 宏,吴学敏,庄向生,周伦江(福建省农业科学院畜牧兽医研究所,福建福州 350013)
副猪嗜血杆菌oppA基因的克隆、表达及间接ELISA检测方法的建立
车勇良,陈如敬,江 斌,王隆柏,魏 宏,吴学敏,庄向生,周伦江(福建省农业科学院畜牧兽医研究所,福建福州 350013)
采用PCR方法扩增副猪嗜血杆菌(Hps)的寡肽结合蛋白(OppA)基因,序列测定结果表明,扩增片段全长1654 bp.将扩增片段插入表达载体pGEX-6P-1中,转化BL21进行诱导表达,SDS-PAGE电泳结果表明,重组融合蛋白大小约为87 ku,以纯化的重组蛋白OppA作为抗原,建立Hps抗体的间接ELISA检测方法.通过试验确定最佳的反应条件为:抗原包被浓度为1.0μg·孔-1,于37℃包被1 h,待检血清的稀释度为1∶50,阳性判断标准(D450nm)大于0.643.特异性和重复性试验结果表明,建立的间接ELISA方法具有良好的特异性和稳定性,可用于Hps抗体的检测.
副猪嗜血杆菌;寡肽结合蛋白基因;克隆;表达;间接ELISA
副猪嗜血杆菌病又称革拉泽氏病[1],是由副猪嗜血杆菌(Haemophilus parasuis,Hps)引起的一种条件性细菌病,主要表现为仔猪的纤维素性多发性浆膜炎、关节炎和脑膜炎等[2-3].副猪嗜血杆菌病多为继发[4],通常是由猪圆环病毒病、猪呼吸与繁殖障碍综合征、猪瘟和猪伪狂犬病引起仔猪免疫力下降而导致的,其发病率为10% -15%,死亡率可达50%以上,给我国甚至全世界的养猪业造成了巨大的经济损失.通过琼脂扩散试验,可将Hps分为15个血清型[2],但还有20% -30%的菌株不能通过此方法定型,我国目前流行的主要血清型为血清4、5和13型.细菌寡肽透过酶(oligopeptide permease,Opp)输送系统的主要功能是从环境中摄取和运送寡肽营养物质进入细菌内[5].Opp存在于革兰氏阴性和革兰氏阳性细菌中,opp基因是由oppA、oppB、oppC、oppD和oppF5个基因构成的基因簇,其编码产物形成跨膜通道,主要功能是输送由3-5个氨基酸组成的小肽,属于ABC输送器家族[5].而寡肽结合蛋白(OppA)是一种底物结合蛋白,位于革兰氏阴性菌的细胞质中[5],主要功能是捕获寡肽或作为细胞膜表面受体,是非常保守的一种蛋白质,可以作为该细菌的一种诊断抗原.
目前已有多种方法用于Hps病原和抗体的检测,其中用于病原检测的有PCR方法[6]、Southern杂交技术[7]、补体结合试验[8]和环介导等温扩增方法(LAMP)[9];用于抗体检测的有间接血凝试验[10]和间接ELISA方法[11].间接血凝试验的稳定性较差,而间接ELISA方法的稳定性较好.因此,本试验通过扩增出HpsoppA基因序列,转化原核表达载体pGEX-6P-1进行原核表达,纯化表达蛋白,包被酶标板,建立Hps抗体检测试剂,旨在为副猪嗜血杆菌病的预防和控制提供依据.
1 材料与方法
1.1 材料
Hps由本实验室分离保存;胰酶大豆琼脂培养基(TSA)、胰酶大豆肉汤培养基(TSB)、胰蛋白胨和酵母提取物均购自BD Difco公司;小牛血清从杭州四季青公司购得;NAD和辣根过氧化物酶标记的兔抗猪二抗购自Roche公司;pMD18-T simple载体、Taq酶和限制性内切酶等分子生物学试剂购自TaKaRa公司.
1.2 方法
1.2.1 Hps DNA的提取 将冻存的细菌划线接种于含5%小牛血清和0.005%NAD的TSA琼脂平板中,于37℃培养过夜.挑取单个菌落接种于含5%小牛血清和0.005%NAD的TSB液体培养液中,于37℃振摇培养过夜.离心沉淀后加入PBS重悬,按照CTAB/NaCl方法[12]提取细菌基因组DNA,自然干燥后溶于TE中置-20℃保存备用.
1.2.2oppA基因的PCR扩增 根据SH0165株的oppA基因,用生物软件Primier 5.0设计1对特异性引物,扩增HpsoppA的全基因.上游引物OP1的序列:5'-CAGGATCCATGCAAACAACCTTTACC-3'(下划线部分为BamHⅠ酶切位点);下游引物OP2的序列:5'-CGCTCGAGTTACTGCTTAATGATATA -3'(下划线部分为XhoⅠ酶切位点).以Hps DNA为模板,采用特异性引物OP1/OP2进行PCR扩增.反应条件为:94℃预变性5 min;94℃变性1 min、50℃复性1 min、72℃延伸1 min,共35个循环;72℃延伸10 min.4℃保存.于80 V、1%琼脂糖凝胶电泳40 min,采用凝胶成像系统观察结果.
1.2.3oppA基因的克隆与测序 将回收的PCR产物和T载体于16℃连接1 h,转化感受态DH5α,并接种于含有氨苄青霉素的LB琼脂平板中,于37℃培养箱倒置培养12-19 h.挑取菌落接种于含有氨苄青霉素的LB液体培养基中,并放置在摇床于37℃振摇12 h左右,用质粒提取试剂盒提取质粒.将PCR鉴定为阳性的质粒命名为pMD18-T-OppA,阳性质粒的序列送TaKaRa公司测序.
1.2.4 重组表达载体的构建及阳性重组菌的筛选、鉴定 将阳性质粒pMD18-T-OPPA和pGEX-6P-1载体均用BamHⅠ和XhoⅠ进行双酶切,回收目的片段和载体的酶切产物,按常规方法建立10μL的连接体系,于16℃连接过夜以构建重组表达质粒pGEX-OPPA.取连接产物按常规方法转化感受态细菌BL21(DE3),于37℃培养过夜.挑取单菌落在含有氨苄青霉素的LB液体培养基中进行培养,并用质粒试剂盒提取质粒,采用PCR方法筛选阳性质粒.
1.2.5 重组菌的诱导表达及SDS-PAGE分析 阳性重组菌在2 mL LB培养基(含60μg·mL-1氨苄青霉素)中于37 ℃、250 r·min-1摇床振摇培养至D600nm约为 0.6,分别加入终浓度为 1、2 和 4 mmol·L-1的IPTG后继续在相同条件下分别诱导3和6 h,同时设不加IPTG的培养管作为阴性对照,设PGEX空载体培养管作为平行对照.
1.2.6 包涵体的提取及纯化 收获的阳性重组菌菌液经离心后用PBS重悬菌体,超声波破碎后,于12000 r·min-1、4 ℃离心10 min,弃掉上清,沉淀用洗涤液(含 10 mmol·L-1Tris-HCl、1 mmol·L-1EDTA 和 2 mol·L-1尿素)洗涤20 次,然后用溶解变性液(含 10 mmol·L-1Tris-HCl、1 mmol·L-1EDTA 和 8 mol·L-1尿素)溶解包涵体,以10倍于原体积的PBS稀释溶解后的包涵体进行透析复性,用蛋白纯化柱纯化蛋白.
1.2.7 抗原最适包被浓度和HRP-羊抗猪二抗浓度的确定 按照方阵滴定法优化ELISA反应条件.原核表达蛋白抗原分别以 2.0、1.5、1.0 和 0.5 μg·孔-1包被于酶标板中,HRP 标记二抗按 1∶20000、1∶30000和1∶40000稀释,并设阴性血清作对照,组成方阵,按间接ELISA方法操作.比较阴、阳性血清的D450nm和P/N(P为阳性血清的D450nm,N为阴性血清的D450nm),确定抗原的最佳包被浓度,相对应的HRP标记的二抗稀释度为最佳二抗稀释度.
1.2.8 待检血清稀释度的确定 以最佳浓度的抗原包被酶标板,洗涤后,用封闭液封闭.接着将待检血清作1∶25,1∶50,1∶100 3个稀释度,同样的稀释度共设两孔,按间接ELISA方法操作,在酶标仪上读出D450nm.通过比较阴、阳性血清的P/N来确定最佳的待检血清稀释度.
1.2.9 阴、阳性临界值的确定 用已建立的间接ELISA方法检测临床采集的30份无Hps病原感染的阴性猪血清,计算阴性血清的平均D450nm()和标准方差(SD)+2SD为阴、阳性临界值,凡超过临界值的判为阳性,否则判为阴性.
1.2.10 间接ELISA特异性试验 应用建立的间接ELISA方法检测猪传染性胸膜肺炎放线杆菌、猪链球菌2型、猪多杀性巴氏杆菌、猪大肠杆菌、猪圆环病毒2型和猪蓝耳病病毒的阳性血清,并设Hps阴、阳性血清作为对照,以检测其特异性.
1.2.11 间接ELISA方法重复性的测定 取阴、阳性标准血清,采用建立的间接ELISA方法进行4次重复性试验,每次6孔.应用Excel软件对试验数据进行多因素方差分析,根据P的大小确定差异显著性,进而证明建立的间接ELISA方法的稳定性.
1.2.12 临床血清样品的检测 检测2010-2012年本研究室收集的来自福州、泉州和厦门等8个地区猪场共194份血清,了解福建省Hps的流行情况.
2 结果与分析
2.1 Hps oppA基因的PCR扩增结果
PCR扩增结果(图1)显示,扩增出的目的基因片段大小为1654 bp,与预期目的片段大小相符.
2.2 Hps OppA阳性表达载体的鉴定
挑取测序结果与预期一致的阳性质粒,与pGEX-6P-1同时双酶切并进行连接,转化DH5α,凃于LB琼脂平板,待生长后挑取单个菌落接种于LB液体培养基中,提取质粒,进行PCR鉴定.鉴定结果(图2)表明,阳性重组质粒能扩增出与预期一致的条带.
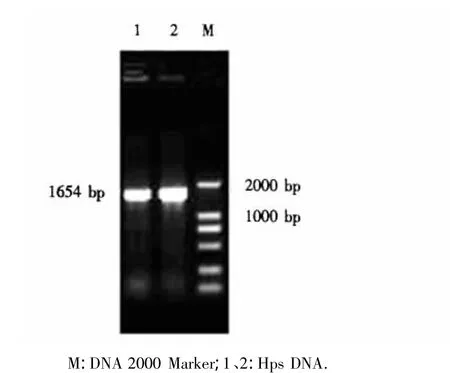
图1 Hps oppA基因的PCR扩增结果Fig.1 PCR amplification of the oppA gene of Hps
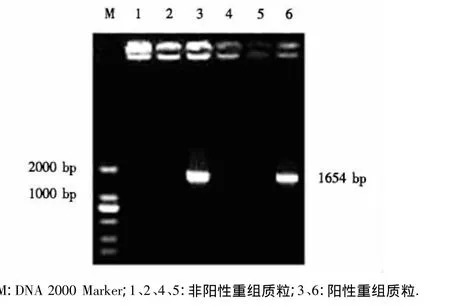
图2 阳性重组质粒的PCR鉴定结果Fig.2 PCR amplification of positive recombinant plasmid
2.3 重组菌的诱导表达和SDS-PAGE分析
SDS-PAGE分析结果(图3)显示,重组菌经2 mmol·L-1IPTG诱导6 h后,出现一条大小为87 ku的条带,与预期大小一致.
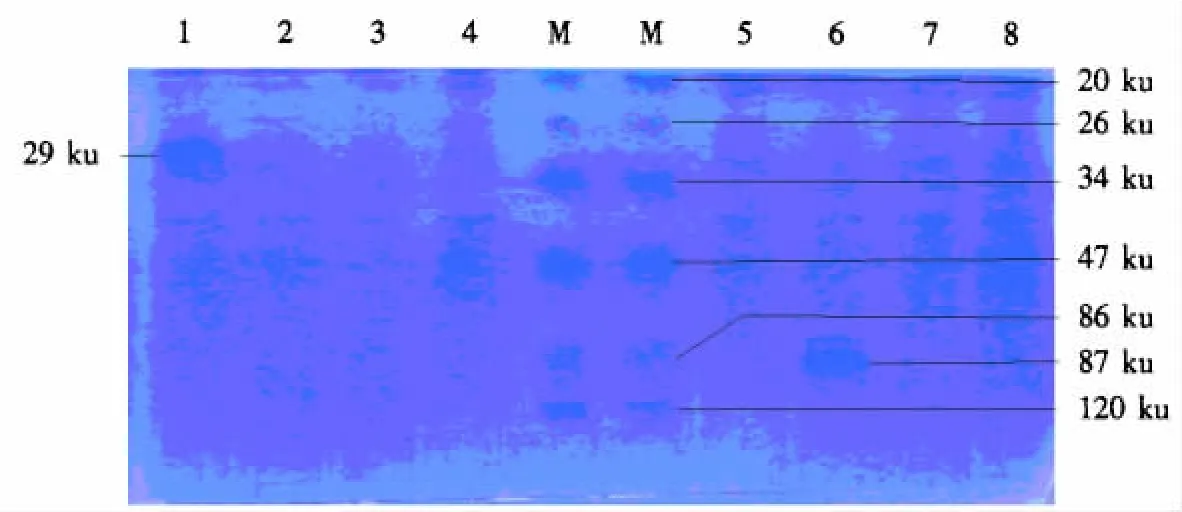
图3 重组菌诱导表达后的SDS-PAGE结果Fig.3 The SDS-PAGE analysis of protein expression induced
2.4 抗原最适包被浓度和HRP-羊抗猪二抗浓度的确定
按照方阵滴定法优化ELISA反应条件并进行间接ELISA操作.结果(表1)显示,随着抗原浓度的降低,阴、阳性血清的D450nm相应地下降.当抗原浓度为1.0μg·孔-1,二抗稀释度达1∶30000时,其P/N最高,为3.028.因此,选择抗原最适的包被浓度为1.0μg·孔-1,HRP标记的二抗稀释度为1∶30000.
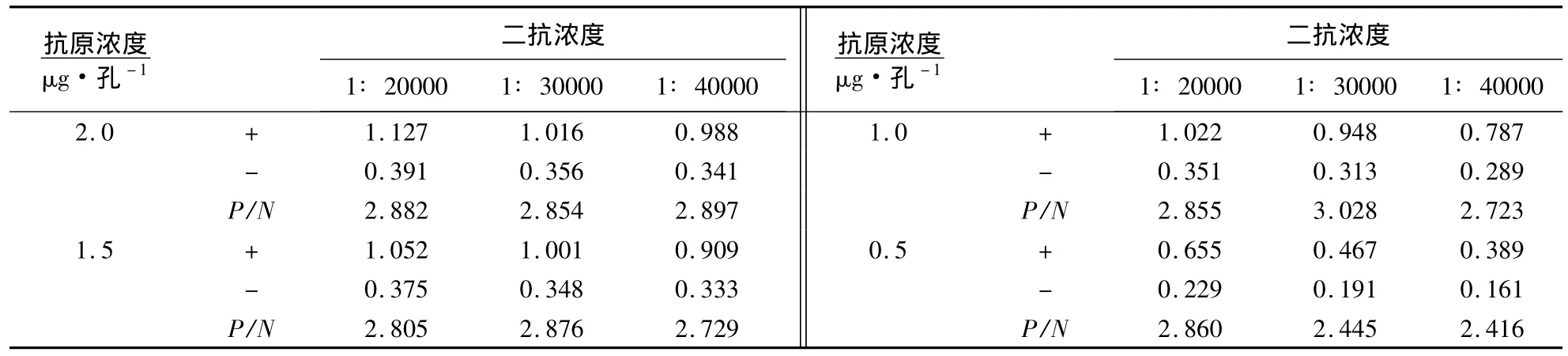
表1 包被抗原浓度和二抗浓度的确定1)Table 1 Determination of the optimal coating concentration of antigen and HRP-SPA dilution
2.5 待检血清稀释度的确定
表2表明,血清稀释度为1∶50时,其P/N最高,故确定血清最佳稀释度为1∶50.
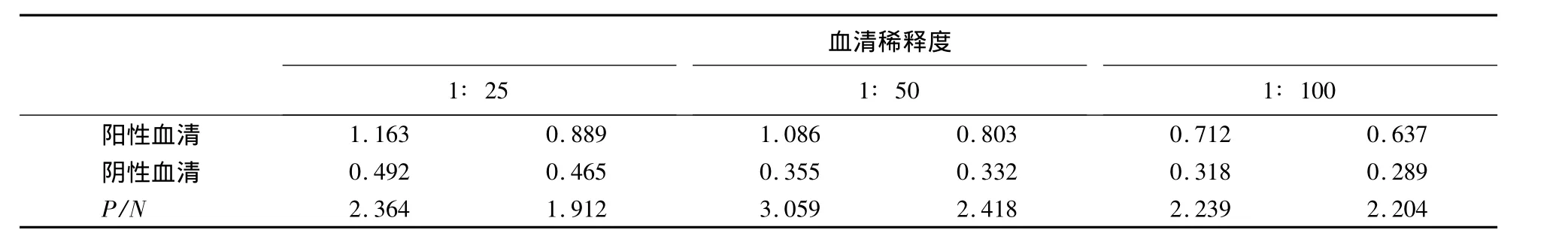
表2 待检血清稀释度的确定1)Table 2 Determination of the serum dilution for ELISA
2.6 阴、阳性临界值的确定
表3表明,30份阴性血清D450nm的平均值为 0.514,标准方差为0.06473,临界值为0.643.因此,当D450nm大于0.643时,可以判定Hps抗体为阳性,反之,即为阴性.
2.7 间接ELISA特异性试验
表4显示:包被抗原与抗猪传染性胸膜肺炎放线杆菌、猪链球菌2型、猪多杀性巴氏杆菌、猪大肠杆菌、猪圆环病毒2型和猪蓝耳病病毒的标准阳性血清不反应,呈阴性反应;抗原与抗Hps的标准阳性血清呈阳性反应,与抗Hps标准阴性血清不反应.表明本试验建立的间接ELISA方法特异性好.
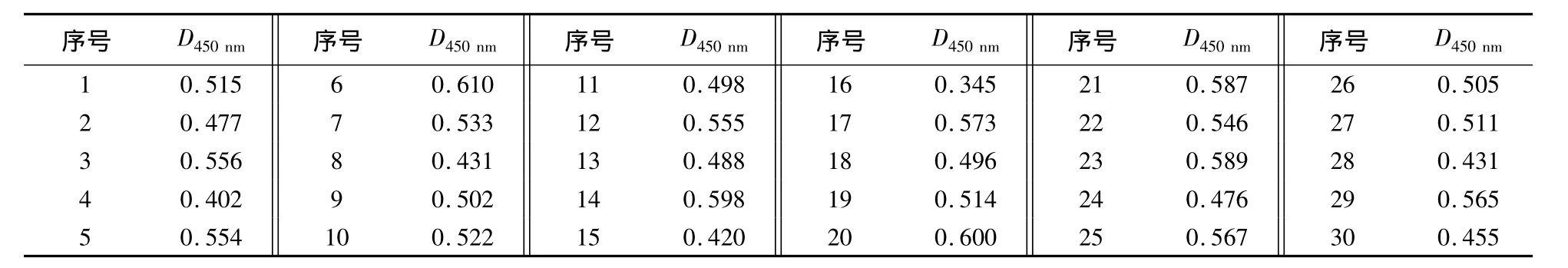
表3 30份阴性血清的D450nmTable 3 Determination of the threshold for ELISA through 30 negative serum samples
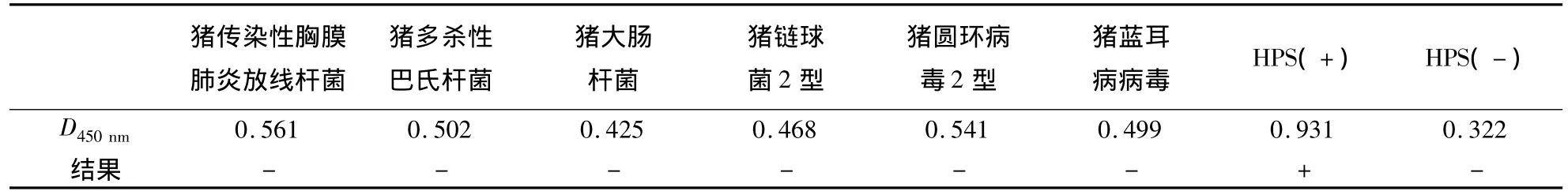
表4 间接ELISA特异性测定结果1)Table 4 Determination of specifity for indirect ELISA
2.8 间接ELISA方法重复性测定结果
方差分析结果显示:阳性血清的P大于0.05,差异不显著(表5);阴性血清的P也大于0.05,差异也不显著(表6).表明建立的间接ELISA方法具有良好的稳定性.
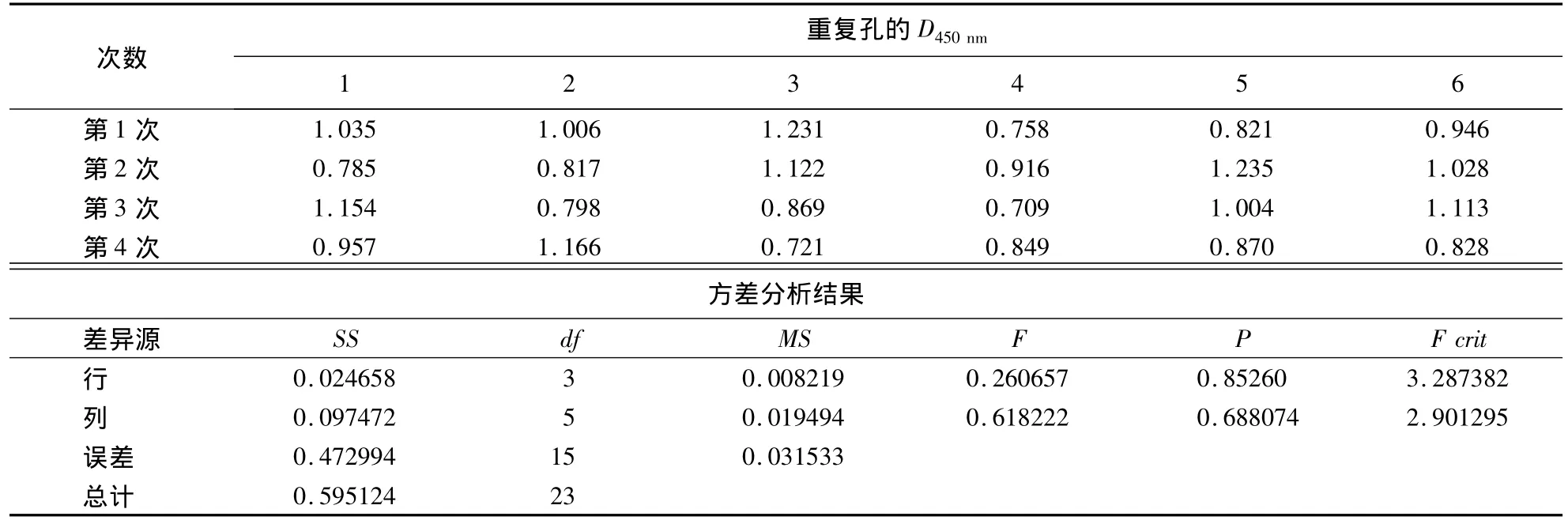
表5 阳性血清重复性测定及方差分析结果Table 5 Determination of repeatability for positive serum samples
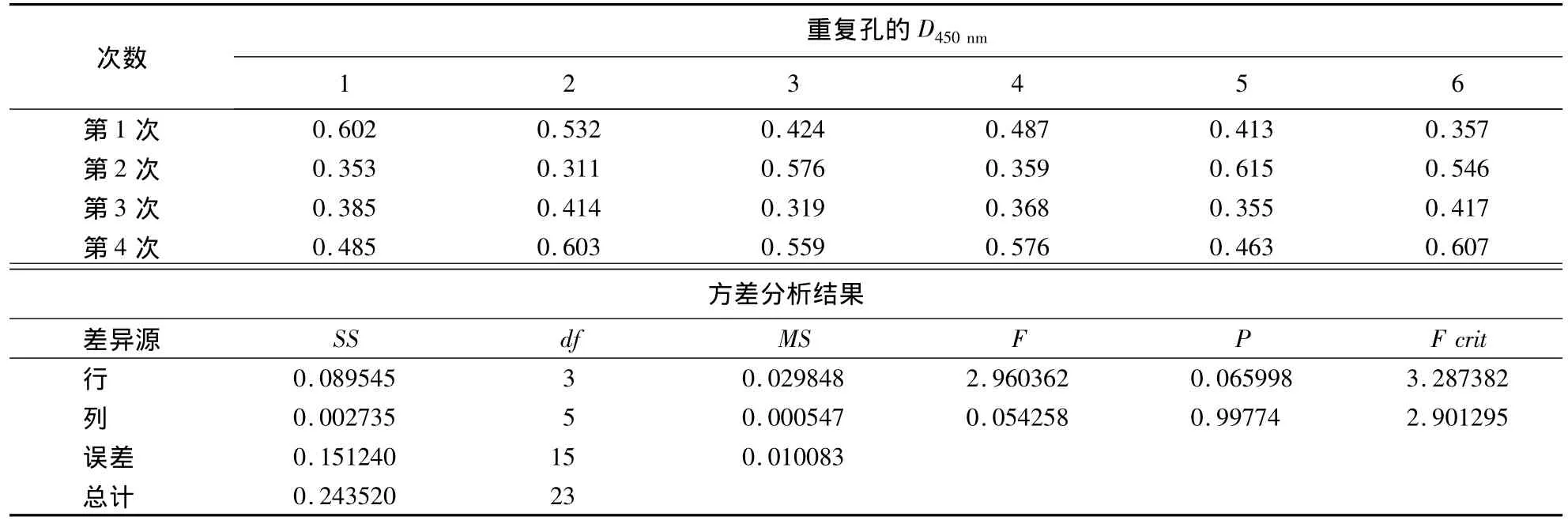
表6 阴性血清重复性测定及方差分析结果Table 6 Determination of repeatability for negative serum samples
2.9 临床血清样品的检测结果
检测2010-2012年本研究室收集的来自福州、泉州和厦门等8个地区猪场共194份血清,了解福建省Hps的流行情况;同时应用海博莱Hps血清抗体检测试剂盒和建立的间接ELISA方法对收集的194份血清进行Hps抗体检测.海博莱检测试剂盒的阳性检出率为36.78%,而建立的间接ELISA方法的阳性检出率为51.32%,两者的阳性检出率的符合率为71.67%,符合率较低(表7).
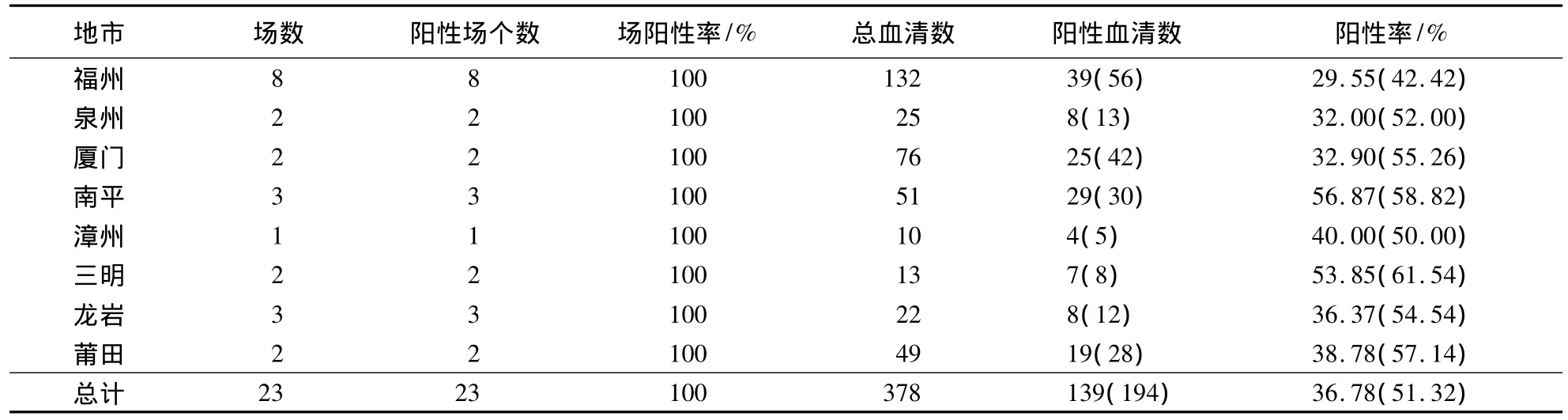
表7 临床血清样品的检测结果1)Table 7 Determination of swine serum samples by indirect ELISA
3 讨论
近年来,猪场呼吸道疾病日益严重,而Hps作为一种条件性致病菌引起的危害也日趋严重.由于培养条件苛刻,Hps的分离率较低;很多用于病原菌检测的方法必须以分离的病原菌DNA为模板,这样就导致了很多副猪嗜血杆菌病不能被确诊.因此,急需一种诊断方法用来确诊该病,而用于抗体检测的血清学方法有利于该病的大规模普查和快速诊断.间接ELISA方法是血清学检测方法中一种较为简便、敏感、特异的方法,比间接血凝试验更准确和敏感[13-14].
选择一种合适的包被抗原是建立间接ELISA检测方法的关键.国内石碧等[15]和王艳等[16]分别选用荚膜多糖和全菌体作为包被抗原建立了检测Hps抗体的间接ELISA方法,取得了较好的试验效果;陈善真等[17]使用原核表达载体pET32a(+)表达了外膜蛋白P5,并用该蛋白包被酶标板建立了间接ELISA方法,该方法特异性好、重复性好,检出率与Hps的临床分离率接近,可用于Hps的临床检测、流行病学调查和免疫监控;贾爱卿等[18]和李鹏等[19]也使用原核表达载体表达了外膜蛋白P2,并把该蛋白作为包被抗原建立了检测Hps抗体的间接ELISA方法,该方法的敏感性和特异性也较好.而Opp属于ABC输送系统家族成员,ABC输送系统是细菌中最大的旁系同源蛋白家族之一,占细菌基因组的5%,控制着必需营养物质进出细菌[20],并且具有其他多种生物功能[21-22].
OppA作为Opp的成员之一,是非常保守的.因此,本试验选用原核表达载体pGEX-6P-1表达OppA,并把该蛋白作为包被抗原,通过优化确定包被抗原浓度,酶标二抗浓度,待检血清稀释度和阴、阳性临界值,建立了Hps抗体检测的间接ELISA方法,并对该方法的特异性、重复性进行了测定,通过对血清样品的检测证实该间接ELISA方法具有简便、敏感、特异性和稳定性好的特点,可用于Hps抗体的检测.
[1]GLASSER K.Untersuchungen uber die schweineseuchemit besonderer berucksichtigung ihrer aetiologic und pathologie[J].Deutsche Tierarztliche Wochenschrift,1910,18:729 -733.
[2]KIELSTEIN P,RAPP-GABRIELSON V J.Designation of15 srovars ofHaemophilu parasuison the basis of immunodiffusion using heat-stable antigen extracts[J].Clin Microbiol,1992,30:826 -865.
[3]AMANO H,SHIBATA M,KAJIO N,et al.Pathologic observations of pigs intranasally inoculated with serovar 1,4 and 5 ofHaemophilus parasuisusing immunoperoxidasemethod[J].JVetMed Sci,1994,56:639 -644.
[4]CAIX,CHEN H,BLACKALL P J,et al.Serological characterization ofHaemophilus parasuisisolates from China[J].Vet Microbiol,2005,111(3 -4):231 -236.
[5]DETMERSF JM,LANFERMEIJER F C,POOLMAN B.Peptides and ATP binding cassette peptide transporters[J].Res Microbiol,2001,152(3):245 -258.
[6]ANGENA O,OLIVEIRA S,AHRENSP.Development of an improved species specific PCR test for detection ofHaemophilus parasuis[J].VetMicrobiol,2007,119(2/4):266 -276.
[7]LANCASHIRE JF,TURNIC,BLACKHALLP J.Rapid and efficient screening ofa representational difference analysis library using reverse southern hybridisation:identification ofgenetic differences betweenHaemophilus parasuisisolates[J].JMicrobiol Methods,2007,68(2):326 -330.
[8]NIELSIN R.Pathogenicity and immunity studies ofHaemophilus parasuisserovars[J].Acta Vet Scand,1993,34(2):193 -198.
[9]车勇良,陈如敬,王隆柏,等.副猪嗜血杆菌可视化LAMP检测方法的建立与应用[J].西北农林科技大学学报:自然科学版,2012,41(12):61 -66.
[10]魏子贡,蔡旭旺,金梅林.副猪嗜血杆菌抗体间接血凝检测方法的建立及应用[J].中国兽医科学,2006,36(9):713-718.
[11]MINIATSO P,SMART N L,EWERT E.Vaccination of gnotobiotie primary specific pathogen free pigs againstHaemophilus parasuis[J].Can JVet Res,1991,55(1):33 -36.
[12]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].2版.金冬雁,黎孟枫,侯云德,等译.北京:科学出版社,1999:125-126.
[13]OLIVEIRA S.Haemophilus parasuis:diagnosis,epidemiology and control[D].Minnesota:University of Minnesota,2003:129-134.
[14]尹秀凤,姜平,邓雨修,等.副猪嗜血杆菌的分离与鉴定[J].畜牧与兽医,2004,36(7):6-8.
[15]石碧,崔耀文,贾凡,等.副猪嗜血杆菌血清5型间接血凝试验和间接ELISA抗体检测方法的建立[J].中国兽医科学,2007,37(11):964 -968.
[16]王艳,夏万田,姜平,等.副猪嗜血杆菌间接ELISA抗体检测方法的建立[J].畜牧与兽医,2006,38(3):5-6.
[17]陈善真,李春玲,贾爱卿,等.副猪嗜血杆菌OMP5基因的克隆、表达及间接ELISA检测方法的建立[J].中国农业科学,2011,44(14):3036 -3044.
[18]贾爱卿,李春玲,王贵平,等.副猪嗜血杆菌ompP2基因的克隆、表达及间接ELISA抗体检测方法的建立[J].中国兽医学报,2011,31(9):1266 -1269.
[19]李鹏,姜平,李军星,等.副猪嗜血杆菌重组P2蛋白的高效表达及间接ELISA方法的建立[J].中国兽医学报,2011,31(4):480-484.
[20]HIGGINSC F.ABC transporters:physiology,structure andmechanism-an overview[J].Res Microbiol,2001,152(3 -4):205-210.
[21]GOMINETM,SLAMTIL,GILOISN,etal.Oligopeptide permease is required for expression of theBacillus thuringiensisplcRregulon and for virulence[J].Mol Microbiol,2001,40(4):963 -975.
[22]SOLOMON J,SU L,SHYN S,et al.Isolation and characterization ofmutants of theBacillus subtilisoligopeptide permease with altered specificity of oligopeptide transport[J].JBacteriol,2003,185(21):6425 -6433.
(责任编辑:施晓棠)
Cloning and expression of oppA gene and development of an indirect enzyme-linked immunosorbent assay for detecting antibody against Haemophilus parasuis
CHE Yong-liang,CHEN Ru-jing,JIANG Bin,WANG Long-bai,WEIHong,WU Xue-min,ZHUANG Xiang-sheng,ZHOU Lun-jiang
(Institute of Animal Husbandry and Veterinary Medicine,Fujian Academy of Agricultural Sciences,Fuzhou,Fujian 350013,China)
TheoppAgene which encodesHaemophilus parasuisoligopeptide binding protein A(OppA)was amplified by PCR.Sequencing results showed thatamplifiedoppAgene was1654 bp fragment,the genewas inserted into the expression vector pGEX-6p-1.A fusion protein was expressed in BL21 that transfected by pGEX-6p-1-oppA and induced by IPTG.Themolecular weightof the recombinant was about87 ku by SDS-PAGE.An indirectenzyme-linked immunosorbentassay for detecting antibody againstH.parasuiswas developed by using OppA protein expressed as coating antigen.The results of tests showed that coating antigen concentration for OppA is 1 μg·well-1incubated optimally 1 h at 37 ℃,and the serum dilution fold is 1∶50.The positive criterion for this ELISA assay isD450nm>0.643.Specificity and repeatability tests conformed that developed ELISA had good specificity and stability.So this assay can be used as a tool of diagnosis and quarantine ofH.parasuis.
Haemophilus parasuis;oppAgene;cloning;expression;indirect ELISA
S852.61
A
1671-5470(2015)03-0282-07
10.13323/j.cnki.j.fafu(nat.sci.).2015.03.011
2014-05-28
2014-07-10
国家公益性行业(农业)科研专项(NYHYZX07-034);福建省公益类科研专项(2010R1025-2);福建省农业科学院创新团队项目(CXTD-1-1306).
车勇良(1976-),男,副研究员,硕士.研究方向:预防兽医学.Email:cyl19760810@163.com.通讯作者周伦江(1973-),男,副研究员,博士.研究方向:动物病毒学.Email:lunjiang@163.com.
