寄生于花生的根腐线虫种类鉴定及致病性测定
2015-03-02廖琳琳章淑玲张绍升
廖琳琳,章淑玲,肖 顺,张绍升
(福建农林大学植物保护学院,福建福州 350002)
寄生于花生的根腐线虫种类鉴定及致病性测定
廖琳琳,章淑玲,肖 顺,张绍升
(福建农林大学植物保护学院,福建福州 350002)
在福建省福清市渔溪镇花生根部发现根腐线虫的侵害,通过形态特征观察和rDNA-ITS区测序及序列比对,将其鉴定为咖啡根腐线虫.盆栽接种试验证明,该线虫可以侵染花生的根系和荚果,影响植株生长并降低结荚率,对花生具有显著的致病性.
咖啡根腐线虫;花生;致病性
花生(Arachis hypogaeaL.)是我国重要的经济和油料作物.花生生长过程中易遭受许多病原菌的侵害,其中线虫病的危害极其严重.我国已报道寄生于花生的线虫达到13属22种[1-4],在我国北方花生产区花生根结线虫病发生严重[5-7].近几年,我国发现花生茎线虫病,其病原被鉴定为腐烂茎线虫(Ditylenchus destructor)[8-9],2013 年报道了花生茎线虫(Ditylenchusarachis)[10].最近,在福建省的花生根部和果荚上发现根腐线虫(Pratylenchussp.),但有关根腐线虫对花生的危害性在我国尚无报道.因此,本文对花生根腐线虫病的症状进行观察描述,利用形态学和分子生物学方法鉴定线虫种类,并通过盆栽接种试验测定该线虫对花生的致病性.
1 材料与方法
1.1 样本采集和症状观察
线虫样本采自福建省福清市渔溪镇花生的根、荚果和根际土壤.
症状观察以田间症状和接种症状相结合,肉眼观察病株地上部的生长情况、根部被害状、果荚形状和病变组织特征,以及果荚内壁组织和种皮病变状况.病根、病荚和种皮内的线虫采用组织染色法进行观察[11].
1.2 线虫的分离
取田间长势衰弱的花生植株的根系、荚果和根际土壤,采用贝曼漏斗法[1]分离线虫.另外,病根、病荚和种皮内的线虫采用直接解剖分离.
1.3 线虫的纯化和培养
收集从病荚中分离的线虫,在体视显微镜下挑取形态一致的根腐线虫成熟雌虫于凹玻片的灭菌水中,经光学显微镜检查确定该线虫的形态.将经过检查确认的线虫作为培养繁殖的接种体,移入0.2%氯霉素溶液中消毒15 min,用无菌水清洗3次后,转移至胡萝卜愈伤组织上,每块愈伤组织中接种30条成熟雌虫.接种线虫后的胡萝卜愈伤组织于28℃黑暗培养60 d,繁殖出大量的线虫.
将培养繁殖线虫的胡萝卜愈伤组织移入小烧杯中捣碎并用无菌水搅拌浸泡,用过筛法筛取线虫,用于形态鉴定、分子生物学鉴定以及致病性测定.
胡萝卜愈伤组织的制备方法参照文献[1].选择健康无损伤的胡萝卜,用自来水洗净并晾干.在超净工作台上将清洁的胡萝卜用75%酒精浸泡数秒后,点燃烧干残留于其表面的酒精,用灭菌刀片削去胡萝卜表皮,选取中间段切成7 mm厚的薄片.将薄片移入灭菌的培养皿中,每皿放置一片,用保鲜膜密封后置于28℃恒温培养箱中黑暗培养,待愈伤组织形成后即可使用.
1.4 线虫标本制作与保存
将纯化培养得到的线虫置于体视显微镜下,挑取雌虫和雄虫于凹玻片的水滴中,经酒精灯火焰温热杀死.将杀死后的线虫挑到滴有TAF固定液的载玻片上制成临时玻片,用于形态特征观察.取部分线虫样本经脱水后制成永久玻片用于保存[1].
1.5 线虫种类鉴定
1.5.1 形态学鉴定 利用光学显微镜观察线虫雌、雄虫的形态特征并测量.形态计测采用De Man公式[1]:DGO=背食道腺开口至口针基部球的距离,EP=排泄孔至头端距离,VA=阴门至肛门的距离,VBW=阴门处体宽,PUS=后阴子宫囊长,a=体长/最大体宽,b=体长/头端至食道与肠连接处的距离,b'=体长/头端至食道末端的距离,c=体长/尾长,c'=尾长/肛门处体宽,V=阴门至头顶距离×100/体长,T=泄殖腔至精巢最前端距离×100/体长.
1.5.2 分子鉴定 (1)DNA提取.从纯化培养分离得到的线虫中挑取单条雌虫,置于灭菌的ddH2O中清洗 3 次.取 20 μLWLB 裂解液 (50 mmol·L-1KCl、10 mmol·L-1Tris pH 8.3、2.5mmol·L-1MgCl2、0.45%NP 40、0.45%Tween 20,pH=8.3)于200 μL 的PCR 管中,并加1 μL 蛋白酶K 溶液(1.2 mg·mL-1)混匀.挑取经清洗的线虫于混合液中,用挑针压断线虫,将其置于-20℃冰箱中过夜.然后放入PCR仪中65℃温育1 h,95℃ 10 min,降温至4℃后,将其作为模板加入反应体系中扩增.ITS区扩增:引物为通用引物TW81(5'-GTTTCCGTAGGTGAACCTGC-3')和AB28(5'-ATATGCTTAAGTTCAGCGGGT-3').采用50μL反应体系,包括25 μL PCR Master Mixture、5 μL DNA 模板、2 μL上游引物(10 mmol·L-1)、2 μL下游引物(10 mmol·L-1)、16 μL ddH2O.扩增程序:95℃预变性 150 s;95 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃最后延伸10 min,于12℃保存[12].
(2)电泳检测.反应结束后,将1%琼脂糖凝胶置于0.5×TBE的电泳缓冲液中.取5μL扩增产物与1μL 6×loadingbuffer和0.2μL核酸染料混合,将其加入凝胶孔中,在电压100 V、电流40 mA的条件下电泳30 min.电泳结束后,用全自动凝胶成像仪观察、拍照.
(3)PCR产物纯化、克隆和测序分析.PCR产物送交生工生物工程(上海)股份有限公司进行纯化、克隆和测序.将测序结果拼接后在NCBI上进行相似性比对,并在GenBank上登录以获得相应登录号.从基因库中下载相应序列进行比对分析,同时使用贝叶斯法[13]构建系统发育树.
1.6 致病性测定
将土壤(稻田土∶河沙=1∶1)置于烘箱中摊为10 cm厚的土层,经过170℃灭菌3 h,待冷却2 d后,分装于塑料花盆内(直径25 cm).将花生种子在冷水中浸泡24 h,保湿发芽后播植于花盆内的灭菌土壤中.出苗10 d后,选留长势一致的健壮花生苗进行移栽.移栽土为相同的灭菌土,每盆1株,共栽种6盆.设3盆作为对照(不接种线虫),另外3盆接种含有各龄根腐线虫的悬浮液(500条左右)于植株根部.荚果成熟期(约100 d)检查线虫侵染情况.
2 结果与分析
2.1 线虫田间为害症状与致病性测定
在田间受根腐线虫侵害的花生植株长势矮小、衰弱(图1A).结荚数减少60%以上,果荚表面形成黑色侵染伤斑;根瘤形成少或无根瘤;根系变黑,表皮腐烂(图1B).在体视显微镜下解剖病组织可以观察到大量根腐线虫,同时对病组织染色可以看到入侵的线虫(图1C).
与未接种植株相比,接种植株地上部表现为黄化、矮小和生长不良(图1D);接种的花生植株根系变黑、腐烂,荚果少且不饱满(图1E).对病根和病荚组织染色可发现线虫寄生于其中(图1F).

图1 根腐线虫危害花生的症状及接种试验Fig.1 Symptoms of peanut infected by root-lesion nematodes and inoculation test
2.2 病原线虫种类鉴定
2.2.1 形态特征 形态测量值见表1.
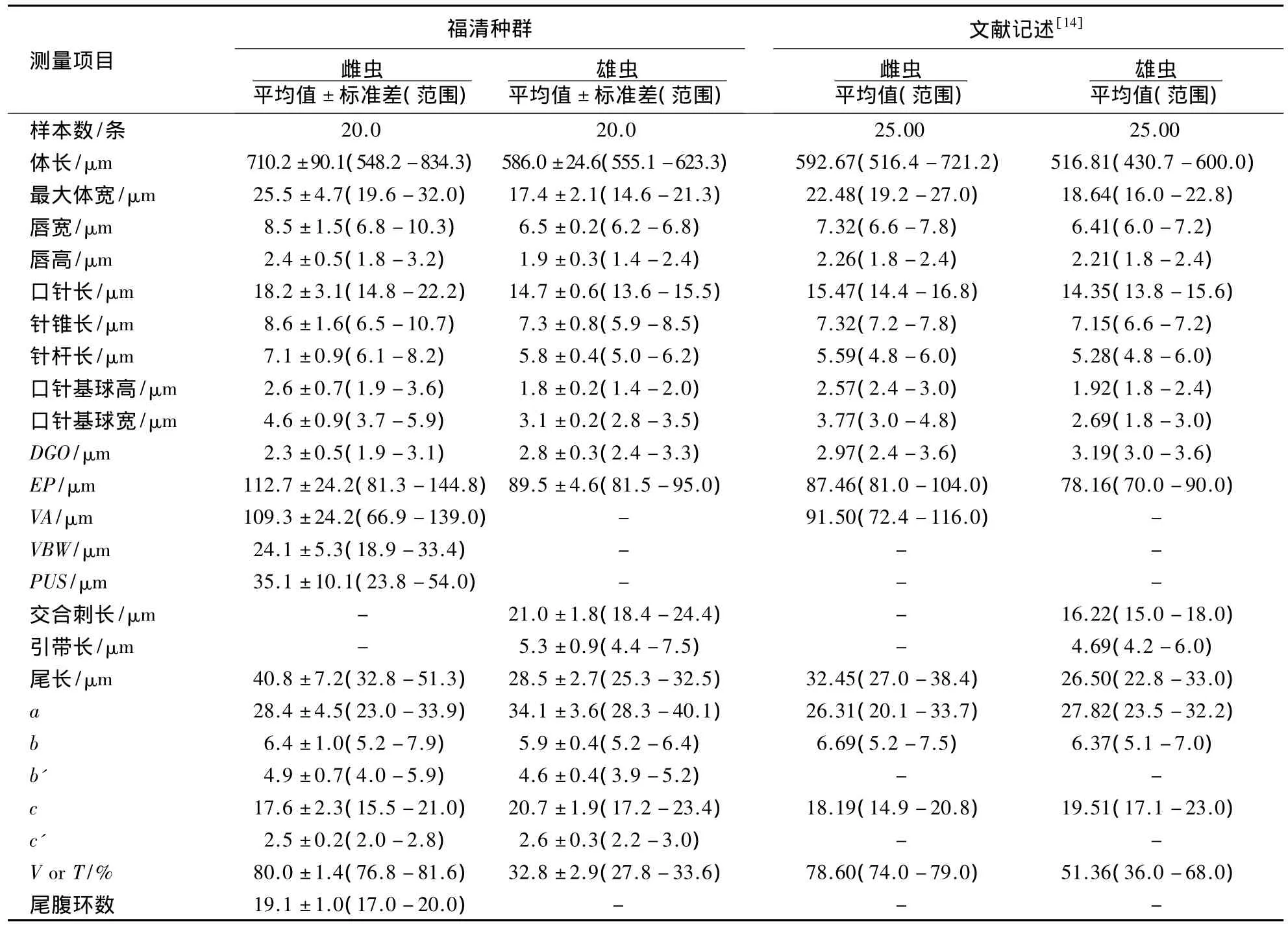
表1 福建花生根腐线虫与文献记述的咖啡根腐线虫形态测量值比较Table 1 Morphometrics of root-lesion nematode from Fujian peanut and Pratylenchus coffeae from the previous records
雌虫:虫体经缓慢加热杀死后,体僵直或稍向腹面弯曲(图2A).唇区低平,有2个唇环.口针粗短、发达,基部球圆形;背食道腺开口距口针基部球2-3μm(图2C).体环明显,侧区具4条侧线,约占体宽的1/3(图2E).中食道球发达、卵圆形,食道腺从腹面和侧面覆盖肠的前端,覆盖长度为体宽的1.2-2.3倍.排泄孔位于食道—肠瓣门的前方,半月体紧靠排泄孔的前部,约2个体环的宽度(图2F).单卵巢前伸,后阴子宫囊长度为体宽的1.0-1.5倍.阴肛距约为尾长的2.7倍.尾部近圆柱形,末端宽圆(图2G)、平截(图2H)或斜截(图2I),光滑,无环纹;侧尾腺口较小,位于尾的中后部;尾腹环17-20个.
雄虫:前体部形态特征与雌虫基本相似(图2B、D).交合刺纤细、成对,长约21μm,引带长5μm,交合伞包至尾端,尾较尖(图2J).

图2 寄生于花生的根腐线虫形态特征Fig.2 Morphological characteristics of root-lesion nematodes parasiting on peanut
2.2.2 分子生物学鉴定 对根腐线虫的rDNA-ITS区测序后获得长度为1037 bp的序列.将该序列在GenBank上登录,登录号为KF534516.同时,BLAST比对分析表明,该线虫的rDNA-ITS序列与Pratylenchus coffeae序列的相似性最高,达到93% -99%.
从系统发育树(图3)来看,该线虫与P.coffeae种群同源性最高,以100%的置信度归为一大支,且遗传距离小;与其他根腐线虫“种”同源性较低,分列于不同枝;与不同属的相似穿孔线虫同源性最低.
2.2.3 分类地位 根据线虫形态学观察及分子生物学测定结果,并与参考文献[14-15]的描述比对可知,采自福建省渔溪镇花生的根腐线虫为咖啡根腐线虫[Pratylenchus coffeae(Zimmermann)Filipjev&Schuurmans Stekhoven],隶属垫刃目(Tylenchida)垫刃总科(Tylenchoidea)根腐科(Pratylenchidae)根腐线虫属(Pratylenchus).
3 结论
在福建省福清市的花生根部发现根腐线虫侵染.通过线虫的形态特征观察和rDNA-ITS区测序及系统发育树比对,将该线虫鉴定为咖啡根腐线虫.经胡萝卜愈伤组织培养繁殖,并接种于花生植株,证明其对花生具有致病能力.田间调查和接种试验证明咖啡根腐线虫为害花生根系和荚果,造成根系腐烂,严重影响花生的产量和品质.福建省是我国花生的主产区之一,咖啡根腐线虫对花生的危害需引起有关部门的重视,及时采取相应的防控措施.

图3 基于ITS序列的系统发育树Fig.3 Phylogenetic tree based on ITS sequence
[1]张绍升.植物线虫病害诊断与治理[M].福州:福建科学技术出版社,1999:71-89,178-180.
[2]刘维志.植物线虫志[M].北京:中国农业出版社,2003:39-58.
[3]章淑玲,李世通,黄艳,等.福建省花生根部寄生线虫种类鉴定[J].植物保护,2012,38(5):128-133.
[4]章淑玲,李世通,刘国坤,等.花生种荚内寄生线虫的种类鉴定[M].廖金玲.中国线虫学研究.北京:中国农业科学技术出版社,2012:53-58.
[5]陈品三,彭德良.我国花生根结线虫种和小种鉴定及其细微结构观察和地区分布[J].中国油料,1989(2):47-50.
[6]宾淑英,冯志新.花生根结线虫对花生的致病性研究[J].仲恺农业技术学院学报,1993,6(1):7-13.
[7]肖顺,程云,张绍升.寄生于花生的根结线虫种类[C]∥彭友良,王振中.中国植物病理学会2008年学术年会论文集.北京:中国农业科学技术出版社,2008:435.
[8]程云,张绍升.腐烂茎线虫对花生的致病性[J].福建农林大学学报:自然科学版,2007,36(5):454-457.
[9]李世通,肖顺,章淑玲,等.腐烂茎线虫的培养[J].福建农林大学学报:自然科学版,2014,43(1):11-13.
[10]ZHANG S L,LIU G K,JANSEEN T,et al.A new stem nematode associated with peanut pod rot in China:morphological and molecular characterization ofDitylenchus arachisn.sp.(Nematoda:Anguinidae)[J].Plant Pathology,2014,63(5):1193-1206.
[11]BYRD DW,KIRKPATRICK JT,BARKER K R.An improved technique for clearing and staining plant tissue for detection of nematodes[J].Journal of Nematology,1983,15(1):142 -143.
[12]UEHARA T,MIZUKOBO T,KUSHIDA A,et al.Identification ofPratylenchus coffeaeandP.loosiusing specific primers for PCR amplification of ribosomal DNA[J].Nematologica,1998,44(4):357 -368.
[13]吴祖建,高芳銮,沈建国.生物信息学分析实践[M].北京:科学出版社,2010:177-180.
[14]ROMAN J,HIRSCHMANN H.Morphology and morphometrics of six species ofPratylenchus[J].Journal of Nematology,1969,1(4):363 -368.
[15]POURJAME E,WAEYENBERGE L,MOENSM,etal.Morphological,morphometrical and molecular study ofPratylenchus coffeaeandPratylenchus loosi(Nematoda:Pratylenchidae)[J].Mededelingen-Faculteit Landbouwkundige en Toegepaste Biologische Wetenschappen Universiteit Gent,1999,64(3):391 -401.
(责任编辑:杨郁霞)
Identification and pathogenicity of root-lesion nematodes parasiting on the peanut
LIAO Lin-lin,ZHANG Shu-ling,XIAO Shun,ZHANG Shao-sheng
(College of Plant Protection,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
Root-lesion nematodeswere discovered from the root of peanut in Yuxi,Fuqing,Fujian Province.According to themorphological and rDNA-ITS characteristics,the nematodes were identified asPratylenchus coffeae.Inoculation test showed that the nematodes could infect the pods and root of peanut,limite the growth of peanut and reduce the number of pods.It really indicated thatP.coffeaecould cause the disease seriously.
Pratylenchus coffeae;peanut;pathogenicity
S432.4
A
1671-5470(2015)03-0240-05
10.13323/j.cnki.j.fafu(nat.sci.).2015.03.004
2014-04-16
2014-05-12
国家自然科学基金—青年科学基金(31201495).
廖琳琳(1989-),女,硕士研究生.研究方向:植物检疫和植物线虫学.Email:liaolinlin100@126.com.通讯作者张绍升(1951-),男,教授.研究方向:植物线虫学.Email:shaoshengzhang@126.com.
