乌司他丁对中暑大鼠肾损伤及氧化应激的影响
2015-03-02彭娜耿焱张爽唐柚青文强刘云松苏磊
彭娜,耿焱,张爽,唐柚青,文强,刘云松,苏磊
中暑以高热和神经系统功能紊乱为主要特征,可发展为重症中暑(severe heat stroke,SHS),导致多脏器功能衰竭,甚至死亡。肾损伤是重症中暑常见的并发症,可导致住院时间延长、死亡发生率增加。研究表明,中暑时的多种病理生理因素可导致脏器功能损伤,包括炎症反应、内皮损伤、缺血缺氧、凝血障碍等[1]。乌司他丁(UTI)是一种胰蛋白酶抑制剂,具有抑制蛋白酶活性和炎症因子过度释放、清除氧自由基等作用,对多种因素导致的脏器功能损害具有保护作用[2-6]。本研究从氧化应激的角度初步探讨了SHS导致肾损害的机制,并进一步观察乌司他丁对中暑氧化应激和肾损伤的影响。
1 材料与方法
1.1 实验动物及分组 雄性SPF级Wistar大鼠42只,体重220~250g,由广州军区广州总医院动物中心提供,实验动物的相关方案通过动物伦理委员会批准。大鼠随机分为对照组(n=6)、中暑组(HS组,n=18)及乌司他丁治疗组(UTI组,n=18)。对照组置于23.0±0.2℃室温下饲养,其他两组复制中暑模型[7]。UTI组于制模前腹腔注射UTI 10万U/kg,每12h重复给药,其余两组大鼠均注射等量生理盐水。模型复制成功后,迅速转移至与对照组相同环境下复温,自由进食水。
1.2 SHS模型复制 将HS组大鼠置于仿真高温气候舱内(4m×3m×2m,由南方医科大学公共卫生热带医学院提供),舱内温度39.5±0.2℃,湿度60%±5%。分别采用直肠热电偶(BW-TH 1101,Biow ill,上海)置入大鼠直肠深度约6.5cm处监测核心体温,经鼠尾无创血压监测系统(Biowill,上海)行无创血压监测,每次10m in。以大鼠收缩压自峰值开始下降作为中暑标志[8-9]。
1.3 标本采集及处理 对照组于造模前麻醉处死,HS组及UTI组大鼠于造模0、6、24h分批予5%水合氯醛(0.2m l/100g)麻醉,经心脏采血约3m l。3000r/min离心分离血浆,–20℃低温保存待检。取一侧肾脏组织立即置于–80℃保存以制备组织匀浆,另一侧肾脏留取标本行组织学检查。以最快的速度留取肾脏组织标本2.5mm3大小,以4%多聚甲醛固定,石蜡包埋切片,行HE染色及光镜检查。取4~5块1mm3大小的一侧肾皮质区组织,置于专用固定液中,4℃冰箱保存,制作电镜切片并观察肾小管细胞的超微改变。
1.4 指标检测及评分标准
1.4.1 血清肾功能指标检测 采用全自动生化分析仪(Hitachi 7600,日本日立公司)检测血清肌酐(Cr)、尿素氮(BUN)水平,按说明书步骤进行操作。
1.4.2 肾脏组织氧化应激指标检测 采用南京建成生物工程研究所提供的试剂盒检测大鼠肾脏组织氧化应激指标。以还原型谷胱甘肽法测定谷胱甘肽过氧化物酶(GPx)活性,硫代巴比妥酸(TBA)反应法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性。
1.4.3 肾损伤组织学评分 采用Paller法进行肾损伤组织学评分。每只大鼠在400倍光镜下随机选10个视野观察,每组60个视野,评分标准包括:肾小管明显扩张,细胞扁平为1分;刷状缘损伤为1分,脱落为2分;细胞质空泡1分;间质水肿1分;肾小管腔内有脱落的坏死细胞未形成管型或碎片为1分,形成管型或碎片为2分。
1.5 统计学处理 采用SPSS 17.0软件进行统计分析,计量资料以表示,多组间比较采用方差分析,进一步两两比较采用Bonferroni法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肾功能指标变化 与对照组比较,中暑后6h,HS组和UTI组大鼠血清BUN和Cr均明显升高(P<0.05),24h达到峰值,但UTI组升高的程度较同时间点HS组明显减轻(P<0.05,表1)。
2.2 大鼠肾组织氧化应激指标变化 与对照组比较,HS组及UTI组大鼠肾组织MDA水平于模型复制成功后0h明显升高(P<0.05),6h及24h有所下降,但仍明显高于对照组(P<0.05),而UTI组各时间点MDA水平升高程度较HS组明显减轻(P<0.05)。HS组大鼠肾组织SOD和GPx活性于模型复制后6h明显低于对照组和UTI组(P<0.05),而UTI组与对照组比较无明显下降(P>0.05,表1)。
2.3 大鼠肾组织病理检查及损伤评分比较 光镜下,中暑后24h中暑大鼠肾脏表现为中性粒细胞浸润、肾小管肿胀坏死及蛋白样物质沉积,与HS组比较,UT I组上述表现明显减轻。电镜下,HS组肾小管线粒体广泛空泡化,UTI组肾小管线粒体部分空泡化(图1)。Paller评分显示,与对照组(13.21±4.06)比较,HS组及UTI组大鼠肾损伤Paller评分明显升高(分别为82.31±10.43、193.23±6.58),差异均有统计学意义(P<0.05)。
表1 各组大鼠血清Cr、BUN及肾组织氧化应激指标的变化(±s,n=6)Tab.1 Changes of serum Cr and BUN and oxidative stress indicators of kidney tissues in the rats of different groups (±s, n=6)
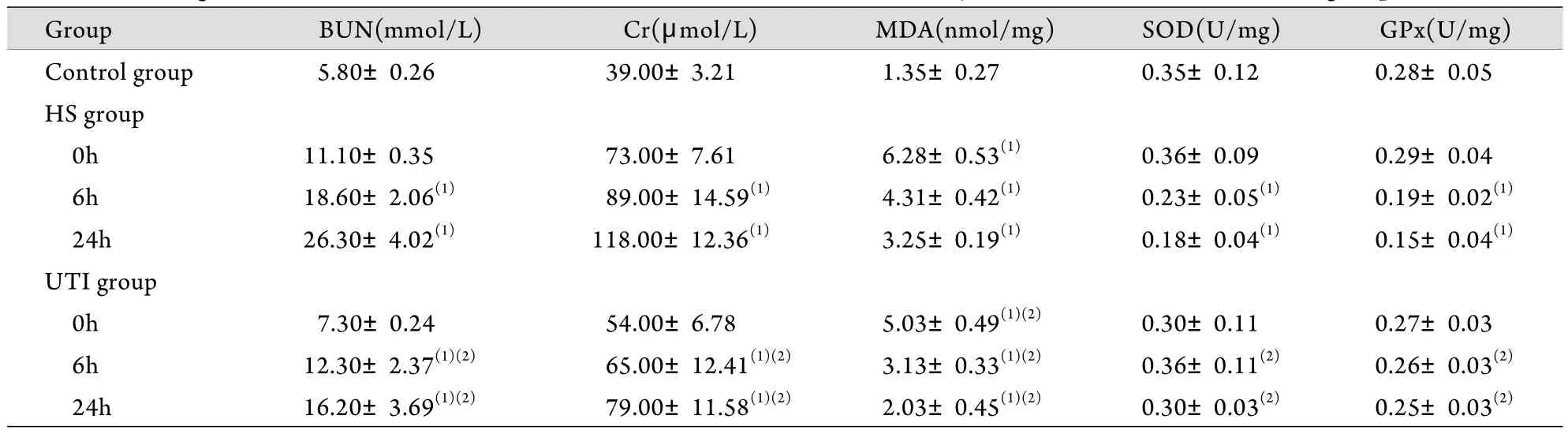
表1 各组大鼠血清Cr、BUN及肾组织氧化应激指标的变化(±s,n=6)Tab.1 Changes of serum Cr and BUN and oxidative stress indicators of kidney tissues in the rats of different groups (±s, n=6)
(1)P<0.05 compared with control group; (2)P<0. 05 compared with HS group
Group BUN(mmol/L) Cr(μmol/L) MDA(nmol/mg) SOD(U/mg) GPx(U/mg)Control group 5.80±0.26 39.00±3.21 1.35±0.27 0.35±0.12 0.28±0.05 HS group 0h 11.10±0.35 73.00±7.61 6.28±0.53(1) 0.36±0.09 0.29±0.04 6h 18.60±2.06(1) 89.00±14.59(1) 4.31±0.42(1) 0.23±0.05(1) 0.19±0.02(1)24h 26.30±4.02(1) 118.00±12.36(1) 3.25±0.19(1) 0.18±0.04(1) 0.15±0.04(1)UTI group 0h 7.30±0.24 54.00±6.78 5.03±0.49(1)(2) 0.30±0.11 0.27±0.03 6h 12.30±2.37(1)(2) 65.00±12.41(1)(2) 3.13±0.33(1)(2) 0.36±0.11(2) 0.26±0.03(2)24h 16.20±3.69(1)(2) 79.00±11.58(1)(2) 2.03±0.45(1)(2) 0.30±0.03(2) 0.25±0.03(2)

图1 各组大鼠肾脏组织病理改变Fig.1 Renal histopathological change of rats in control group, HS group and UTI group A. Electron m icroscopy (×30 000); B. Light m icroscopy (×400)
3 讨 论
SHS常导致多脏器功能损伤,肾脏是其中最常见的损伤脏器之一。因病情严重程度的不同,SHS临床表现不一,轻者出现蛋白尿、血尿,重者可出现肾衰竭,导致病程延长及预后不良。本研究在复制大鼠SHS模型的基础上,观察早期肾脏功能和组织病理的动态改变。结果表明,在SHS早期,大鼠即出现进行性肾功能损害,病理损伤表现为中性粒细胞浸润、组织间隙充血水肿、肾小管坏死及蛋白管型。上述变化与既往文献报道基本一致[10]。
氧化应激是机体正常的氧化和抗氧化失衡所致,是氧自由基蓄积而产生的损伤,包括细胞微分子的氧化修饰、细胞结构损伤和器官损伤[11]等。氧化应激与人类多种疾病的发生、发展密切相关[12]。文献报道,氧自由基及其衍生产物参与了脓毒症的发生和发展,是导致脓毒症脏器功能损害的重要机制[13]。在合并急性肾衰竭的危重病患者中,氧化应激水平亦显著升高[14]。
中暑被认为是较脓毒症更为剧烈的失控性炎症反应,其激活的中性粒细胞和巨噬细胞甚至内皮细胞均可产生大量的氧自由基[15]。已有大量研究关注热应激下氧自由基与脏器损伤的关系。体外及体内实验显示,热应激可导致小肠活性氧及MDA等氧化应激产物含量升高,并伴随着促凋亡p38MAPK途径的激活[16]。本研究重点对肾脏氧化应激及损伤状况进行分析,结果显示SHS大鼠肾组织MDA含量于造模后0h开始明显升高,SOD和GPx活性于造模后6h明显下降,24h较前有所恢复,但与对照组比较差异仍有统计学意义,同时肾功能随病情发展而加重,且伴病理结构的损害。MDA是体内多不饱和脂肪酸过氧化变性的终产物,代表了整体脂质的氧化水平。SOD和GPx是机体重要的抗氧化酶,结合MDA水平,可以反映机体的氧化应激状况。本实验结果表明,SHS时氧化应激可能是急性肾脏损伤的病理生理机制之一。
UTI是从健康男性尿液中提取的尿胰蛋白酶抑制剂[17-18],大量研究证实其具有稳定溶酶体膜、减少炎症介质释放的作用[19-21]。Ito等[22]报道UTI可以降低急性肺损伤小鼠肺组织髓过氧化物酶水平,从而改善肺水肿和肺出血症状。Tanaka等[23]报道,UTI可减少内毒素血症大鼠氧自由基的产生,其机制可能与UTI抑制了还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的作用有关。基于上述研究,本研究进一步观察了UTI对SHS大鼠肾脏氧化应激及损伤的影响,结果显示UTI治疗组大鼠肾脏MDA含量较HS组明显下降,SOD和GPx活性则明显升高,表明UTI可以减轻肾脏的氧化应激水平,从而保护肾功能。
综上所述,本研究在SHS大鼠模型基础上观察了UTI对肾脏氧化应激及肾损伤的影响,结果显示UTI可以降低SHS大鼠肾脏MDA的含量,抑制SOD和GPx活性的下降,从而减轻肾脏的氧化应激水平,同时肾脏的病理损伤和肾功能指标得到改善。因此,UTI可能是早期治疗SHS肾脏损伤的有效药物,进一步的机制及剂效关系研究可为其临床应用提供更多理论依据。
[1] Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25): 1978-1988.
[2] Ogawa M, Nishibe S, Mori T,et al. Effect of human urinary trypsin inhibitor on granu locyte elastase activity[J]. Res Commun Chem Pathol Pharmacol, 1987, 55(2): 271-274.
[3] Yang XY, Wang ZG, Wang TY,et al. Effects of ulinastatin on myocardial protection in patients with on- pump coronary artery bypass grafting[J]. J Logist Univ PAPF (Med Sci), 2014, 23(9):744-746. [杨学永, 王振国, 王韬渊, 等. 乌司他丁对体外循环冠状动脉旁路移植术患者心肌保护作用[J]. 武警后勤学院学报(医学版), 2014, 23(9): 744-746.]
[4] Liu YF, Wang ZG, Tang HW,et al. Protective effect of ulinastatin on inhalation lung injury caused by black gunpowder smoke in rats and its inhibitory effect on the mRNA expression of IL-1β and TNF-α[J]. Med J Chin PLA, 2014, 39(3): 235-239. [刘一凡, 王正冠, 唐红卫, 等. 乌司他丁对黑火药烟雾所致吸入性肺损伤大鼠的保护作用以及对IL-1β、TNF-α基因表达的抑制作用[J]. 解放军医学杂志, 2014, 39(3): 235-239.]
[5] Wang H, Liu GJ, Hu M. Protective eff ect of ulinastatin combined with xuebijing on mu ltiple organ function in Patients with sepsis[J]. Chin J Pract Intern Med, 2014, 34(S1): 113-116. [王虹,刘贵建, 胡敏. 乌司他丁联合血必净对脓毒症患者器官功能的保护作用[J]. 中国实用内科杂志, 2014, 34(S1): 113-116.]
[6] Wang XH, Hu JH, Shen YZ. Protective effects of Xingnaojing combined with u linastatin on brain in jury in severe acute pancreatitis of rats[J]. Tianjin Med J, 2013, 41(4): 349-352, 402.[王小红, 胡江鸿, 沈云志. 醒脑静联合乌司他丁对重症急性胰腺炎大鼠脑损伤的保护作用[J]. 天津医药, 2013, 41(4):349-352, 402.]
[7] Geng Y, Fu W, Liu YN,et al. Comparison of classical heat stroke between conscious and unconscious rat models[J]. Med J Chin PLA, 2013, 38(8): 615-619. [耿焱, 付炜, 刘亚楠, 等. 清醒与麻醉状态经典型热射病大鼠模型比较[J]. 解放军医学杂志,2013, 38(8): 615-619.]
[8] Yang HH, Chang CP, Cheng RT,et al. Attenuation of acute lung inflammation and injury by whole body cooling in a rat heatstroke model[J]. J Biomed Biotechnol, 2009, 2009: 768086.
[9] Lin MT, Kao TY, Jin YT,et al. Interleukin-1 receptor antagonist att enuates the heat stroke-induced neuronal damage by reducing the cerebral ischemia in rats[J]. Brain Res Bull, 1995, 37(6): 595-598.
[10] Austin MG, Berry JW. Observations on one hundred cases of heat stroke[J]. J Am Med Assoc, 1956, 161(16): 1525-1529.
[11] Lykkesfeldt J, Svendsen O. Oxidants and antioxidants in disease: oxidative stress in farm animals[J]. Vet J, 2007, 173(3): 502-511.
[12] Kehrer JP. Free radicals as mediators of tissue in jury and disease[J]. Crit Rev Toxicol, 1993, 23(1): 21-48.
[13] Andrades ME, Ritter C, Dal-Pizzol F. The role of free radicals in sepsis development[J]. Front Biosci (Elite Ed), 2009, 1: 277-287.
[14] Alonso de, Vega JM, Díaz J,et al. Oxidative stress in critically ill patients with system ic inflammatory response syndrome[J]. Crit Care Med, 2002, 30(8): 1782-1786.
[15] Salvem ini D, Cuzzocrea S. Oxidative stress in septic shock and dissem inated intravascular coagulation[J]. Free Radic Biol Med,2002, 33(9): 1173-1185.
[16] Yu J, Liu F, Yin P,et al. Involvement of oxidative stress and m itogen-activated protein kinase signaling pathways in heat stress-induced injury in the rat small intestine[J]. Stress, 2013,16(1): 99-113.
[17] Sato H, Kajikawa S, Kuroda S,et al. Impaired fertility in female mice lacking urinary trypsin inhibitor[J]. Biochem Biophys Res Commun, 2001, 281(5): 1154-1160.
[18] Yu JB, Yao SL. Protective effects of hem in p retreatm ent combined with ulinastatin on septic shocks in rats[J]. Chin Med J (Engl), 2008, 121(1): 49-55.
[19] Bingyang J, Jinping L, M ingzheng L,et al. Effects of urinary protease inhibitor on inflammatory response during on-pump coronary revascularisation[J]. J Cardiovasc Surg (Torino), 2007,48(4): 497-503.
[20] Inoue K, Takano H, Yanagisawa R,et al. Antioxidative role of urinary trypsin inhibitor in acute lung in jury induced by lipopolysaccharide[J]. Int J Mol Med, 2005, 16(6): 1029-1033.
[21] Huang RH, Wan XY. Effects of ulinastatin on toll-like receptor 4 signaling pathway in lung tissue of rats after lipopolysaccharide insult[J]. Chin J Emerg Med, 2012, 21(11): 1226-1229. [黄日红, 万献尧. 乌司他丁对脂多糖诱导的大鼠肺组织To ll样受体4信号通路表达的影响[J]. 中华急诊医学杂志, 2012,21(11): 1226-1229.]
[22] Ito K, M izutani A, Kira S,et al. Effect of U linastatin, a human urinary trypsin inhibitor, on the oleic acid-induced acute lung injury in ratsviathe inhibition of activated leukocytes[J]. Injury,2005, 36(3): 387-394.
[23] Tanaka R, Fujita M, Tsuruta R,et al. Urinary trypsin inhibitor suppresses excessive generation of superoxide anion radical,system ic inflammation, oxidative stress, and endothelial injury in endotoxem ic rats[J]. Inflamm Res, 2010, 59(8): 597-606.
