基于光学分子影像的术中肿瘤精确导航技术
2015-03-02何坤山迟崇巍田捷中国科学院分子影像重点实验室中国科学院自动化研究所北京100190
何坤山 迟崇巍 田捷(中国科学院分子影像重点实验室,中国科学院自动化研究所,北京100190)
基于光学分子影像的术中肿瘤精确导航技术
何坤山 迟崇巍 田捷
(中国科学院分子影像重点实验室,中国科学院自动化研究所,北京100190)
何坤山,中国科学院自动化研究所在读博士,主要研究方向光学分子影像手术导航系统硬件研发。
E-mail:hekunshan2014@ia.ac.cn

作者简介
迟崇巍,工学博士,中国科学院自动化研究所助理研究员,主要研究方向光学分子影像手术导航技术研发。
E-mail:chongwei.chi@ia.ac.cn
世界卫生组织发布的《2014年全球癌症报告》表明,在全球范围内每年癌症新增病例高达到1400万,死亡病例达到820万。同时,中国新增癌症病例在亚洲高居第一位。联合国癌症研究机构称,到2030年,全球每年将有1320多万人死于癌症,约为2008年癌症致死人数的两倍。如何在早期发现肿瘤组织及如何在手术过程中实现肿瘤的精确治疗一直是国际上具有挑战性的难题。

作者简介
田捷,工学博士,博士生导师,中国科学院自动化研究所研究员,两项国家重点基础研究发展计划(973计划)首席科学家(2006、2011)。
E-mail: tian@ieee.org; jie.tian@ ia.ac.cn
目前,外科手术过程主要依据医生对组织的色泽、质地、形态进行判断和切除,所以判断切除的范围与医生的临床经验有着密切的关系。如果可以在术中提供一些客观的肿瘤边界或者特异性组织边界信息,将有助于提高手术成功率、降低手术创伤、减少医疗费用、避免手术意外发生、促进病人康复。美国哈佛大学医学院John V. Frangioni教授 于2003年就提到,癌症术中成像技术之所以没有得到广泛的应用,首要原因就是没有适合外科医生的成像设备。现有的医学影像技术,如计算机断层成像(CT)、核磁共振成像(MRI)、正电子发射断层成像(PET)等,已在术前精确诊断和术后疗效评估等方面发挥了重要的作用,但难以在手术过程中发挥各自的功能。在2009年世界分子影像大会上,2008年度诺贝尔化学奖获得者钱永健先生报告了如何用荧光显微镜成像引导切除荧光标记的小鼠肿瘤组织 ,开启了光学分子影像技术在手术领域应用的先河。根据光穿透组织的能力与组织吸收光的强弱、光波的特性,650~900nm的近红外光(Near-Infrared,NIR)被称为“组织光窗(Tissue Optical Window)”。与可见光相比,近红外光具有组织吸收散射少、自体荧光小、信背比高等优点。研究表明,光学分子影
de Grand A M, Frangioni J V. An operational near-infrared fluorescence imaging system prototype for large animal surgery. Technol Cancer Res Treat (2003),2: 553-562.
Nguyen Q T, Olson E S, Aguilera T A, et al. Surgery with molecular fluorescence imaging using activatable cell-penetrating peptides decreases residual cancer and improves survival. Proceedings of the National Academy of Sciences of the United States of America (2010) , 107: 4317-4322.
Savariar E N, Felsen C N, Nashi N, et al. Realtime in vivo molecular detection of primary tumors and metastases with ratiometric activatable cellpenetrating peptides, Cancer Res, vol. 73, pp. 855-64, Jan 15 2013.
Nagtegaal I D, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer. J Clin Oncol, 2008, 26: pp. 303-312.
Newman I M, Samson M C. The application of laser-assisted indocyanine green fluorescent dye angiography in microsurgical breast reconstruction. J Reconstr Microsurg, 2009, 25, 21-26.
van Dam G M, Themelis G, Crane L M A, et al.Intraoperative tumor-specific fluorescence imaging in ovarian cancer by folate receptor-α targeting: first in-human results. Nature Medicine, 2011, 17: 1315-1319.
Phillips B T, Lanier S T, Conkling N, et al. Intraoperative perfusion techniques can accurately predict mastectomy skin flap necrosis in breast reconstruction: results of a prospective trial, Plast Reconstr Surg, 2012. 129, 778e-88e.
Hirche C, Engel H, Kolios L, et al. An Experimental Study to Evaluate the Fluobeam 800 Imaging System for Fluorescence-Guided Lymphatic Imaging and Sentinel Node Biopsy.Surgical innovation, 2012.
H Nagafuji, Nakamura T. Feasibility of ICG fluorescence-guided sentinel node biopsy in animal models using the HyperEye Medical System. Annals of surgical oncology 2011,18:2042-2047.像手术导航技术能够显示组织水平、细胞和亚细胞水平的特定分子,反映活体状态下分子水平的变化,对其生物学行为在影像方面定性和定量研究,可帮助医生在术中发现微小癌灶,将亚毫米级的病变组织在术中实时显示出来,从而提高患者的预后效果~。
2011年,欧洲科学家研发了分子影像手术导航的原型系统,并首次应用到人体卵巢癌的临床手术中 ,相比于传统方法,提高了手术治疗效果。2012年,中国科学院分子影像重点实验室团队研发出具有自主知识产权的光学分子影像手术导航系统,目前已经应用于人体乳腺癌、肝癌和胃癌的术中精确定位和准确治疗上。与传统的医学影像方法相比,光学分子影像技术不仅可以用于肿瘤的早期发现和精确诊断,还可以为基于影像的手术提供强有力的支持,从而极大地推动生命科学和临床医学的发展,具有划时代的意义。
1 光学分子影像导航系统的分类
为了满足实时性、安全性、便捷性等不同的需求,各种新型的成像系统不断地被研发出来,并应用到了临床领域~。根据其特点,现有的系统可被分为便携式、功能型及内窥式三种类型。
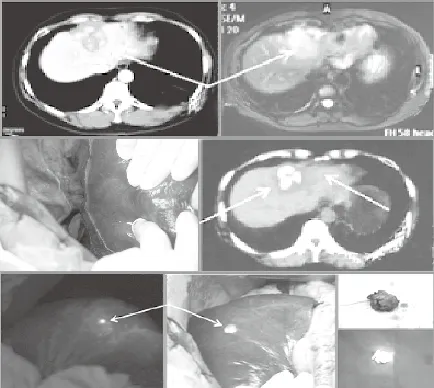
图1 光学分子影像术中精准定位微小肿瘤
1.1 便携式光学分子影像手术导航系统
便捷性是衡量光学分子影像手术导航系统的一个重要指标。中国科学院分子影像重点实验室自主研发的光学分子影像手术导航系统不仅能在术中实现快速的定位,而且使用方便。目前,已在中国人民解放军总医院、东方肝胆外科医院及珠江医院开展临床实验。在统计的58例肝癌患者中,其中有28例患者的微小肿瘤仅由分子影像方法检出,并实现了2毫米肿瘤的术中精确定位。
同时,肿瘤边界的精确识别一直是外科手术过程中的难题。在传统的手术过程中,医生只能通过触诊和视觉来判断肿瘤的大致位置,然后通过术中病理结果判断检测精度。而光学分子影像手术导航系统可以在术中实时判断肿瘤的边界,并给出肿瘤的范围和位置,引导医生实施精准的切除。
1.2 功能型光学分子影像手术导航系统
Themelis G, YooJ S, Soh K S, et al.Real-time intraoperative fluorescence imaging system using light-absorption correction," Journal of Biomedical Optics, 2009. 14:064012.
van der Poel H G, Buckle T, Brouwer O R, et al. Intraoperative laparoscopic fluorescence guidance to the sentinel lymph node in prostate cancer patients: clinical proof of concept of an integrated functional imaging approach using a multimodal tracer. European urology, 2011, 60:826-833.
Yamashita S i, Tokuishi K, Anami K, et al. Video-assisted thoracoscopic indocyanine green fluorescence imaging system shows sentinel lymph nodes in non–small-cell lung cancer. The Journal of thoracic and cardiovascular surgery, 2011. 141:141-144.
Spinoglio G, Priora F, Bianchi P P, et al. Realtime near-infrared (NIR) fluorescent cholangiography in single-site robotic cholecystectomy (SSRC): a single-institutional prospective study. Surgical endoscopy, 2012, 1-7.
Borofsky M S, Gill IvS, Hemal A K, et al. Near‐infrared fluorescence imaging to facilitate super‐selective arterial clamping during zero‐ischaemia robotic partial nephrectomy. BJU international, 2013.
Moroga T. , Yamashita S -i. , Tokuishi K, et al.Thoracoscopic segmentectomy with intraoperative evaluation of sentinel nodes for stage I non-small cell lung cancer," Annals of thoracic and cardiovascular surgery: official journal of the Association of Thoracic and Cardiovascular Surgeons of Asia, 2011. 18:89-94.
Gotoh K , Yamada T, Ishikawa O, H. Takahashi, et al.HOW I DO IT A Novel Image-Guided Surgery of Hepatocellular Carcinoma by Indocyanine Green Fluorescence Imaging Navigation. Journal of Surgical Oncology, 2009. 100: 75-79.
Mieog J S D, Hutteman M, van der Vorst J R, et al. Image-guided tumor resection using real-time near-infrared fluorescence in a syngeneic rat model of primary breast cancer. Breast Cancer Research and Treatment, 2011. 128: 679-689.
功能型手术导航系统能够实现术中多光谱图像的实时采集,并对荧光图像进行快速的矫正。结合前期“973”项目科研成果,针对临床需求自主研发了具有核心知识产权的术中功能型光学影像手术导航系统。系统(图2)类似于无影手术灯,通过探头中两台CCD相机的实时采集,实现了荧光图像与可见光图像的快速配准融合。目前,该系统已经应用于乳腺癌及胃癌的前哨淋巴结活检等方面。该系统在图像的快速融合与操作便捷性方面具有优势 ,先后获得了“日内瓦国际发明展览会金奖”、“第八届国际发明展览会金奖”、“第二十一届全国发明展览会金奖”等奖项。
在精确识别乳腺癌的前哨淋巴结方
Cahill R A, Anderson M, Wang L M, et al. Near-infrared (NIR) laparoscopy for intraoperative lymphatic road-mapping and sentinel node identification during definitive surgical resection of early-stage colorectal neoplasia, Surg Endosc.2012 26:197-204.
Liu Y , Njuguna R, Matthews T, et al. Near-infrared fluorescence goggle system with complementary metal–oxide–semiconductor imaging sensor and see-through display. Journal of biomedical optics.2013,18: 101303.
Chi C, Ye J, Ding H, et al. Use of Indocyanine Green for Detecting the Sentinel Lymph Node in Breast Cancer Patients: From Preclinical Evaluation to Clinical Validation. Plos One, 2013, 8(12): e83927.
Ali T, Choyke P L , Kobayashi H , Endoscopic molecular imaging of cancer, Future Oncology 2013,1501-1503.
Jafari M D, Lee K H, Halabi W J, et al. The use of indocyanine green fluorescence to assess anastomotic perfusion during robotic assisted laparoscopic rectal surgery. Surgical Endoscopy & Other Interventional Techniques, 2013, 27(8):3003-3008.
Sevick-Muraca EM Translation of Near-Infrared Fluorescence Imaging Technologies: Emerging Clinical Applications. Annual Review of Medicine, 2012, 63: 217-231.
Keereweer S, Van Driel P B, Snoeks TJ, et al. Optical image-guided cancer surgery: challenges and limitations. Clin Cancer Res,2013,19: 3745-3754.
Vahrmeijer A L, Hutteman M, van der Vorst JR,et al. Image-guided cancer surgery using nearinfrared fluorescence. Nat Rev Clin Oncol, 2013.面,针对99例的乳腺癌患者检测中,该系统的检测准确率为96%,而传统方法的准确率仅为69%;在胃癌的精确切除方面,该系统实现了3~5分钟术中快速精确定位病灶,引导外科医生精确切除了病灶,减少了患者创伤。欧洲肿瘤外科协会主席Graeme J. Poston和英国肿瘤外科协会主席Riccardo A. Audisio对该工作给予了高度评价,称其将是个体精准手术的下一个巨大进步。
1.3 内窥式光学分子影像手术导航系统
目前,手术作为癌症的主要治疗手段之一,正朝着微创、精准的方向发展。总的来说,手术可分为开放式手术和微创手术。开放式手术给医生提供了更大的操作空间,而微创手术则具有出血少、愈合快、疼痛小等优点。近年来,微创手术在肺癌、胃癌、结直肠癌、宫颈癌等疾病中得到了广泛的应用。微创手术的蓬勃发展离不开内窥镜的支持与贡献。从内窥镜出现到现在的50年间,内窥镜在图像采集设备、图像处理技术等多个方面取得了巨大的发展和进步,其成像质量已经能够满足医生的大部分手术需求。从光纤类型上来说,内窥镜可分为硬镜和软镜。硬镜成像质量好,而软镜在进入人体时对通道造成的损伤小。从用途上来说,内窥镜又可分为胸腔镜、腹腔镜、关节镜、耳鼻喉内窥镜、膀胱镜、喉镜等。不断出现的新的内窥镜促进了微创手术的进一步发展。然而,如何发现早期的、微小的、较深处的肿瘤依然是有待解决的挑战性难题。在微创手术中,医生仅能依赖内窥镜所提供的视觉信息来判断肿瘤,这常常导致颜色和形态与正常组织相似的微小肿瘤病灶被遗漏。
图2 自主研发的光学分子影像手术导航系统
近年来,随着光学分子影像技术的不断发展,内窥式光学分子影像手术导航系统为微创肿瘤治疗提供一种较好的解决办法。目前,这些系统已经在肿瘤的术中引导切除与肿瘤的微创治疗等方面发挥了重要的作用 。由于体内天然的暗室环境,使得内窥式光学分子影像手术导航系统采集的图像具有较高的信背比。中国科学院分子影像重点实验室与北京大学人民医院合作,自主研发的光学分子影像胸腔镜手术导航系统,能够高灵敏地检测肺癌结节病灶及乳糜管位、肺段造影等疾病,为临床手术治疗提供了有效帮助。
2 小 结
精准医疗是应用现代遗传技术、分子影像技术、生物信息技术,结合患者的生活环境和临床数据,实现精准的疾病分类及诊断,制定其个性化的疾病预防和治疗方案的新方法和新技术。精准医疗的发展和进步将会提高医生治疗疾病的能力,对癌症的治疗也将产生巨大的推动作用。其中,新兴的分子影像技术是医学影像技术与现代分子生物学相结合而产生的一门综合性交叉学科,它可以在细胞分子水平上实现生物体生理、病理变化的实时、无创、动态、在体成像,代表了医学影像技术发展的新方向。该技术突破了传统影像技术仅能显示由细胞分子改变所引起的解剖结构变化的局限,改变了传统离体方法不能在体连续观测药物作用机理及治疗效果的局限,在分子生物学与临床医学之间架起了相互连接的桥梁。有助于从细胞分子水平认识疾病的发生、发展机理,实现特异性的在体无创检测,实现疾病的早期精确诊断,推动生命科学领域的发展。同时,也将进一步提高人口健康水平与人民生活质量。
目前适合术中成像的影像设备难觅踪影,而光学分子影像手术导航技术作为一种新兴的医学影像方法,可以辅助医生在实施肿瘤切除的过程中,精确定位肿瘤的边界。临床实验中,光学分子影像导航系统为医生实施精准手术提供了强大的帮助;总之,随着研究的不断深入、完善,将会被广泛应用于临床医学的各个领域,成为新的医疗技术、医疗设备和新的临床学科~。
[感谢:国家重点基础研究发展计划(“9 7 3”计划)(2011CB707700);国家自然科学基金(81227901, 61231004 和61501462的支持)]
10.3969/j.issn.1674-0319.2015.06.009

肿瘤是严重危害人类生命和健康的常见病和多发病,如何在早期发现肿瘤组织及如何在手术过程中实现肿瘤的精确定位成为了近年来国际上的研究热点。随着医学影像技术的不断发展,光学分子影像手术导航技术作为一种新兴的医学影像方法,有望实现手术过程中对肿瘤及其他病灶组织的边界信息的快速、准确、客观的定位,有效地提高手术的成功率,并提高患者的术后生存率。文章主要综述了光学分子影像手术导航技术方面的研究进展,以期为肿瘤的精准手术提供一种有效的方法。
