腰椎损伤疝出型椎间盘组织JNK信号通路激活情况的研究
2015-03-02李鹏飞马信龙臧加成孔敬波
李鹏飞,马信龙,王 涛,田 鹏,韩 超,臧加成,孔敬波
(1.天津医科大学总医院骨科,天津300052;2.天津市天津医院骨科研究所生物力学室,天津300211)
论著
腰椎损伤疝出型椎间盘组织JNK信号通路激活情况的研究
李鹏飞1,2,马信龙2,王 涛2,田 鹏2,韩 超2,臧加成2,孔敬波2
(1.天津医科大学总医院骨科,天津300052;2.天津市天津医院骨科研究所生物力学室,天津300211)
目的:探究c-Jun氨基末端激酶(JNK)信号通路在腰椎损伤疝出型椎间盘组织中激活情况。方法:随机选择24例行手术治疗的腰椎间盘突出症(LDH)患者,其中12例损伤疝出型和12例退变突出型,分别为损伤疝出组和退变突出组。收集术中摘除的椎间盘组织,HE染色观察髓核组织病理变化;TUNEL染色分析髓核细胞凋亡情况;免疫蛋白印迹技术检测MKK4、JNK、pJNK、JunD蛋白表达水平。结果:损伤疝出组出现炎性细胞浸润的比例、髓核细胞凋亡计数以及MKK4、JNK、pJNK、JunD蛋白表达水平高于退变突出组(P<0.05)。结论:损伤疝出型髓核组织炎症反应更明显;JNK信号通路异常激活与髓核细胞凋亡增加可能是损伤疝出型LDH病理机制之一;JNK信号通路激活可能是LDH病理分型的标志之一。
腰椎;椎间盘移位;JNK信号通路
腰椎间盘突出症(lumbar disc herniatio n,L DH)是以腰痛、坐骨神经痛等为主要临床表现的骨科常见病,其发病机制存在争议,机械压迫学说[1]、化学性神经根炎学说[2]以及自身免疫学说[3]是目前存在的3个热点学说,但其详细机制尚不明确。研究LDH的病理机制,首先应该认清LDH的分型,不同分型的LDH的病理机制不同,其手术方案亦不相同。目前公认的LDH的病理学分型是损伤疝出型和退变突出型[4-6],是基于LDH的自身免疫学说,而非解剖学分型。本课题组前期实验中采用生物芯片技术筛选出腰椎间盘突出症髓核组织microRNAs表达谱[7],其中miR-494和miR-513a-5p在损伤疝出型LDH中较退变突出型高表达,其靶基因分别是c-Jun氨基末端激酶(JNK)的上游MKK4和下游JunD,因此我们预测JNK信号通路可能调节LDH的病理过程。JNK是促分裂原活化蛋白激酶家族成员之一,研究证实细胞因子、应激、生长因子等可以激活JNK通路,调节细胞的增殖、凋亡、分化,并在许多疾病中发挥重要作用[8-10]。本试验目的是进一步验证腰椎损伤疝出型椎间盘组织JNK信号通路激活情况,探讨JNK信号通路在损伤疝出型LDH病理过程中可能的机制。
1 资料与方法
1.1 研究对象
1.1.1 纳入标准和排除标准 纳入标准:(1)根据临床表现、影像学资料(X线、CT、MRI)确诊为LDH;(2)反复发作,经过3个月保守治疗无法缓解症状,须行手术治疗;(3)根据影像学资料和术中所见纤维环的完整性将病例分为损伤疝出型和退变突出型。排除标准:(1)肿瘤、感染、自身免疫疾病等;(2)术前使用免疫抑制剂。
1.1.2 临床资料 依据上述标准随机选择2012年5月-10月天津市天津医院脊柱外科确诊并行手术治疗的LDH患者24例,分为12例损伤疝出型和12例退变突出型,分别为损伤疝出组和退变突出组。损伤疝出组男性8例,女性4例,年龄(41.83±13.55)岁,L4/L5 6例,L5/S1 6例;退变突出组男性7例,女性5例,年龄(54.17±11.36)岁,L2/L3 1例,L4/L5 7例,L5/S1 4例。收集手术摘除的间盘组织,仔细分离弃去纤维环和软骨,将获得的髓核组织装入冻存管,0℃保存并在0.5 h内送到实验室液氮保存。
损伤疝出型LDH诊断标准[6]:(1)患者以中青年为主,多存在腰部扭转暴力外伤病史,坐骨神经痛明显,直腿抬高试验阳性;(2)MRI显示病变椎间盘T2加权像呈低信号,髓核突破纤维环及后纵韧带,椎间盘突出于椎管内压迫神经根;(3)术中发现纤维环及后纵韧带破裂,髓核组织与椎间盘母体分离,质软,常自行溢出或很容易用髓核钳拉出。
退变突出型LDH诊断标准[6]:(1)患者多为老年人,有中、重体力劳动史,一般无腰部外伤史,以间歇性跛行为典型症状,亦可出现直腿抬高试验阳性;(2)MRI显示为多发腰椎间盘变性突出或膨出,以某节段为主,但纤维环及后纵韧带完整;(3)术中发现纤维环及后纵韧带完整,椎间盘质硬,切开纤维环,髓核组织也不会突出,也不容易用髓核钳拉出。
1.2 研究方法
1.2.1 主要试剂 PB S(Cwbio公司,美国),二甲苯(北京化学试剂公司,中国),无水乙醇(北京化学试剂公司,中国),改良型苏木精(Cwbio公司,美国),中性树胶(Cwbio公司,美国),TUNEL试剂盒(博士德公司,中国),DAB显色试剂盒(Cwbio公司,美国),组织蛋白抽提试剂盒(Cwbio公司,美国),BCA定量检测试剂盒(Cwbio公司,美国),SDS-PAGE凝胶制备试剂盒(Cwbio公司,美国),EeclWestern Blot Kit高灵敏度化学发光检测试剂盒(Cwbio公司,美国),Western Blot封闭液II(Cwbio公司,美国),丽春红染色试剂(Cwbio公司,美国),MKK4、JNK、p-JNK、JunD一抗(Cwbio公司,美国),β-actin鼠单克隆抗体(Cwbio公司,美国),Mar ker(Cw bio公司,美国)。
1.2.2 主要仪器 显微镜及显微成像系统(Olympus BX41,日本),液氮罐(Thermo公司,美国),石蜡组织切片机(Leica2235,德国),生物组织摊烤片机(亚光YT-6C,德国),蛋白电泳系统(Hoefer SE250,美国),蛋白转膜系统(Hoefer TE22,美国),化学发光成像系统(Fusion X7型,美国)。
1.2.3 组织学观察 组织置于4%多聚甲醛固定48h,石蜡包埋,切片机连续切片,每个样本切10张完整的片子,厚度6μm,脱蜡水化,选择5张切片进行伊红-苏木精(HE)染色,乙醇梯度脱水,二甲苯透明,中性树脂封片,晾干,显微成像系统拍照(×200)。
1.2.4 TUNEL染色分析凋亡情况 选择余下5张脱蜡水化后的石蜡切片行TUNEL染色,首先每个样本滴加50mL PBS稀释的2mg/mL的蛋白酶K溶液,37℃孵育15min,PBS洗涤(必须把蛋白酶K洗涤干净,否则会严重干扰后续的标记反应),每张片加入50μL TdT反应混合液,37℃放置2 h,PBS洗涤,封闭液封闭30min,然后滴加生物素化抗地高辛抗体(SABC),37℃孵育30min,PBS洗涤后DAB显色,苏木精复染,脱水透明,封片,晾干,显微镜观察拍照,每个样本每张片子选择10视野计数凋亡细胞,并计算平均数。
1.2.5 免疫蛋白印迹法检测JNK通路激活情况 将髓核组织置于冰上碾碎后加入哺乳动物蛋白抽提试剂并混匀,冰上孵育20min,定量检测样本蛋白浓度,SDS-PAGE凝胶电泳,将蛋白转移到0.22μm孔径的硝酸纤维素膜(NC膜),丽春红染色,Western Blot封闭液II(含5%脱脂奶粉)封闭NC膜2 h,分别加入1∶500稀释的一抗MKK4、JNK、pJNK及JunD,室温孵育1 h,4℃过夜,加入1∶10 000稀释的辣根过氧化物酶(HRP)标记的二抗,室温孵育40 min,TBST洗膜5次,每次5min,2mLECTWestern BlotKit高灵敏度化学发光检测试剂避光孵育2min后FusionX7化学发光成像系统曝光,β-actin作内参。Gel-Pro32图像分析软件计算分析条带的灰度值。
1.3 统计学处理 采用SPSS17.0软件进行数据处理,所有计量资料用±s表示,两组间比较采用独立样本t检验,计数资料组间比较采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果 HE染色发现损伤疝出组有9例发现炎性细胞浸润,而退变突出组只有2例,使用确切概率法比较两组差异性,差异具有统计学意义(P<0.05)(图1)。
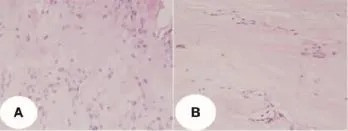
图1 两组标本HE染色(×200)Fig 1 HE-stained sam plesof two groups(x200)
2.2 TUNEL染色检测髓核细胞凋亡情况 TUNEL染色切片发现:损伤疝出组凋亡细胞计数(14.3± 2.7)明显多于退变突出组(8.3±2.6)(图2),差异具有统计学意义(P<0.05)。
2.3 Western Blot检测JNK信号通路激活情况 损伤疝出组JNK信号通路中MKK4、JNK、pJNK、JunD蛋白表达水平较退变突出组明显高表达(图3),差异具有统计学意义(P<0.05)(表1)。
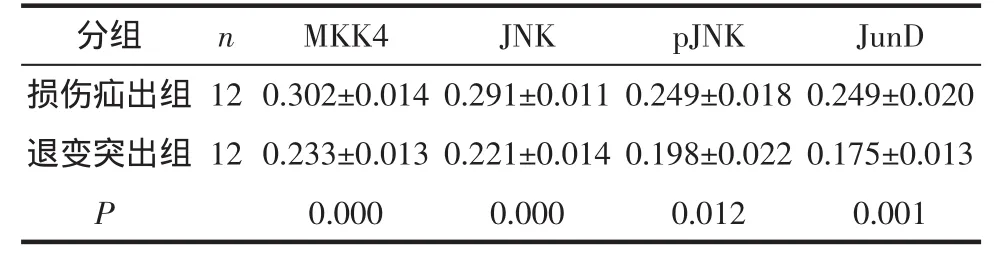
表1 两组标本JNK信号通路蛋白定量结果(OD值570mm)Tab 1 The result of protein quantify of JNK pathway signaling in two groups(OD value,570mm)
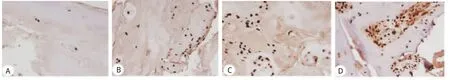
图2 两组样本TUNEL染色(×400)Fig 2 TUNEL-stained samplesof two groups(×400)
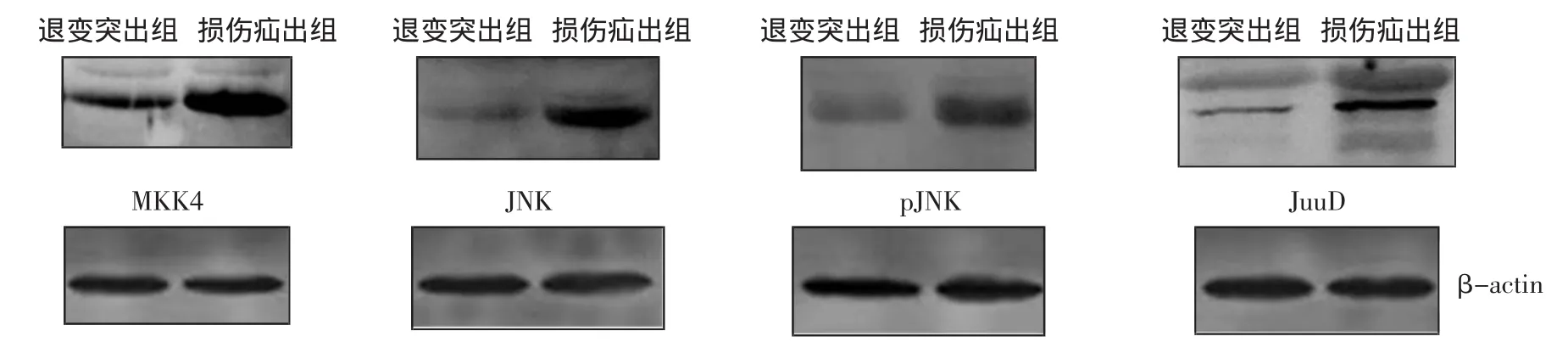
图3 两组中JNK信号通路蛋白表达水平Fig 3 Situation of expression of JNK signaling pathway proteins in two groups
3 讨论
3.1 腰椎损伤疝出型椎间盘组织炎症反应更明显 HE染色结果发现损伤疝出组髓核组织出现炎性细胞浸润的比例更高,说明炎症反应明显,然而引起炎症的原因很多,如物理、化学、生物学以及免疫学等因素,由免疫学因素介导的炎症称为免疫炎症。基于腰椎间盘的特殊解剖结构,Naylor等[3]1962年首先提出LDH的自身免疫学说,认为无血运的髓核组织是人体的“隐蔽”抗原,髓核从椎间盘中脱出接触人体血液系统可以诱发自身免疫反应,大量实验已经证实了LDH自身免疫反应的存在[11-12],但仅在损伤疝出型LDH椎间盘组织标本中发现CD4+和CD8+T淋巴细胞浸润和免疫球蛋白IgG、IgM的沉积[4-13],以及IL-1、IL-6、IL-8、IL-17等[14-16]炎症因子的高表达。本研究纳入的损伤疝出型LDH患者大都存在腰部扭转暴力外伤史,而且术中发现纤维环破裂,髓核脱出,因此推断炎症细胞的浸润可能是由于脱出的髓核引发的自身免疫反应导致的,自身免疫因素在LDH尤其是损伤疝出型LDH发病机制、病理演变以及症状产生过程中可能发挥重要作用。
3.2 JNK信号通路在损伤疝出型腰椎间盘突出症病理机制中可能的作用 本研究发现损伤疝出型椎间盘组织MKK4、JNK、pJNK及JunD蛋白表达水平以及髓核细胞凋亡数高于退变突出型。JNK信号通路作用机制复杂,生物效应多变,具有促凋亡和抗凋亡的双重作用[17],JNK可直接磷酸化Bcl促凋亡家庭成员(如Bak和Bid),介导线粒体释放促凋亡因子,从而诱导细胞凋亡[18-19],JNK还可以激活JunD,而JunD通过下游的NF-kB信号通路或PI3K/AKT信号通路促进细胞生存[20]。有文献报道[9],IL-1和NO通过激活MAPK信号通路(ERK1/2,JNK,p38)来诱导髓核细胞的凋亡。董振辉等[21]研究发现TNF-α介导JNK信号通路诱导髓核细胞凋亡。JNK信号通路的异常激活可能是损伤疝出型LDH自身免疫引发的炎症反应所致,髓核细胞凋亡增加可能与JNK信号通路的异常激活密切相关,而JunD蛋白的高表达可能是髓核细胞凋亡的保护机制,试图平衡JNK引起的凋亡,但均需进一步的细胞实验进行验证。因此,我们得出结论,JNK信号通路异常激活与髓核细胞的凋亡增加可能是损伤疝出型腰椎间盘突出症病理机制之一。
3.3 JNK信号通路的异常激活在腰椎间盘突出症病理分型中的意义 目前LDH的病理分型存在争议,大部分分型是基于突出椎间盘的形态和位置,不是真正意义的病理分型。国际腰椎研究会(ISSLS)和美国矫形外科协会(AAOS)将腰椎间盘突出症分为退变型、膨出型、突出型、后纵韧带下脱出型、后纵韧带后脱出型及游离型。MacNab[22]将其分类为:(1)突出,包括局限型和广泛型;(2)疝出,包括脱垂、脱出和游离型。该分类可以认为概括了LDH的两种病理类型。Spengler[23]分类:突起型、突出型、游离型。周秉文等[24]分类:突起型、破裂型、游离型。张义修[25]按照椎间盘突出的病理学实质,将其分为3类:椎间盘损伤疝出型、椎间盘退行性膨出、椎体后缘骨软骨病。本研究发现损伤疝出型LDH椎间盘组织JNK信号通路激活情况明显高于退变突出型,进一步说明损伤疝出型和退变突出型LDH是两种不同的病理变化,有希望成为LDH病理分型的标志物。
综上所述,JNK信号通路异常激活与髓核细胞凋亡增加可能是损伤疝出型腰椎间盘突出症病理机制之一,针对JNK信号通路的靶向生物治疗意义重大。另一方面有望鉴别LDH病理分型,指导LDH的手术方案。本研究也存在不足之处,纳入样本偏少,需要加大样本进行验证,并进一步在细胞水平上深入研究。
[1] Takahashi K,Shima I,Porter RW.Nerve root pressure in lumbar disc herniation[J].Spine(Phila Pa1976),1999,24(19):2003
[2] Ohtori S,Inoue G,Eguchi Y,et al.Tumor necrosis factor-αimmunoreactive cells in nucleus pulposus in adolescent patients with lumbar disc herniation[J].Spine(Phila Pa 1976),2013,38(6):459
[3] Naylor A.The biophysical and biochemical aspectsof intervertebral disc herniation and degeneration:arrisand gale lecture delivered at the royal college of surgeons of England on 30th January 1962[J]. Ann RCollSurg Engl,1962,31(2):91
[4] 马信龙,徐云强,张义修,等.腰椎间盘突出症自身免疫因素的研究[J].中国现代神经疾病杂志,2004,4(5):291
[5]田伟,崔冠宇,赵丹慧,等.腰椎间盘突出症患者IgM和IgG与其症状和体征相关性研究[J].中华骨科杂志,2008,28(4):288
[6]王涛,马信龙,张晓林,等.腰椎损伤疝出型和退变突出型椎间盘组织白细胞介素17表达与Modic改变的关系[J].中华骨科杂志,2012,32(4):356
[7] 王涛,马信龙,张晓林,等.人退变腰椎间盘差异性表达microRNA的筛选及JNK通路参与椎间盘退变的探讨[J].中华骨科杂志,2013,33(7):770
[8] Weston C R,Davis R J.The JNK signal transduction pathway[J]. CurrOpin CellBiol,2007,19(2):142
[9] Niu C C,Lin S S,Yuan L J,et al.Hyperbaric Oxygen treatment suppressesMAPK signalingandmitochondrialapoptotic pathway in degenerated human intervertebral disc cells[J].JOrthop Res,2013, 31(2):204
[10]Wuertz K,Vo N,Kletsas D,et al.Inflammatory and catabolic signalling in intervertebral discs:the roles of NF-κB and MAP kinases[J].EurCellMater,2012,23:103
[11] Mihn D C,Kim T Y.Presence of various autoantibodies demonstrated by autoimmune target test in the sera of patientswith degenerated and herniated intervertebraldisc:commenton the articleby Shamjietal[J].ArthritisRheum,2011,63(3):862
[12]DiMartino A,Merlini L,FaldiniC.Autoimmunity in intervertebral disc herniation:from bench tobedside[J].ExpertOpin Ther Targets, 2013,17(12):1461
[13]李晖,马信龙,王沛,等.腰椎间盘突出症的免疫病理学研究[J].中华骨科杂志,2007,27(5):359
[14]Andrade P,Hoogland G,GarciaM A,etal.Elevated IL-1βand IL-6 levels in lumbar herniated discs in patients with sciatic pain[J]. Eur Spine J,2013,22(4):714
[15]KraycheteDC,Sakata RK,Issy AM,etal.Serum cytokine levels in patientswith chronic low back pain due toherniated disc:analytical cross-sectional study[J].Sao Paulo Medical Journal,2010,128(5):259
[16]Cheng L,Fan W,Liu B,etal.Th17 lymphocyte levels are higher in patients with ruptured than non-ruptured lumbar discs,and are correlated with pain intensity[J].Injury,2013,44(12):1805
[17]Jing LU,Anning L.Role of JNK activation in apoptosis:a doubleedged sword[J].CellRes,2005,15(1):36
[18]侯炳旭,冯丽英.JNK信号通路在慢性乙型肝炎患者外周血单个核细胞中的活化[J].世界华人消化杂志,2011,19(29):3075
[19]Zhu X,Wang K,Zhang K,et al.Ziyuglycoside IIinduces cell cycle arrestand apoptosis through activation of ROS/JNK pathway in human breastcancer cells[J].Toxicol Lett,2014,227(1):65
[20]Lamb JA,Ventura JJ,Hess P,etal.JunDmediatessurvivalsignaling by the JNK signal transduction pathway[J].Mol Cell,2003,11 (6):1479
[21]董振辉,王德春.肿瘤坏死因子α诱导人髓核细胞凋亡的作用途径[J].中国组织工程研究与临床康复,2010,14(50):9321
[22]MacNab I.Backache[M].2nd ed.Baltimore:Williams and Wikins, 1977:34-35
[23]Spengler D M.Lumbar discectomy.Resultswith limited disc excision and selective foraminotomy[J].Spine(Phila Pa 1976),1983,7 (6):604
[24]周秉文,胡有谷,孙进修,等.腰椎间盘突出症的分型和手术商榷[J].中华骨科杂志,1988,18(8):366
[25]张义修.椎间盘突出的病理学诊断[Z].天津医科大学总医院,2001:68-69
(2014-07-14收稿)
JNK signaling pathway in disc tissueof injury-extrusion typeof lumbar disc herniation
LIPeng-fei1,2,MA Xin-long2,WANGTao2,TIANPeng2,HANChao2,ZANG Jia-cheng2,KONG Jing-bo2
(1.D epartment of Orthopaedics,General Hospital,Tianjin Medical University,Tianjin 300052,China;2.Biomechanics laboratory of Orthopaedic Research Institute of Tianjin Hospital,Tianjin 300211,Chin a)
Objective:To investigate the function ofc-Jun N-terminalkinase(JNK)signaling pathway in disc tissueof injury-extrusion typeoflumbardischerniation(LDH).Methods:Twenty fourcaseswith LDHwere randomly chosen,ofwhich 12 caseswere injury-extrusion type(injury-extrusiongroup)and 12 casesweredegeneration-protrusion type(degeneration-protrusion group).Disc tissuewascollected duringoperation,and thepathologicalchangesofnucleuspulposustissuewith HEstainingwereobserved;theapoptosisofnucleuspulposus cellswith TUNEL stainingwere analyzed;the expression levelsofMKK4,JNK,pJNK,JunD protein withWestern blottingwere detected.Results:The proportion of inflammatory cells infiltration,the countofnucleuspulposuscellsapoptosisand theexpression levelsofMKK4, JNK,pJNK,JunD protein of injury-extrusion group were significantly higher than degeneration-protrusion group(P<0.05).Conclusion:Local inflammation ofnucleuspulposus tissue for injury-extrusion group ismore significant;Abnormalactivation of JNK signaling pathway and increaseofnucleuspulposuscellsapoptosismay be the pathologicalmechanism for injury-extrusion typeof LDH;Abnormalactivation of JNK signaling pathwaymaybeamarker forpathologicalclassification of LDH.
lumbar vertebrae;intervertebraldisk displacement;JNK signaling pathway
R681.5+3
A
1006-8147(2015)01-0035-04
天津市科技支撑重点项目(13ZCZDSY01700)
李鹏飞(1987-),男,硕士在读,研究方向:脊柱外科;通信作者:马信龙,E-mail:m axin long86@163.com。
