兔角膜碱烧伤制作人工角膜植入适应证模型的实验研究
2015-03-01白华王宗华王丽强黄一飞
白华 王宗华 王丽强 黄一飞
·基础研究·
兔角膜碱烧伤制作人工角膜植入适应证模型的实验研究
白华 王宗华 王丽强*黄一飞*
目的 评估以兔角膜碱烧伤实验作为人工角膜植入适应证模型的效果。方法 使用直径为12 mm圆滤纸片蘸取浓度为1 mol/L的氢氧化钠(NaOH),贴于新西兰兔(10只)角膜正中40 s,3个月后,进行临床、光学和电子显微镜检查。结果 所有兔角膜形成带有新生血管的角膜白斑,与临床人工角膜患者相比,具有相似病理学特点,即角膜明显增厚,呈不规则复层鳞状上皮,基质胶原排列紊乱,原有结构消失,基质层瘢痕化,充满大量新生血管及炎细胞。扫描电子显微镜下可见,角膜上皮呈复层鳞状上皮,基质浅层可见炎细胞明显,大量纤维母细胞排列。结论 用兔角膜碱烧伤可以模拟人工角膜植入的适应证,并进行与其相关的研究。(中国眼耳鼻喉科杂志,2015,15:324-326, 330)
人工角膜;角膜碱烧伤;化学伤;人工角膜移植
人工角膜的适应证包括角膜移植排斥的高危病例、多次移植失败、严重的新生血管和严重的干眼[1]。在实际临床中,这些患者往往具有共同的病理学特点[2-3]:①高度角化的角膜上皮;②严重角膜新生血管;③眼表泪液分泌异常。因此,对人工角膜进行的一系列研究需要一个动物模型作为基础。而且,目前植入人工角膜的患者中,角膜化学伤占很大比例,其眼表状况基本具备这些病理学特点。因此,我们尝试用兔角膜碱烧伤的方法模拟临床人工角膜的适应证来进行动物模型制作,并与临床上的人工角膜患者置换下来的角膜病理做对比,现将实验结果报告如下。
1 材料与方法
1.1 实验动物 新西兰白兔(中国人民解放军总医院实验动物中心提供)10只,体重2~2.5 kg,雌雄各半。右眼为实验眼。
1.2 方法 模型制作:在1%丁卡因表面麻醉下置开睑器,用直径为12 mm的圆形滤纸片蘸取氢氧化钠(NaOH)溶液(1 mol/L),贴于兔角膜正中;40 s后,用生理盐水迅速冲洗5 min,氧氟沙星眼膏和1%阿托品眼膏涂结膜囊。均以右眼为实验眼。术后10 d内每日涂氧氟沙星眼膏,并进行临床观察。直至碱烧伤后3个月,角膜形成稳定角膜白斑和全象限新生血管。
临床大体观察:主要从以下几个方面加以观察,包括结膜囊炎症反应、角膜水肿程度、新生血管范围及有无相关并发症。
组织病理学观察:分别于碱烧伤后12周处死动物,取材后角膜正中切开,一半用4%多聚甲醛固定行光学显微镜检查,另一半用2.5%戊二醛固定行电子显微镜检查。
1)苏木素-伊红(hematoxylin eosin, HE)染色。石蜡包埋,5 μm切片,常规HE染色。
2)天狼猩红染色。石蜡切片脱蜡至水,苦味酸天狼猩红染液在室温浸染1 h。流水冲洗,苏木素复染细胞核1 min。95%~100%乙醇脱水,二甲苯透明,树胶封固。结果判断:采用苦味酸天狼猩红染液染色,使用偏振光学显微镜观察结果,可以在同一张切片上同时清晰显示Ⅰ、Ⅲ型胶原纤维及其相互间的关系。粗大明亮红、黄色纤维为Ⅰ型胶原纤维,纤细的绿色纤维为Ⅲ型胶原纤维。
3)Masson三色染色。石蜡切片3~4 μm脱蜡至水;Harris苏木素染3 min流水冲洗,1%的盐酸乙醇分化3~5 s流水冲洗,温水返蓝1 min流水冲洗;丽春红酸性品红加温染3 min,蒸馏水冲洗,1%磷钼酸分化1 min,不洗,擦净载玻片上的磷钼酸残液;2%苯胺蓝复染1 min,95%乙醇冲洗,95%乙醇及无水乙醇脱水,冷风吹干,中性树胶封片。
4)透射电子显微镜。样品经2%戊二醛内固定。逐级脱水后,Epon812环氧树脂浸润、包埋。制备2 μm厚的半薄切片,光学显微镜下定位,制备厚度为50 nm的超薄切片(矢状位切片)。方法详见文献[1]。
2 结果
兔角膜碱烧伤后3个月,所有动物形成了稳定的角膜白斑和全象限新生血管(图1)。
2.1 临床观察 术后3~5 d,流泪等刺激症状较明显,角膜水肿明显;平均1.5个月后眼前节炎症完全消失,形成全象限的新生血管及角膜白斑。无角膜穿孔等严重并发症。
2.2 组织病理学观察
1)HE染色。角膜失去原有规律排列的结构,变为复层移行明显的上皮细胞层,并且可见大量新生血管;角膜基质可见大量炎细胞及新生血管,原有排列整齐的胶原消失,由瘢痕性组织替代(图2)。
2)苦味酸天狼猩红染色。 偏振光下,显示角膜基质层胶原多由Ⅲ 型逐渐过渡为成熟、鲜红色的 Ⅰ 型胶原(图3)。
3)Masson三色染色结果。角膜基质由原有的胶原组织(蓝色)变为非胶原组织(红色),炎细胞和新生血管明显(图4)。
4)透射电子显微镜。结果与光学显微镜结果一致,即:复层上皮细胞,基质层大量炎细胞及纤维母细胞,胶原排列紊乱。
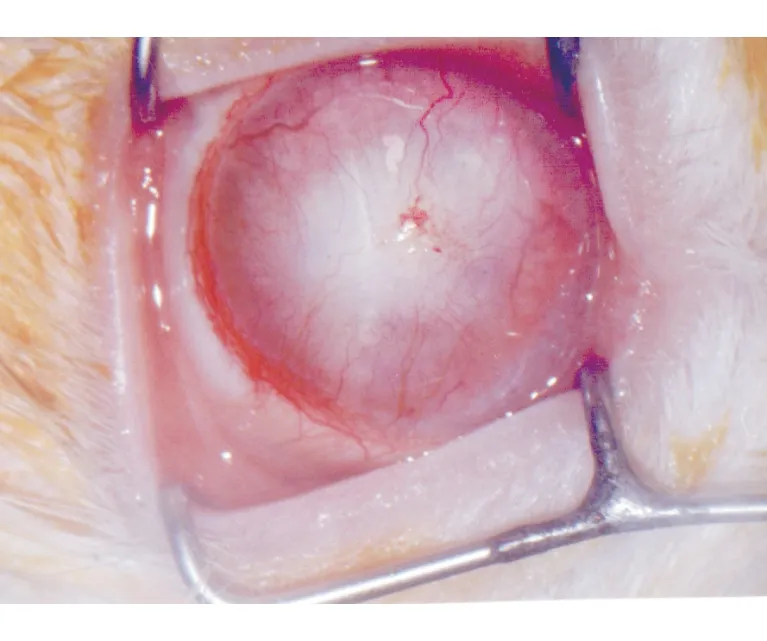
图1. 兔角膜碱烧伤动物模型:角膜白斑形成,全象限新生血管

图2. 角膜上皮复层鳞状上皮形成(箭头), 角膜基质可见大量炎细胞及新生血管,原有排列整齐的胶原消失,被瘢痕性组织替代(×40,HE染色)
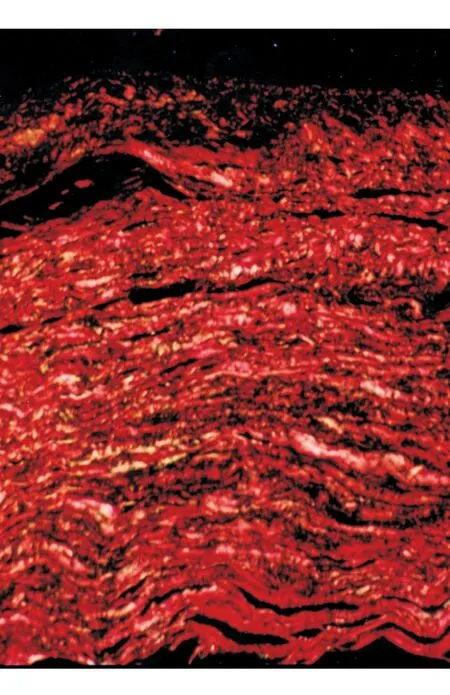
图3. 偏振光下显示,角膜基质层胶原多由Ⅲ型逐渐过渡为成熟、鲜红色的Ⅰ型胶原(×200,苦味酸天狼猩红染色)

图4. 角膜基质由原有的胶原组织(蓝色)变为非胶原组织(红色),炎细胞和新生血管明显(×100,Masson三色染色)
3 讨论
目前,人工角膜的研究[3-6]多围绕人工材料的相容性、并发症的改进、表面的改性等方面进行。很多实验是在体外[6-7]研究或正常动物角膜内[8-9]进行,评估其结果。但是由于人工角膜临床应用于非正常角膜患者,因此寻找一种合适的动物模型是展开人工角膜研究的必要基础。在以往的实验中,我们以兔角膜碱烧伤植入人工角膜来评估其结果[10],实验中的参数生成的新生血管面积不够,因此增加了滤纸片的直径,浓度不变,使其角膜缘受损程度加大,制作更符合临床情况的人工角膜适应证动物模型。
为了更好地对比,参考临床2例人工角膜植入术后患者的角膜病理[11]。患者1为化学伤(强碱)后角膜全象限新生血管,中央角膜白斑,予波士顿人工角膜Ⅰ型移植术(术者是中国人民解放军总医院黄一飞教授),随访半年,术后视力0.4(图5)。患者2为反复角膜炎后角膜全象限新生血管,予波士顿人工角膜Ⅰ型移植术(术者为中国人民解放军总医院黄一飞教授,随访半年,术后视力0.3(图6)。
与人的角膜病理相比,碱烧伤后的兔角膜具有类似的病理特点:复层鳞状上皮的角膜、基质层瘢痕、角膜新生血管化。但是,模型的不足之处是,对于严重干眼、自身免疫性疾病患者,只能模拟其角膜的新生血管及轻度的泪液异常;对于伴有严重瘢痕血管化结膜,上下眼睑瘢痕高度挛缩、睑闭合不全的患者,需要摸索新的浓度或滤片停留时间。
我们可以得出初步结论:兔角膜碱烧伤可以较好地模拟人工角膜植入的适应证,以便进行与其相关的研究。
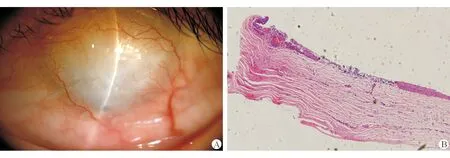
图5. A.患者1,角膜碱烧伤后全象限角膜新生血管;B.患者1,角膜上皮复层鳞状上皮,角膜全层可见大量炎细胞及新生血管,原有排列整齐的胶原消失(×40,HE染色)

图6. A. 患者2,反复角膜炎,角膜全象限新生血管;B. 患者2,角膜上皮复层鳞状上皮化,角膜基质可见大量炎细胞及新生血管,原有排列整齐的胶原消失被瘢痕性组织替代(×40,HE染色)
[ 1 ] Dohlman CH, Schneider HA, Doane MG. Prosthokeratoplasty[J]. Am J Ophthalmol, 1974, 77(5):694-700.
[ 2 ] Gomaa A, Comyn O, Liu C. Keratoprosthesis in clinical practice - a review[J]. Clin Experiment Ophthalmol, 2010,38(2):211-224.
[ 3 ] Bradley JC, Hernandez EG, Schawb IR, et al. Boston type 1 keratoprosthesis: the University of California Davis experience[J]. Cornea, 2009,28(3):321-327.
[ 4 ] Magalhães FP, Sousa LB, Oliveira LA. Boston type I keratoprosthesis: review[J]. Arq Bras Oftalmol, 2012 ,75(3):218-222.
[ 5 ] Patel S, Takusagawa H, Shen L, et al. Long-term complications associated with glaucoma drainage devices and Boston keratoprosthesis [J]. Am J Ophthalmol, 2012 ,154(1):207-208.
[ 6 ] Tan XW, Lakshminarayanan R, Liu SP, et al. Dual functionalization of titanium with vascular endothelial growth factor and β-defensin analog for potential application in keratoprosthesis[J]. J Biomed Mater Res B Appl Biomater, 2012, 100(8):2090-2100.
[ 7 ] Tan XW, Riau A, Shi ZL, et al.Invitroeffect of a corrosive hostile ocular surface on candidate biomaterials for keratoprosthesis skirt [J]. Br J Ophthalmol, 2012,96(9):1252-1258.
[ 8 ] Hicks CR, Chirila TV, Clayton AB. Clinical results of implantation of the Chirila keratoprosthesis in rabbits[J]. Br J Ophthalmol, 1998,82(1):18-25.
[ 9 ] Todani A, Behlau I, Fava MA, et al. Intraocular pressure measurement by radio wave telemetry[J]. Invest Ophthalmol Vis Sci, 2011,52(13): 9573-9580.
[10] 白华,高峰,黄一飞,等.新型PHEMA一体式人工角膜植入碱烧伤兔角膜的实验研究[J].解放军医学杂志,2003,28(12):1082-1083.
[11] Kiang L, Rosenblatt MI, Sartaj R, et al . Surface epithelialization of the type I Boston keratoprosthesis front plate: immunohistochemical and high-definition optical coherence tomography characterization[J]. Graefes Arch Clin Exp Ophthalmol, 2012,250(8):1195-1199.
(本文编辑 诸静英)
Study of alkali burned rabbit cornea as animal model of indications related to keratoprosthesis implantation
BaiHua*,WANGZong-hua,WANGLi-qiang,HUANGYi-fei*.
DepartmentofOphthalmology,BeijingCommandMilitaryGeneralHospitalofPeople’sLiberationArmy,Beijing100700,China
HUANG Yi-fei, Email: 301yk@sina.com
Objective To evaluate feasibility of alkali burned rabbit corneas as animal model of keratoprosthesis implantation. Methods New Zealand rabbits corneas(n=10) were burned with a 12 mm diameter round cornea filter paper dipped in 1 mol/L NaOH for 40 s. The corneas were examined through slit lamp, light microscope and electron microscopy three months later. Results Neovascularization and leukoma were formed in all animal corneas after three months. The pathological findings were consistent with clinical characteristics of patients that had thickening cornea, stratified squamous epithelium corneal stroma scars, neovasculars and inflammatory cells. Conclusions The animal model with corneal alkali burns could be used for implant indications research of keratoprosthesis.(Chin J Ophthalmol and Otorhinolaryngol,2015,15:324-326, 330)
Keratoprosthesis; Alkali burned cornea; Chemical injury; Kerotopnsthesis implantation
中国人民解放军北京军区总医院眼科 北京 100700;*中国人民解放军总医院眼科 北京 100853
通迅作者:黄一飞(Email:301yk@sina.com)
10.14166/j.issn.1671-2420.2015.05.006
2014-02-13)
