植物叶蜡正构烷烃分子分布特征与植被类型的关系
2015-02-28刘卫国
刘 虎,刘卫国
doi:10.7515/JEE201503005
植物叶蜡正构烷烃分子分布特征与植被类型的关系
刘 虎1,2,刘卫国1
(1.中国科学院地球环境研究所 黄土与第四纪地质国家重点实验室,西安 710061;2.中国科学院大学,北京 100049)
正构烷烃是自然界中广泛分布的生物标志化合物,其链长及主峰碳常被用来指示古气候和古植被变化。我们测定了贡嘎山、太白山和黄土高原地区65个植物样品叶蜡正构烷烃的分子分布特征,并对1232个木本和草本植物(包括本实验的65个样品)的正构烷烃比值进行统计。研究表明:木本和草本植物正构烷烃中C29和C31含量基本均较高,其相对丰度变化很大,其中木本植物主峰碳为C27或C29的占61.9%,草本植物主峰碳为C31的占65.2%。三元相图分析也表明,木本和草本植物C27、C29和C31的相对丰度重叠部分较大,而以C27、C29和C31为标准对木本和草本植物进行判别分析的准确度为69.5%。研究结果表明C27、C29和C31主峰碳丰度不能作为区分木本和草本植物的有效指标。同样,利用C31/C29或C31/C27也不能够区分木本和草本植物。我们发现以C33/(C33+C29)=0.30为标准对木本和草本植物进行判别分析的准确度为81.5%,而以C33/ (C33+C27)=0.20为标准对灌木和草本植物进行判别分析的准确度为85.7%,表明某些正构烷烃比值可能具有区分木本和草本植物的潜力,但结合1232个木本和草本植物数据统计发现,正构烷烃比值不能有效区分木本和草本植物。因此,应谨慎利用正构烷烃主峰碳及比值进行植被恢复,这可能为古气候和古植被重建提供必要的参考。
植物叶蜡;正构烷烃;植被类型;碳链长度;主峰碳
植物叶蜡在植物叶表皮合成,由一系列长链有机化合物组成,包括正构烷烃、醇、醛、酯类和脂肪酸等(Jenks and Ashworth,1999),其主要作用是减少叶蜡表皮失水,保持叶面温度和湿度,抵御病原体和昆虫攻击(Richardson et al,2005;Shepherd et al,2006)。其中,正构烷烃是分子结构最简单的生物标志化合物,通过长链脂肪酸脱羰基作用合成(Kunst and Samuels,2003),对气候、环境变化较敏感(Xie et al,2000;Huang et al,2001;Ratnayake et al,2006;Sachse et al,2006;张杰和贾国东,2009),具有化合物稳定、保存时限长、分布广、提取和分析简单等特点(Sachse et al,2006)。长链正构烷烃分子组合特征是经典的有机地球化学指标,如主峰碳数Cmax、奇偶优势指数OEP(Odd Even Predom inance)、碳优势指数CPI(Carbon Predom inance Index)和平均碳链长度ACL(Average Chain Length)等(Cranwell,1973;Cranwell et al,1987;Simoneit et al,1991;Rommerskirchen et al,2003),可用来指示有机质来源及演化(Cranwell,1973;Meyers,2003;Pancost and Boot,2004)、古气候和古环境变化(Cranwell et al,1987;Ohkouchi et al,1997;Pancost and Boot,2004)等。
正构烷烃的主峰碳分布特征可用来判断木本、草本植物的输入,前人有机地球化学研究结果表明:木本植物的正构烷烃主要以C27或C29为主峰,而草本植物的正构烷烃主要以C31为主峰(Cranwell,1973;Cranwell et al,1987;Meyers and Ishiwatari,1993)。Bojović et al(2012)通过对塞尔维亚195个黑松样品进行分析,发现其正构烷烃分布存在明显的多样性,表明正构烷烃可以作为有效的植物分类学指标。Nikolic et al(2013)也提出正构烷烃分布特征可以用于植物分类。Maffei(1996a,1996b)通过对伞形科、十字花科和豆科及禾本科的研究认为正构烷烃分布特征作为植物分类指标是有效的。
然而,一些结果也显示正构烷烃分布特征变化的意义不能简单地做出解释(Dodd and A fzal-Ra f i,2000;Bush and McInerney,2013),也即其分布特征是否具有植物分类学意义存在争议。饶志国等(2011)对近来国内外报道的总共334 种现代植物长链正构烷烃分子主峰碳数进行统计表明,207 种现代草本植物中,124种植物正构烷烃以C31为主峰,101 种木本植物中,以C31和C29为主峰的分别为35和31种。Bush and McInerney(2013)对芝加哥地区24种38株植物进行采样分析,并对目前报道的2093种现代植物正构烷烃数据进行统计,发现草本和木本植物正构烷烃中C29和C31含量相对丰度变化很大,依靠C27、C29和C31鉴别草本和木本植物的准确度为58%。Vogts et al(2009)通过对非洲热带雨林和草原的研究,发现木本和草本植物正构烷烃分布特征差别很小。Carr et al(2014)在南非地区的研究也发现,一些木本和草本植物的正构烷烃分布相互重叠,很难区分。
此外,正构烷烃C31/C29、C31/(C31+C29)等比值变化用于反映陆源高等植物类型(木本和草本植物)输入的变化:比值增加,木本向草本植物植物演化;比值减小,草本向木本植物植物过渡(Cranwell,1973,1984)。Schwark et al(2002)用C31/C29比值估计湖泊沉积物中木本和草本植物的贡献。Schefuss et al(2003)和Rommerskirchen et al(2003)用C31/(C31+C29)比值对非洲南部植物类型转换进行了分析。Zhang et al(2006)也根据C31/(C31+C29)分析了中国黄土高原旬邑和洛川地区植被类型的变化。但正构烷烃比值能否作为古气候重建指标一直在讨论,而且缺乏大量的统计数据表明正构烷烃比值能作为区分木本和草本植物的有效指标。
同时一些研究表明现代植物的正构烷烃分布可能不仅受植被类型的影响,对环境条件变化也十分敏感。温度、降雨、海拔等可能影响植物叶蜡正构烷烃的组成(Guo et al,2014),不同环境条件下的植物会通过改变正构烷烃的链长来适应自然环境的变化(Dodd and Poveda,2003),且不同植物叶蜡正构烷烃的分布对相同环境条件变化的响应也不同(Guo et al,2014)。Sachse et al(2006)对欧洲南北大梯度阔叶树叶子的研究认为植物叶蜡在温暖干燥环境比寒冷潮湿环境合成更长链的正构烷烃。Dodd and A fzal-Ra f i(2000)对柏科植物研究表明植物正构烷烃分子组成与环境条件密切相关。Li et al(2013)研究表明不同的环境条件及其相关的植物生理作用的差别可能导致植物正构烷烃种内分布变化较大。因此,虽然长链正构烷烃对重建古气候和古植被具有巨大潜力,但在将其作为古气候和古植被指标之前仍需要进一步认识现代植物正构烷烃种间及种内的变化特征。
本研究通过对贡嘎山、太白山和黄土高原地区所采集的65个植物样品(包括37个乔木、5个灌木和23个草本植物)的正构烷烃组分进行测定,并对目前发表的1232个木本和草本数据(包含本研究的65个木本和草本数据)进行统计,以研究植物叶蜡正构烷烃主峰碳及比值与植被类型的关系,为重建古气候和古植被提供现代过程证据。
1 材料与方法
1.1 研究地点与采样
黄土高原(33°43' ~ 40°16'N,100°45' ~114°33'E)地势西北高东南低,具有大陆性气候特征,从东南向西北,依次为湿润半湿润暖温带、半湿润半干旱温带及干旱半干旱温带气候区。气候较干旱,降水稀少,气温和降水均由东南向西北递减,年平均气温2.2 ~15℃,年降水量150 ~700 mm。黄土高原主体由塬、梁、峁及其间的沟壑组成,分布在河南、内蒙古、山西、陕西、甘肃、宁夏、青海7个省区。本研究在黄土高原地区采集的植物样品分别来自泾川、靖边、安塞、延安、甘泉、洛川、宜君、蓝田、榆林和横山县,共采集5个灌木样品及23个草本样品。
太白山(33°49'~34°08'N,107°41'~107°52'E)位于陕西省境内,跨眉县、太白县和周至县三县,年均温 1~5℃,是暖温带第一高峰,最高海拔3767 m,年降水量约为1000 mm。太白山植被类型呈规律的垂直地带性变化,海拔500~3800 m,从暖温带过渡到亚寒带(Liu et al,2013)。本研究在太白山采集的植物样品海拔高度分布在682~3217 m,共采集9个乔木样品。
四川贡嘎山(29°20'~30°00'N,101°30'~102°10'E)地处青藏高原的东缘,在四川盆地向青藏高原过渡带大雪山的中段,境内海拔6000 m以上的山峰有45座,主峰海拔7556 m。气候上,贡嘎山位于我国东部季风区亚热带与青藏高原高寒区温带的过渡带上,山体两侧气候差异明显,具有鲜明的垂直地带性。本研究在贡嘎山采集的植物样品海拔高度分布在511~3527 m,主要包括阔叶林带、针阔混交林带及针叶林带,共采集28个乔木样品。
1.2 样品处理与测定
所有样品在40℃烘箱内烘干,取0.5 g样品放入50 m L试管,加入二氯甲烷在30℃、60 Hz的条件下进行超声萃取,每次萃取时间30 m in,萃取3次,合并萃取液离心后获取上清液,将上清液在N2下吹干,用正己烷提取3次并转入层析柱(100~200目),用4 m L正己烷淋洗硅胶柱提取正构烷烃。整个实验过程严格防止污染(所有使用试剂均为进口高效色谱级,层析硅胶活化24 h 后使用,玻璃器皿均利用马弗炉450℃高温灼烧4 h后使用,除去可能对正构烷烃成分有影响的有机组分)。过柱后的正构烷烃组分在N2下吹干,然后将正构烷烃用正己烷转移到内插管,用甲苯定容到50 μL或100 μL,震荡均匀后进行气相色谱(GC)分析。为保证试验流程的质量,每组样品附加一个空白试验,同时每测5个样品加一个标准对比,空白试验中未发现文中所讨论的有机组分。
气相色谱分析在Agilent 6890A 气相色谱仪(美国Agilent公司)上进行,色谱柱为HP-PLOT Q 毛细管柱(30 m×0.32 mm)。氦气作为载气,流量1.3 m L·m in-1,分流比为4:1,汽化室温度310℃,进样量1~2 μL,火焰离子检测器(FID)检测。升温程序为:初始温度40℃下保留1 m in,然后以10℃·m in-1升温至150℃,再以6℃·min-1升温至315℃,恒温20 min。在完全相同的条件下对标准物质 STD(由C21,C25,C27,C29,C31,C33混合而成)进行 GC 分析,通过对样品和标准物质保留时间的对比来确定样品的烷烃碳数,然后对不同碳数峰面积采用自动积分来确定不同碳数正构烷烃的相对丰度。实验前处理和仪器测试在中国科学院地球环境研究所稳定同位素地球化学研究室进行。

图1 采样点地理分布图Fig.1 Geographical distribution of sampling points
碳优势指数CPI和平均碳链长度ACL按照文献Bush and M cInerney(2013)计算:
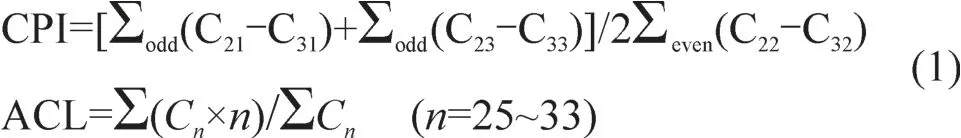
2 结果与讨论
2.1 正构烷烃主峰碳、CPI和ACL分析
对贡嘎山、太白山和黄土高原地区65个现代植物(乔木、灌木和草本)样品的叶蜡正构烷烃组分测定,分析不同植被类型正构烷烃的分子分布特征。结果表明:42个木本样品(37个乔木和5个灌木样品)中26个样品主峰碳为C27或C29,占61.9%,12个样品主峰碳为C31,占28.6%,其中,21个乔木样品主峰碳为C27或C29,占56.8%,而灌木样品主峰碳全部为C27或C29;23个草本样品中15个样品主峰碳为C31,占65.2%,C29(21.7%)次之(图2)。
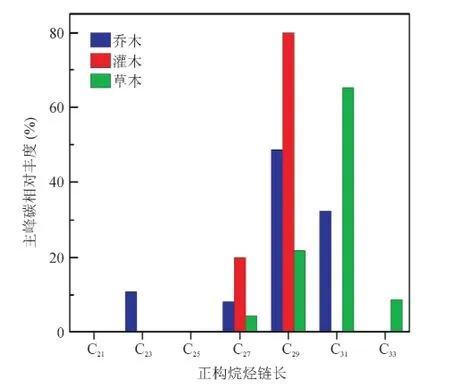
图2 木本和草本植物正构烷烃主峰碳相对丰度Fig.2 Dom inant carbon abundance of n-alkanes in woody plants and grasses
在古气候和古植被重建时,由于CPI是表征偶碳数分子与奇碳数分子相对变化的一个有机地球化学指标,常被作为有效指标指示古气候与古植被变化。通常认为CPI >1.0表示奇偶优势明显,CPI<1.0表示偶奇优势明显(Kuhn et al,2010),目前研究表明陆生高等植物中正构烷烃具有明显的奇偶优势(Duan and Ma,2001),即正构烷烃奇碳数丰度高于相邻偶碳数丰度,因此,正构烷烃CPI值被认为可以指示沉积物有机质是否来源于陆地高等植物(Simoneit et al,1991;Duan,2000)。
本研究所有植物样品正构烷烃均表现出明显的奇偶优势,木本样品正构烷烃CPI值分布在1.4~55.6,平均值为12.4,81.0%的样品CPI值大于5.0,其中乔木植物正构烷烃CPI值分布在1.4~55.6,平均值为12.4,78.4%的样品CPI值大于5.0,而灌木植物正构烷烃CPI值分布在9.9~19.1,平均值为12.4,所有样品CPI值均大于5.0;草本样品正构烷烃CPI值分布在3.5~17.0,平均值为11.6,所有样品CPI值大于2.0,95.7%的样品CPI值大于5.0(图3 A)。这与现代植物正构烷烃CPI 值一般大于5(Cranwell,1984)的观点基本一致,但也表明并不是所有的植物叶蜡正构烷烃CPI均大于5。
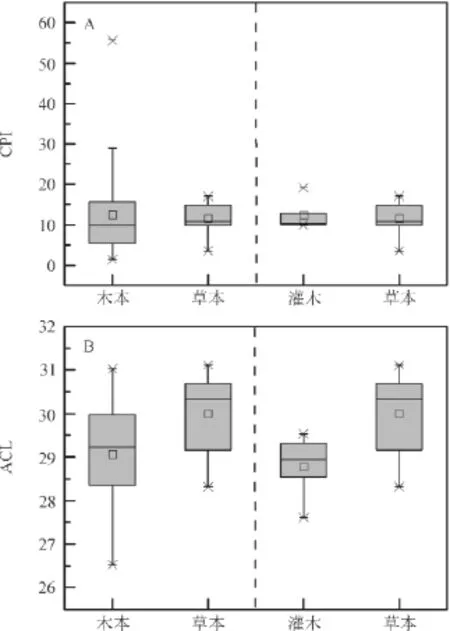
图3 木本和草本植物正构烷烃CPI和ACLFig.3 CPI and ACL of n-alkanes in woody plants and grasses
除了CPI,另外一个较为普遍用来表征正构烷烃分子分布特征的参数是ACL。已有的研究认为,植物中正构烷烃ACL值与植物的生态类型及其生长地区环境有关(Cranwell,1973;Cranwell et al,1987;Rommerskirchen et al,2003)。由图3B可知,本次测定的木本植物ACL分布范围为26.5~31.0,平均值为29.1,其中乔木植物ACL分布范围为26.5~31.0,平均值为29.1,与Bush and McInerney(2013)乔木ACL范围(26.8~31.9)基本一致;灌木植物ACL分布范围为27.6~29.5,平均值为28.8,略低于Vogts et al(2009)灌木ACL范围(28.9~30.6),但与Feakins and Sessions(2010)灌木ACL值分布范围(27.0~30.2)基本一致;草本的ACL平均值较高,其值为30.0,分布范围是28.3~31.1,与Rommerskirchen et al(2006)草本植物ACL值分布范围(28.9~32.2)基本一致。
2.2 正构烷烃比值分析
正构烷烃C31/C29和C31/C27比值通常用来反映生态系统中木本和草本植物的相对丰度,但对不同植被类型而言,C31/C27和C31/C29值变化较大(图4A和图4B),因此采用由此演化的C31/(C31+C27)、C31/(C31+C29)、C33/(C33+C27)和C33/(C33+C29)比值对木本和草本进行分析(图4C-F)。
木本和草本植物的C31/(C31+C27)、C31/(C31+C29)和C33/(C33+C27)比值变化范围均较大,且其数值重叠部分较大(图4C~E),C33/(C33+C29)比值虽然也有较大的变化范围,分别为0.00~0.89和0.02~0.86,平均值分别为0.13和0.37,但其重叠部分相对较小(图4F)。
由图4C~F可知,灌木和草本植物C31/(C31+C27)比值基本重叠,变化范围分别为0.12~0.82和0.48~0.97,平均值分别为0.55和0.77。而其他比值重叠部分相对较小,其中C31/(C31+C29)比值变化范围分别为0.23~0.47和0.21~0.88,平均值分别为0.31和0.64;C33/(C33+C27)比值变化范围分别为0.00~0.14和0.07~0.89,平均值分别为0.06和0.53;C33/(C33+C29)比值变化范围分别为0.00~0.03和0.03~0.70,平均值分别为0.02和0.37。
2.3 正构烷烃主峰碳判识木本和草本植物的可靠性讨论
已有研究显示,正构烷烃以C27和C29为主峰的主要来源于木本植物,以C31为主峰的则主要来源于草本植物(Cranwell,1973;Cranwell et al,1987;Meyers and Ishiwatari,1993)。国内外利用该手段开展了以黄土、湖泊等为地质载体的大量研究(Cranwell,1973;Meyers and Ishiwatari,1993;王志远等,2004;杨明生等,2006;张虎才等,2007),恢复和重建了地质历史时期植被类型的转换。但本研究中,木本植物样品(乔木和灌木)中主峰碳为C27或C29的仅占61.9%,而草本样品中主峰碳为C31的仅占65.2%(图2),表明主峰碳可能不能作为有效指标进行古气候与古植被恢复与重建。
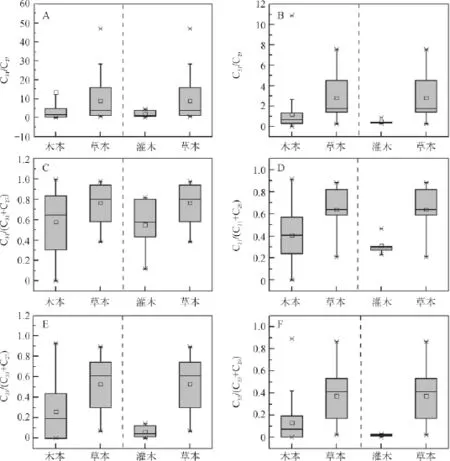
图4 本实验样品中木本和草本植物正构烷烃比值Fig.4 Ratios of n-alkanes between woody plants and grasses according to experimental data here
利用木本和草本植物的主峰碳进行判别分析(表1),即以C29和C31,C27、C29和C31,C27、C29、C31和C33作为标准,判定为木本(草本)的植物表示假设不知道植物类型而根据正构烷烃主峰碳判定该植物属于木本(草本)植物,鉴定为木本(草本)的植物表示经过鉴定确定该植物属于木本(草本)植物,两者对比确定判定准确度,整数表示判定为木本(草本)的植物中真正的木本(草本)植物数目,百分数表示判定为木本(草本)的植物中真正的木本(草本)植物比例。由表1B可知,以C27、C29和C31主峰碳为标准判别木本和草本植物的准确度为69.5%。类似的,以C27和 C29主峰碳为标准及以C27、C29和C31、C33主峰碳为标准对木本和草本植物进行判别分析的准确度分别为68.5%和70.5%(表1A和表1C)。表明依靠正构烷烃主峰碳判别植被类型的准确度较低,在古气候与古植被重建时应结合其他重建指标。
此外,由于三元相图能更直观地反映主峰碳能否将木本和草本植物区分开,尤其对于3个或3个以上组分具有更好的区分效果,因此通过三元相图,分别采用C27、C29和C33,C27、C29和C31,C29、C31和C33正构烷烃的相对丰度对木本和草本植物进行区分(图5A~C)。由图5A~C可知,对木本和草本来说,不管用C27、C29和C33,C27、C29和C31,还是C29、C31和C33进行分类,其相对丰度均有较大部分重叠,表明依靠C27、C29和C31、C33主峰碳不能区分木本植物和草本植物,因此应谨慎利用主峰碳进行古气候与古植被重建与恢复。
究其原因,植物叶蜡正构烷烃的分子分布特征可能不仅受植被类型的影响,环境条件的改变也可能改变正构烷烃的分布特征。植物叶蜡是保护植物免受伤害的第一层障碍,因此叶蜡的组成物质,包括正构烷烃,在一定程度上受环境条件的控制(Dodd and Poveda,2003;Guo et al,2014),而化学分类研究(Medina et al,2006;Bingham et al,2010)和生物合成研究(Jetter et al,2006;Kunst et al,2006)也表明,遗传控制在一定程度上也影响植物叶蜡正构烷烃的分子分布特征。因此,难以准确地区分正构烷烃链长及主峰碳的变化是受植物类型的影响,还是受环境条件的影响,如温度、干旱等。进一步的研究需要对现代植物进行全面的调查,系统研究植被类型及环境条件对植物正构烷烃链长及主峰碳的影响,以更好地通过正烷烃分子分布特征重建古气候和古植被。
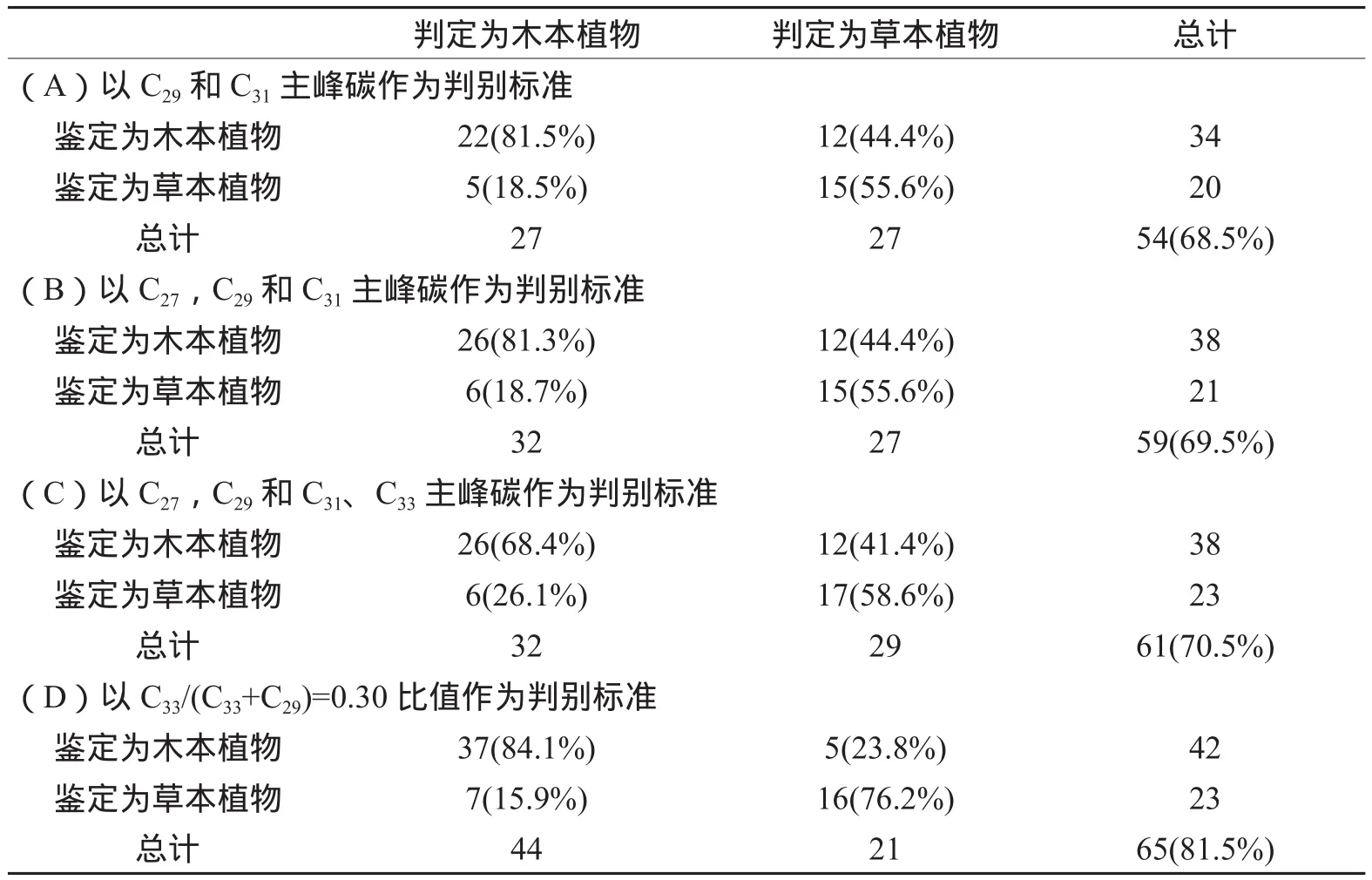
表1 木本和草本植物判别分析结果Table 1 Results of discrim inant analysis between woody plants and grasses
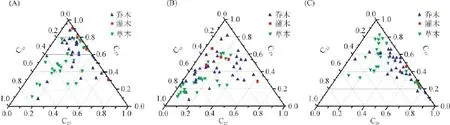
图5 木本和草本植物正构烷烃相对丰度Fig.5 Abundance of n-alkanes in woody plants and grasses
2.4 正构烷烃比值判识木本和草本植物的可靠性讨论
正构烷烃C31/C29、C31/(C31+C29)等比值变化用于反映陆源高等植物类型(木本和草本植物)输入的变化,以此为基础开展了许多研究(Schwark et al,2002;Rommerskirchen et al,2003;Schefuss et al,2003;Zhang et al,2006)。本研究也发现某些正构烷烃比值对于木本和草本植物,尤其是灌木和草本植物,具有一定的区分效果。但正构烷烃比值对于重建植被类型是否具有普遍适用性一直存在争议,缺乏大尺度范围内统计数据的验证。
对于木本和草本植物,由图4A~F可以看出,正构烷烃比值中仅C31/C29和C33/(C33+C29)具备一定的区分效果,其他比值重叠部分均较大。而木本和草本植物C31/C29比值的变化范围分别是0.00~10.89和0.27~7.58,中位数分别为0.69和1.78,表明其比值集中分布在1.00附近,实际区分木本和草本植物的效果也不好。C33/(C33+C29)比值变化范围分别是0.00~0.89和0.02~0.86,中位数分别是0.07和0.41,平均值分别为0.13和0.37,分别向0.10和0.40附近集中,具有一定的区分效果。
而以C33/(C33+C29)=0.30比值作为标准进行判别分析,即以C33/(C33+C29)=0.30作为标准,判定为木本(草本)的植物表示假设不知道植物类型而C33/(C33+C29)<0.30(C33/(C33+C29)>=0.30)时判定该植物属于木本(草本)植物,鉴定为木本(草本)的植物表示经过鉴定确定该植物属于木本(草本)植物,两者对比确定判定准确度,整数表示判定为木本(草本)的植物中真正的木本(草本)植物数目,百分数表示判定为木本(草本)的植物中真正的木本(草本)植物比例。以C33/(C33+C29)=0.30比值作为标准进行判别分析的准确度为81.5%(表1D),表明在一定程度上,C33/(C33+C29)能够区分木本和草本植物。
但通过对1232个木本和草本植物正构烷烃数据统计分析(图6A~F)发现:不管是C31/C27、C31/C29,还是C31/(C31+C27)、C31/(C31+C29)、C33/(C33+C27)以及C33/(C33+C29),其比值变化范围都很大,中位数和平均值也都相差不大,重叠部分较多,表明正构烷烃比值不能有效区分木本和草本植物。
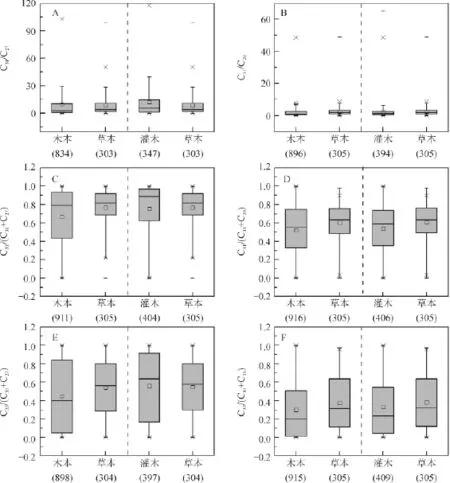
图6 统计数据中木本和草本植物正构烷烃比值Fig.6 Ratios of n-alkanes between woody plants and grasses according to statistics
对于灌木和草本植物,由图4A~F可以看出,除C31/C27和C31/(C31+C27)不能区分灌木和草本植物外,其他比值均在一定程度上具有区分效果。以C31/C29=0.50、C31/(C31+C29)=0.40、C33/(C33+C27)=0.20和C33/(C33+C29)=0.10为标准进行判别分析的准确度分别为82.1%、82.1%、85.7%和82.1%(表2A~D),表明正构烷烃比值具有区分灌木和草本植物的潜力。但通过对687个灌木和草本植物正构烷烃比值的统计(图6A~F)发现,其比值均有很大部分重叠,不能区分灌木和草本植物。
如前面所说,植物叶蜡正构烷烃的分子分布特征可能不仅受植被类型的影响,环境条件的改变也可能改变正构烷烃的分布特征,其比值变化是多种因素综合作用的结果。本研究中的灌木和草本植物全部来自黄土高原,波动较小的环境条件可能导致其正构烷烃链长的相对稳定,灌木植物高碳数正构烷烃含量相对草本植物来说基本均较低,从而与草本植物有较大差别,木本植物采自贡嘎山、太白山和黄土高原地区,较大的环境条件的改变可能影响正构烷烃链长的变化,从而使其与草本植物较难区分开。Bush and M cInerney(2013)和Carr et al(2014)也发现木本和草本植物正构烷烃链长的变化很大。因此,针对某个区域或某种特定环境,正构烷烃比值可能具有区分木本和草本植物,以及灌木和草本植物的潜力,但从大尺度或全球范围来看,正构烷烃比值可能不能作为有效的指标,使用正构烷烃比值进行古气候和古植被恢复及重建应慎重。
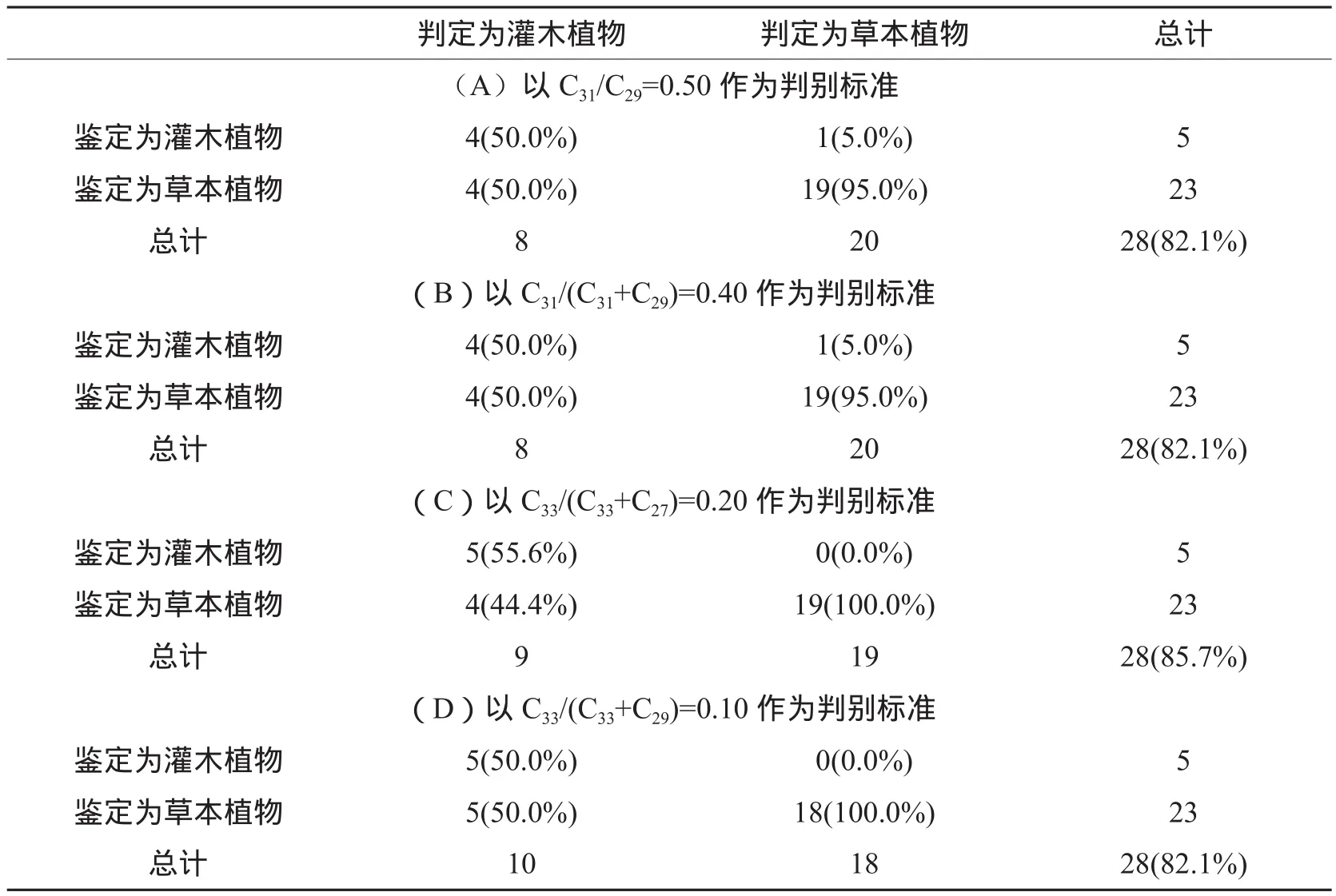
表2 灌木和草本植物判别分析结果Table 2 Results of discriminant analysis between shrubs and grasses
3 结论
目前人们通过各种研究试图将正构烷烃主峰碳和比值与古气候和古植被变化联系起来,而目前古植被重建工作多是基于木本植物正构烷烃主峰碳以C27和C29为主,草本植物的主峰碳以C31为主这一前提,但这是否具有普遍适用性值得讨论。本研究通过对贡嘎山、太白山和黄土高原地区的木本和草本植物叶蜡中正构烷烃的测定及分析发现:木本植物主峰碳为C27或C29的仅占61.9%,草本植物的主峰碳为C31的占65.2%,利用木本和草本植物主峰碳进行判别分析的准确度不超过70.5%,而正构烷烃主峰碳的三元相图也均有较大部分重叠,表明仅依靠主峰碳C27、C29和C31不能有效区分木本和草本植物。此外,本研究表明某些正构烷烃比值能在一定程度上区分木本和草本植物或灌木和草本植物,判别分析的准确度可以超过80%,但基于大尺度范围的统计数据分析表明正构烷烃比值用于古气候和古植被重建可能不具有普遍适用性。因此,应谨慎使用正构烷烃主峰碳及比值进行古植被和古气候的恢复和重建,或者选择与其他古环境重建指标联用。
致谢:感谢中国科学院地球环境研究所王欢业和姚远博士在实验前处理和仪器测试过程中给予的帮助,感谢王政副研究员和曹蕴宁高级工程师在仪器测试过程中给予的帮助,感谢国家自然科学基金项目(41073018,41573005)的资助。
饶志国,吴 翼,朱照宇,等.2011.长链正构烷烃主峰碳数作为判别草本和木本植物指标的讨论:来自表土和现代植物的证据[J].科学通报,56(10):765-780.[Rao Z G,Wu Y,Zhu Z Y,et al.2011.Is the maximum carbon number of long-chain n-alkanes an indicator of grassland or forest? Evidence from surface soils and modern plants [J].Chinese Science Bulletin,56(10):765-780.]
王志远,谢树成,陈发虎.2004.临夏塬堡黄土地层S1古土壤中的正构烷烃及其古植被意义[J].第四纪研究,24(2):231-235.[Wang Z Y,Xie S C,Chen F H.2004.n-Aikane distributions as indicators for paleovegetation from Yuanbao S1paieosoi in Linxia,Gansu Province [J].Ouaternary Sciences,24(2):231-235.]
杨明生,张虎才,雷国良,等.2006.洛川黄土剖面末次冰期间冰段弱古土壤(L1SS1)分子化石及其古植被与古环境[J].第四纪研究,26(6):976-984.[Yang M S,Zhang H C,Lei G L,et al.2006.Biomarkers in weakly developed paleosol(L1SS1)in the luochuan loess section and reconstructed paleovegetation-environment during the interstade of the last glaciations [J].Ouaternary Sciences,26(6):976-984.]
张虎才,杨明生,张文翔,等.2007.洛川黄土剖面 S4古土壤及相邻黄土层分子化石与植被变化[J].中国科学D辑:地球科学,37(12):1634-1642.[Zhang H C,Yang M S,Zhang W X,et al.2007.M olecular fossils and vegetation changes of S4paleosol and loess layer in the luochuan loess section [J].Science China (Series D): Earth Sciences,37(12):1634-1642.
张 杰,贾国东.2009.植物正构烷烃及其单体氢同位素在古环境研究中的应用[J].地球科学进展,24(8):874-881.[Zhang J,Jia G D.2009.Application of plantderived n-alkanes and their compound-speci f c hydrogen isotopic composition in paleoenvironment research [J].Advances in Earth Sciences,24(8):874-881.
Bingham E M,M cClymont E L,Väliranta M,et al.2010.Conservative composition of n-alkane biomarkers in Sphagnum species:Im p lications for palaeoclim ate reconstruction in ombrotrophic peat bogs [J].Organic Geochemistry,41(2):214-220.
Bojović S,Šarac Z,Nikolić B,et al.2012.Composition of n-alkanes in natural populations of Pinus nigra from Serbia-Chemotaxonom ic implications [J].Chemistry & Biodiversity,9(12):2761-2774.
Bush R T,M c Inerney F A.2013.Leaf w ax n-alkane distributions in and across modern plants:Implications for paleoecology and chemotaxonomy [J].Geochimica et Cosmochimica Acta,117:161-179.
Carr A S,Boom A,Grimes H L,et al.2014.Leaf w ax n-alkane distributions in arid zone South A frican flora:Environmental controls,chemotaxonomy and palaeoecological implications [J].Organic Geochemistry,67:72-84.
Cranwell P A.1973.Chain-length distribution of n-alkanes from lake sedim ents in relation to post-g lacial environmental change [J].Freshwater Biology,3(3):259-265.
Cranwell P A.1984.Lipid geochem istry of sediments from Upton B road,a small productive lake [J].Organic Geochemistry,7(1):25-37.
Cranwell P A,Eglinton G,Robinson N.1987.Lipids of aquatic organisms as potential contributors to lacustrine sediments-II [J].Organic Geochemistry,11(6):513-527.Dodd R S,A fzal-Rafii Z.2000.Habitat-related adaptive properties of plant cuticular lipids [J].Evolution,54(4):1438-1444.
Dodd R S,Poveda M M.2003.Environmental gradients and population divergence contribute to variation in cuticular wax composition in Juniperus communis [J].Biochemical Systematics and Ecology,31(11):1257-1270.
Duan Y,Ma L.2001.Lipid geochem istry in a sediment corefrom Ruoergai M arsh deposit (Eastern Qinghai-Tibet p lateau,China) [J].Organic Geochem istry,32(12):1429-1442.
Duan Y.2000.Organic geochem istry of recent marine sediments from the Nansha Sea,China [J].Organic Geochemistry,31(2):159-167.
Feakins S J,Sessions A L.2010.Controls on the D/H ratios of plant leaf waxes in an arid ecosystem [J].Geochimica et Cosmochimica Acta,74(7):2128-2141.
Guo N,Gao J,He Y,et al.2014.Variations in leaf epicuticular n-alkanes in some Broussonetia,Ficus and Humulus species [J].Biochemical Systematics and Ecology,54:150-156.
Huang Y,Street-Perrott F A,M etcalfe S E,et al.2001.Climate change as the dom inant control on glacialinterglacial variations in C3and C4plant abundance [J].Science,293(5535):1647-1651.
Jenks M A,Ashworth E N.1999.Plant epicuticular waxes:function,production,and genetics [J].Horticultural Reviews,23:1-68.
Jetter R,Kunst L,Samuels A L.2006.Composition of plant cuticular waxes [M]// Riederer M,Müller C.Biology of the Plant Cuticle.Oxford:Blackwell Publishing.
Kuhn T K,K rull E S,Bowater A,et al.2010.The occurrence o f short chain n-alkanes w ith an even over odd predom inance in higher plants and soils [J].Organic Geochemistry,41(2):88-95.
Kunst L,Jetter R,Samuels A L.2006.Biosynthesis and transport o f p lant cuticular waxes [M]// Riederer M,Müller C.Biology of the Plant Cuticle.Ox ford:Blackwell Publishing.
Kunst L,Samuels A L.2003.Biosynthesis and secretion of p lant cuticular wax [J].Progress in Lipid Research,42(1):51-80.
Li J,Huang J,Ge J,et al.2013.Chemotaxonomic signi f cance of n-alkane distributions from leaf wax in genus of Sinojackia species (Sty racaceae) [J].Biochem ical Systematics and Ecology,49:30-36.
Liu L,Song Y,Cui L,et al.2013.Stable carbon isotopic composition of black carbon in surface soil as a proxy for reconstructing vegetation on the Chinese Loess Plateau [J].Palaeogeography,Palaeoclimato logy,Palaeoecology,388:109-114.
Maffei M.1996a.Chemotaxonom ic signi f cance of leaf wax alkanes in the gram ineae [J].Biochemical Systematics and Ecology,24(1):53-64.
M affei M.1996b.Chemotaxonom ic significance of leaf w ax n-alkanes in the Umbelliferae,Cruciferae and Legum inosae (Subf.Papilionoideae) [J].Biochemical Systematics and Ecology,24(6):531-545.
M edina E,Aguiar G,Gomez M,et al.2006.Taxonom ic significance o f the epicuticular w ax com position in species o f the genus C lusia from Panama [J].Biochemical Systematics and Ecology,34(4):319-326.
M eyers P A,Ishiw atari R.1993.Lacustrine organic geochem istry an overview of indicators of organic matter sources and diagenesis in lake sediments [J].Organic Geochemistry,20(7):867-900.
Meyers P A.2003.App lications of organic geochem istry to paleolimnological reconstructions:a summary of examples from the Laurentian Great Lakes [J].Organic Geochemistry,34(2):261-289.
Nikolic B,Tesevic V,Bojovic S,et al.2013.Chemotaxonom ic Im p lications of the n-A lkane Com position and the Nonacosan-10-o l Content in Picea omorika,Pinus held reichii,and Pinus peuce [J].Chem istry & Biodiversity,10(4):677-686.
Ohkouchi N,Kaw am ura K,Taira A.1997.M o lecu lar paleoclimatology:reconstruction of climate variabilities in the late Quaternary [J].Organic Geochemistry,27(3):173-183.
Pancost R D,Boot C S.2004.The palaeoclimatic utility of terrestrial biomarkers in marine sediments[J].Marine Chemistry,92(1):239-261.
Ratnayake N P,Suzuki N,Okada M,et al.2006.The variations of stable carbon isotope ratio of land plantderived n-alkanes in deep-sea sediments from the Bering Sea and the North Paci f c Ocean during the last 250,000 years [J].Chemical Geology,228(4):197-208.
Richardson A,Franke R,Kerstiens G,et al.2005.Cuticular wax deposition in grow ing barley (Hordeum vulgare) leaves commences in relation to the point of emergence of epidermal cells from the sheaths of older leaves [J].Planta,222(3):472-483.
Rommerskirchen F,Eglinton G,Dupont L,et al.2003.A north to south transect of Holocene southeast A tlantic continental margin sediments:relationship between aerosol transport and compound-specific δ13C land plant biomarker and pollen records [J].Geochemistry Geophysics,Geosystems,4:1101.
Rommerskirchen F,Plader A,Eg linton G,et al.2006.Chemotaxonom ic signi f cance of distribution and stable carbon isotopic composition of long-chain alkanes and alkan-1-ols in C4grass waxes [J].Organic Geochemistry,37(10):1303-1332.
Sachse D,Radke J,Gleixner G.2006.δD values of individual n-alkanes from terrestrial p lants along a climatic gradient—Implications for the sedimentary biomarker record [J].Organic Geochemistry,37(4):469-483.
Schefuss E,Ratmeyer V,Stuut J B W,et al.2003.Carbon isotope analyses of n-alkanes in dust from the lower atm osphere over the central eastern A tlantic [J].Geochimica et Cosmochimica Acta,67(10):1757-1767.Schwark L,Zink K,Lechterbeck J.2002.Reconstruction of postglacial to early Holocene vegetation history in terrestrial Central Europe via cuticular lipid biomarkers and pollen records from lake sediments [J].Geology,30(5):463-466.
Shepherd T,Wynne Griffiths D.2006.The effects of stress on plant cuticular waxes [J].New Phytologist,171(3):469-499.
Simoneit B R T,Sheng G,Chen X,et al.1991.Molecular marker study of extractable organic matter in aerosols from urban areas of China [J].Atmospheric Environment.Part A.General Topics,25(10):2111-2129.
Vogts A,M oossen H,Rommerskirchen F,et al.2009.Distribution patterns and stab le carbon isotopic composition of alkanes and alkan-1-ols from plant waxes of A frican rain forest and savanna C3species [J].Organic Geochemistry,40(10):1037-1054.
Xie S,Nott C J,Avsejs L A,et al.2000.Palaeoclimate records in compound-speci f c δD values of a lipid biomarker in ombrotrophic peat [J].Organic Geochemistry,31(10):1053-1057.
Zhang Z,Zhao M,Eglinton G,et al.2006.Leaf wax lipids as paleovegetational and paleoenvironmental proxies for the Chinese Loess Plateau over the last 170kyr [J].Quaternary Science Reviews,25(5):575-594.
Relationship of p lant leaf wax n-alkanes molecular distribution characteristics and vegetation types
LIU Hu1,2,LIU Wei-guo1
(1.State Key Laboratory of Loess and Quaternary Geology,Institute of Earth Environment,Chinese Academy of Sciences,Xi'an 710061,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
The biomarkers n-alkanes are ubiquitous in nature environment.Its chain length and dom inant carbon are commonly used to indicate the changes of paleoclimate and paleovegetation.Here we analyzed the distribution of plant leaf wax n-alkanes in 65 plant samples from the Gongga Mountain,Taibai Mountain and Chinese Loess Plateau in China and we also combined 1232 observations of grasses and woody plants,including the new data here,to exam ine the chain-length ratios of n-alkanes of different vegetation types.We found that:n-alkane distributions for grasses and woody plants showed high variabilities and only 61.9% woody plants were dominated by C27or C29,while 65.2% grasses were dominated by C31.The accuracy was about 69.5% when C27,C29and C31were used as criterions to distinguish woody plants and grasses,and the large overlaps of ternary diagrams based on chain-length abundances also showed that it should be prudent to use n-alkane distributions as quantitative indicators.Similarly,C31/C29or C31/C27can't distinguish woody plants and grasses,either.Moreover,our results demonstrated that when C33/(C33+ C29)=0.30 or C33/(C33+ C27)=0.20were taken as criterions to differentiate woody plants or shrubs from grasses,the accuracies were 81.5% and 85.7%,respectively,indicating that some chain-length ratios of n-alkanes could be used as effective indicators to some extent.However,results showed that the chain-length ratios of n-alkanes can't distinguish woody plants/shrubs from grasses effectively according to the statistics of 1232 observations of grasses and woody plants.Indeed,variations of n-alkane distributions may be affected not only by vegetation types,but also by local environmental conditions.Therefore,leaf wax n-alkane distributions of dom inant carbons and chainlength ratios should not be regarded as robust indicators for paleoclimate and paleovegetation reconstruction.
plant leaf wax;n-alkanes;vegetation types;chain length;dom inant carbon
Q948
A
1674-9901(2015)03-0168-12
2015-03-09
国家自然科学基金项目(41073018,41573005)
刘卫国,E-mail:liuwg@loess.llqg.ac.cn
