轮叶党参不定根的诱导培养
2015-02-28李美阳
李美阳
(延边大学农学院,吉林延吉 133002)
轮叶党参不定根的诱导培养
李美阳
(延边大学农学院,吉林延吉 133002)
[目的]通过考察不同外植体与外源激素诱导轮叶党参不定根的能力来探索轮叶党参不定根生长的最佳条件。[方法]切取轮叶党参无菌实生苗的叶片和茎段,接种到含有不同浓度外源激素的不定根诱导培养基中,考察不同外植体与外源激素诱导生根的能力,并在此基础上进行不定根的诱导增殖。[结果]不同外植体以及不同浓度外源激素对不定根诱导能力不同,茎段诱导不定根的效果明显优于叶片。不同生长素对轮叶党参不定根诱导的影响中,IAA对不定根的诱导效果优于NAA。当IAA浓度为1.0 mg/L时的诱导培养效果最佳,茎段的生根率达到最高,可达 92%。[结论]为轮叶党参的大规模组织培养奠定基础。
轮叶党参;不定根;组织培养
轮叶党参 [CodonopsislanceolataBenth.et Hook.f] 属桔梗科党参属多年生藤本草本药食两用植物,别名山海螺、山胡萝卜、四叶参、羊奶、羊奶参、白蟒肉、羊乳等。轮叶党参主要以根入药,传统医学认为其根入药具有消肿排脓、清热解毒、补虚通乳、养阴润肺及祛痰等功效[1-2]。现代药理学研究表明,轮叶党参具有降血脂、抗氧化、抗突变、抗肿瘤及提高机体免疫力的作用[3]。
随着国际、国内市场对轮叶党参需求量的不断增长,野生资源采集已远不能满足市场的需要[4-5]。我国东北地区野生资源虽然较多,但经过多年的采挖,资源已经枯竭。保护轮叶党参植物资源已成为严峻的问题。栽培轮叶党参可以解决市场的大量需求,但栽培轮叶党参仍具有生长周期长(一般为3~5年),易受环境、季节、病虫害影响,党参皂苷含量不高等缺点,自20世纪70年代中期国内外一些研究者利用植物组织培养技术[6]进行轮叶党参快速繁殖和品种改良,作为继野生、栽培之后的第三代植物资源的生产方式——植物组织培养越来越受到人们的青睐。
目前,利用生物技术进行中药资源繁殖并大规模生产其有效成分已成为一条新的发展途径,但药用植物细胞培养的弊端之一是有效成分含量的不稳定。这主要是由于大多数有效成分均为次生代谢产物,其合成细胞阶段表现不强而造成,而根培养可以解决这一问题[7]。根培养的主要优点是具有原始植物根所具有的巨大生物合成能力,同时表现出明显的代谢稳定性和活力稳定性[8]。近年来,国内外通过培养不定根生产有用次生代谢产物的研究日益活跃,此技术已在人参[9-11]等多种药用植物应用中得以成功。
不定根培养是轮叶党参次生代谢产物产生的有效培养方法。同时,加强轮叶党参的不定根培养研究,可为次生代谢产物的大量生产提供原料,加速其药用植物开发进程[12],以提高其应用价值,满足生产和消费的需要。
笔者通过不同外源激素诱导不定根的能力来探寻不定根生长的最佳条件,为建立药用植物大规模组织培养奠定基础。
1 材料与方法
1.1 材料轮叶党参种子购自安图青谷土特产专业合作社。
1.2 轮叶党参无菌苗的获得将冷藏储存的轮叶党参种子去掉边缘种翅后用自来水冲洗30 min,直至没有其他杂质,在无菌操作台上倒入75% 乙醇消毒20 s,再用2%次氯酸钠溶液灭菌30 min,无菌水冲洗5次,无菌滤纸吸去多余水分,然后在无菌操作台上接种到MS 培养基上,接种时应防止种子重叠,进而发生霉变,最后放入培养室内,培养温度为(25±1)℃,光照强度2 000~2 500 lx,光照时间 12 h/d。
1.3 不定根的诱导选取生长健壮的无菌苗于超净工作台上,切取不含叶腋1 cm 左右的茎段和0.5 cm2的叶片,平放于含有不同浓度植物生长调节剂的不定根诱导培养基上。待不定根长至1 cm左右,将其剥离下来,转至新的培养基上继续培养。
1.4 培养基和培养条件以1/2MS培养基为基本培养基,生长素IAA浓度为0.1、0.2、0.5、1.0、2.0和3.0 mg/L共6个处理;生长素NAA浓度为0.1、0.2、0.5、1.0、2.0和3.0 mg/L共6个处理。所有培养基的蔗糖含量为30 g/L,琼脂含量为10 g/L,初始 pH5.7。培养基在121 ℃灭菌20 min。培养温度为(25±1)℃,暗培养。茎段每个处理均接种10个外植体,重复 5 次。观察不同浓度生长素条件下的生根情况。
生根率=(生根外植体数/接种外植体数)×100%
1.5 不定根的继代培养待不定根长至1 cm左右,将其剥离下来,转至新的培养基上继续培养。培养条件为1/2MS+IAA 0.3 mg/L,培养温度为(25±1)℃下暗室培养,蔗糖30 g/L,pH 5.7。
2 结果与分析
2.1 不同外植体对轮叶党参不定根诱导的影响为了确定轮叶党参不定根的最佳诱导部位,分别将叶片与茎段接种于含有2.0 mg/L IAA的培养基上,28 d后统计不定根生长情况(表1)。接种10 d后茎的外植体逐渐膨大,部分出现愈伤组织,且部分诱导生成不定根(图1)。
从表1可以看出,茎段诱导生根率明显高于叶片诱导生根率;诱导效果更好,两者生根率分别是88%和44%。茎诱导的平均根数为4.10,明显高于叶片诱导的平均根数。
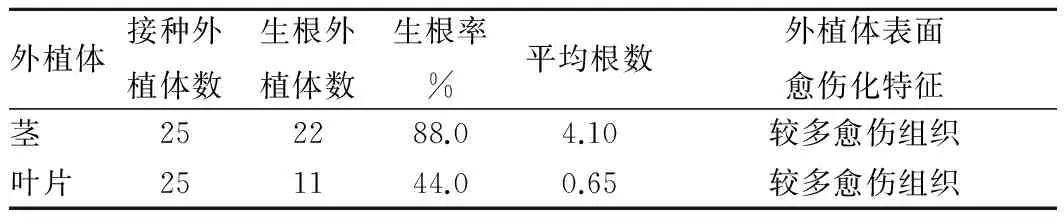
表1 不同外植体在不同浓度的IAA诱导下生根情况
2.2 不同IAA浓度对轮叶党参不定根诱导的影响因茎段诱导不定根的效果优于叶片,接种外植体使用不含叶腋1 cm 左右的茎段。在接种4~5 d后,轮叶党参外植体开始膨胀变大,部分开始卷曲,此时应将卷曲的脱离培养基的部分重新按到培养基上,进行诱导培养。14 d左右轮叶党参外植体的切口处开始出现愈伤化现象并生长出不定根。从表2可以看出,不同浓度IAA对轮叶党参不定根的诱导有较大差异,具体表现在:每个浓度的IAA都能诱导出轮叶党参的不定根,但随着IAA浓度增加生根率也逐渐升高,当IAA浓度为1.0 mg/L时,生根外植体数达46个,生根率为92%,每个外植体的平均根数为4.6,不定根的诱导效果最佳。其次为IAA浓度2.0 mg/L时生根外植体数达42个,生根率为84%。随着IAA浓度的增加生根率反而下降。

表2 不同浓度的IAA诱导生根情况
2.3 不同NAA浓度对轮叶党参不定根诱导的影响将轮叶党参茎段外植体分别接种在不同浓度NAA培养基上,每种激素的培养基上切取10段无生长点、无节间的茎段,平放在培养基上,试验重复5次。14 d左右轮叶党参外植体的切口处开始出现愈伤化现象,生长出不定根,其诱导生根情况见表3。从表3可以看出,在低浓度下随着NAA浓度增加,生根率逐渐增加,当NAA浓度为0.5 mg/L时,生根外植体数达38个,生根率达76.00%,效果最佳。其次为NAA浓度为1.0 mg/L时生根率达65.00%,但当NAA浓度继续增加时,生根率逐渐下降,NAA浓度为3.0 mg/L时,生根率极低,为0.02%。

表3 不同浓度的NAA诱导生根情况
2.4 不定根的继代培养将所获得的不定根进行继代增殖,培养条件为1/2MS+IAA1.0 mg/L,蔗糖30 g/L,pH 5.7,在温度(25±1)℃下暗培养,结果发现选择带有少量愈伤组织的不定根进行继代培养效果优于缺乏愈伤组织的不定根。
3 讨论
3.1 不同类型外植体的诱导生根轮叶党参茎、叶均可在一定条件下诱导生根,但不同外植体在外源性生长素诱导下不定根的分化能力和生长明显不同,表现出明显的异质性。其中茎的诱导效果较好,叶段明显弱于前者。
3.2 不同激素对不定根诱导的影响不定根的发生受许多因素影响,其中生长素类物质起着重要的调控作用[13]。目前离体器官或组织在诱导不定根发生时,大多需要添加外源生长素、吲哚丁酸、萘乙酸等生长素类生长调节剂。研究表明,它们在施用后会影响和改变内源生长素的水平,进而达到调节植物形态发生的目的[14]。在不同浓度的IAA和NAA试验中,IAA对不定根诱导效果明显优于NAA。
4 结论
①不同外植体诱导不定根试验中,茎段的诱导效果明显优于叶片。②不同外源激素诱导不定根试验中,IAA对不定根的诱导效果明显优于NAA。③当IAA浓度为1.0 mg/L时的诱导培养效果最佳,茎段的生根率达到最高,可达 92%。
[1] 刘威.轮叶党参栽培及管理方法[J].农业与技术,2009,29(1):110-112.
[2] 付成国,刘连奎,董然.轮叶党参化学成分与药理作用研究进展[J].中药材,2007,30(4):497-499.
[3] 徐惠波.轮叶党参多糖对单核-巨噬细胞系统吞噬功能的影响[J].吉林医药工业,1988,3:20.
[4] 鲍隆友.西藏党参属植物资源及光萼党参栽培技术[J].中国林副特产,2006,3:37-39.
[5] 耿艳秋,胡国宣,孙 伟,等.长白山轮叶党参资源及开发策略[J].吉林农业,2010(11):136-137.
[6] 庄福良,姜秀丽.轮叶党参的人工栽培技术[J].经济作物,2009(5):159-160.
[7] 袁媛,吕冬梅,黄璐琦,等.不定根诱导培养的研究[J].中国中药杂志,2007,32(1):65-66.
[8] 元英进.植物细胞培养工程[M].北京:化学工业出版社,2004:226.
[9] HAHN E J,KIM Y S,YU K W,et al.Adventitious root cultures of Panaxginseng CV Meyer and ginsenoside production through large-scale bioreactor system[J].Plant Biotechnol,2003,5(1):1-6.
[10] SIVAKUMAR G,YU K W,PAEK K Y.Production of biomass and ginsenosides from adventitious roots of Panaxginsengin bioreactor cultures[J].Engine Life Sci,2005,5(4):333-342.
[11] JEONG C S,MURTHY H N,HAHN E J,et al.Inoculum size and auxin concentration influence the growth of adventitious roots and accumulation of ginsenosides in suspension cultures of ginseng(Panaxginseng CA Meyer)[J].Acta Physiol Plant,2009,31(1):219-222.
[12] 高文远,贾伟.药用植物大规模组织培养[M].北京:化学工业出版社,2005.
[13] DAVIS T D,HAISSIG B E.Biology of adventitious root formation [M].New York:Plenum Press,1994:275-280.
[14] 谷瑞升,蒋湘宁,郭仲琛.植物离体培养中器官发生调控机制的研究进展[J].植物学通报,1999,16(3):171-177.
Induction and Culture of Adventitious Root ofCodonopsislanceolataBenth
LI Mei-yang
(Agricultural College of Yanbian University, Yanji, Jilin 133002)
[Objective] The optimum conditions of inducing capability ofCodonopsislanceolataadventitious root were explored through the study of different explants and exogenous hormones to explore theCodonopsislanceolataadventitious root growth. [Method] Cuttings of theCodonopsislanceolataaseptic seedling leaves and stem segments were inoculated into adventitious root induction medium containing exogenous hormone at different concentration, the ability of different explants and exogenous hormones on induction of rooting were investigated, and on this basis the proliferation of adventitious root induction experiment was conducted. [Result] Different explants and various concentrations hormones have different abilities on induction of adventitious root, stem segments induced adventitious root is obviously better than the blade. Effect of different auxins onCodonopsislanceolataadventitious root induction, IAA is better than NAA on the induction of adventitious root. When the concentration of IAA for inducing culture best effect at 1 mg/L, stems rooting rate reached the highest value, up to 92%. [Conclusion] The study will lay a foundation for large scale tissue culture ofCodonopsislanceolata.
CodonopsislanceolataBenth.et Hook.f; Adventitious root; Tissue culture
李美阳(1971- ),女,吉林安图人,讲师,博士,从事植物生理方面的研究。
2014-11-19
S 567
A
0517-6611(2015)01-027-02
