外源葡萄糖对盐胁迫下黄瓜幼苗光合作用和离子分布的影响
2015-02-28汪菊香
汪菊香
(安徽省南陵县许镇镇农业综合服务中心,安徽芜湖 241000)
外源葡萄糖对盐胁迫下黄瓜幼苗光合作用和离子分布的影响
汪菊香
(安徽省南陵县许镇镇农业综合服务中心,安徽芜湖 241000)
[目的] 为了探讨外源葡萄糖缓解盐胁迫下黄瓜幼苗生理伤害的作用机制。[方法] 采用营养液水培法,以盐敏感型黄瓜品种‘津春2号’为材料,研究外源葡萄糖对盐胁迫下黄瓜幼苗生长、叶绿素含量、光合作用以及体内离子分布的影响。[结果] 盐胁迫(65 mmol/L NaCl)显著降低了黄瓜幼苗叶片的叶绿素含量、净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci),限制了黄瓜幼苗植株的生长,而根施2 mmol/L葡萄糖缓解了盐胁迫诱导的光合速率和生长下降;在盐胁迫下,黄瓜幼苗叶片、茎和根中Na+和Cl-含量显著增加,而K+和Mg2+含量明显降低,外源葡萄糖处理逆转盐胁迫诱导黄瓜植株体内离子含量的变化。[结论]外源葡萄糖通过抑制根中Na+和Cl-向地上部的运输,减轻叶片中Na+和Cl-积累诱导的离子毒害,从而缓解盐胁迫对光合作用的抑制,进而促进盐胁迫下黄瓜幼苗的生长。
葡萄糖;黄瓜;盐胁迫;生长;光合作用;离子分布
盐胁迫对农业生产的威胁是一个世界性的热点问题,也是影响全球生态环境的重要因素之一[1]。由于盐渍土土壤具有相对较高的溶液浓度,易引起植物叶片渗透势、水势以及相对含水量下降,导致生长发育受到限制[2]。众多研究证实,盐胁迫抑制植株生长,通常与光合作用效率的下降密切相关。Stepien等[3]研究表明,盐胁迫处理14 d的黄瓜植株净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)均显著降低,而非光化学淬灭系数(qN)显著升高。盐胁迫下黄瓜叶片PSII实际光化学效率(ФPSII)、气孔限制值(Ls)和胞间CO2浓度(Ci)下降[4]。研究表明,盐胁迫导致光合效率下降主要是由非气孔限制因素所致,如光合色素、叶绿体超微结构、光合电子传递、光合膜蛋白复合体以及光合磷酸化和CO2固定等方面受到抑制或损伤,且光合作用的抑制程度取决于盐害的胁迫程度、持续时间以及不同耐性的植物品种[5]。
葡萄糖作为渗透调节物质,能提高细胞的渗透调节能力,具有维持细胞渗透压平衡和增强植物响应非生物胁迫的能力。研究表明,水分胁迫下施用外源葡萄糖可通过促进小麦根系生长和提高叶组织的渗透调节能力,改善叶片的水分状况和光合功能,从而减轻水分胁迫对小麦幼苗生长的抑制作用[6]。经进一步研究,发现在花后干旱和低氮互作胁迫下,外源喷施葡萄糖处理能够明显增加小麦单穗结实率和籽粒干物质的积累,延长旗叶的光合效率和灌浆持续期,促进小麦籽粒蛋白质和淀粉积累,进而提高小麦的产量[7]。在盐胁迫下,施用外源葡萄糖能够有效增强山楂、甜菜体内抗氧化酶的活性,降低活性氧过量积累诱导的氧化伤害[8]。此外,有研究表明,外源葡萄糖能够提高盐胁迫下水稻、玉米和红小豆种子的发芽率、活力指数和发芽指数,增强种子对盐胁迫环境的适应能力[9-11]。然而,对于葡萄糖如何增强盐胁迫下蔬菜作物抗性的生理机制仍缺乏了解。
黄瓜(CucumissativusL.)具有产量高、营养丰富、效益好等特点,是世界性的重要蔬菜作物之一,也是我国设施栽培面积大、种植范围广的主要蔬菜作物之一。但是,由于黄瓜根系分布较浅,再生能力弱,对盐渍环境敏感。一旦遭受盐害,黄瓜植株生长发育就会受到显著抑制,严重影响黄瓜的产量和品质。为此,笔者采用营养液水培法,通过根施外源葡萄糖处理盐胁迫下黄瓜幼苗,研究外源葡萄糖对盐胁迫下黄瓜幼苗生长、光合作用和体内离子分布的影响,以期探讨外源葡萄糖缓解盐胁迫下黄瓜幼苗生理伤害的作用机制,为利用外源葡萄糖增强黄瓜植株耐盐性提供理论依据。
1 材料与方法
1.1 幼苗培养试验于2013年3~6月在塑料大棚内进行。选用盐敏感型的黄瓜品种‘津春2号’(购自天津市科润黄瓜研究所)为试验材料,种子经消毒、浸种后,在29 ℃下催芽24 h,播于装有基质的塑料盘中育苗。棚内昼温控制在20~25 ℃,夜温昼温控制在15~18 ℃,光合有效量子密度(PPFD)最大为900 μmol/(m2·s)左右,相对湿度维持在55%~75%。在两片子叶展开后,浇1/2剂量的日本园试配方营养液。待第2片真叶展开后,选取生长整齐一致的幼苗定植于装有1个剂量园试配方营养液的箱(60 L)中,营养液pH调至6.5±0.1,电导率(EC)2.0~2.2 mS/cm,气泵通气20 min/h 。
1.2 试验处理预培养2 d后,向营养液中添加NaCl。试验设4个处理:①对照(CK),正常营养液栽培;②对照+葡萄糖(CK+Glu);③盐胁迫(NaCl);④盐胁迫+葡萄糖(NaCl +Glu)。当开始NaCl处理时,处理②、④外源葡萄糖直接添加到营养液中。每个处理72株,试验随机排列,3次重复。处理7 d后,测定各项指标,并且选择第 3 片真叶(从基部数)测定光合作用参数和叶绿素含量。该试验所采用的NaCl胁迫浓度(65 mmol/L)和根施葡萄糖处理浓度(2 mmol/L)均由预备试验筛选得出。
1.3 指标测定与方法
1.3.1生长指标的测定。株高(茎基部到生长点)用直尺测量;茎粗(茎基部)用游标卡尺测量;鲜样用去离子水冲洗干净并吸干水分后称得鲜重;在烘箱中105 ℃下杀青15 min后,降温到75 ℃烘干至恒重,称得干重。
1.3.2光合色素含量的测定。叶绿素含量根据Holden[12]的方法,用乙醇∶丙酮∶水4.5∶4.5∶1.0萃取完整叶片色素含量,利用紫外分光光度计测量。
1.3.3气体交换参数的测定。用便携式光合作用测定系统(Li-6400,美国),于上午9:30~11:30测定各处理幼苗第三叶位叶片的光合气体交换参数。每个处理测定3株。测定时,使用开放气路,叶室温度控制在(28±1) ℃,光强控制在800 μmol /(m2· s),参比室CO2浓度为(370±10)μmol/mol,相对湿度为60%~70%。测定指标主要包括叶片的Pn、Tr、Gs和Ci。
1.3.4离子含量分析。提取方法参照王宝山等[13]方法,略加改动。称取烘干样品40 mg于试管中,加20 ml去离子水,摇匀,沸水浴2 h,冷却后过滤于50 ml容量瓶中定容。K+、Na+和Mg2+含量使用日立Z-2000型原子吸收分光光度计进行测定。Cl-含量采用AgNO3滴定法进行测定,以0.22 mol/L K2CrO4和0.03 mol/L K2Cr2O7为混合指示剂。
1.4 数据分析试验数据均采用SAS13.1统计分析软件进行分析。采用Duncan多重比较法进行统计分析,P<0.05。
2 结果与分析
2.1 葡萄糖对盐胁迫下黄瓜幼苗生长的影响由表1可知,在正常营养液栽培条件下,根施外源葡萄糖对黄瓜幼苗生长指标没有明显的影响。65 mmol/L NaCl胁迫处理7 d后,黄瓜幼苗株高、茎粗、鲜重和干重明显下降,与对照相比分别下降37.04%、17.48%、40.85%和37.55%。盐胁迫下,外源葡萄糖显著增加黄瓜幼苗株高、茎粗、鲜重和干重,分别比单纯盐胁迫处理提高47.78%、19.22%、51.39%和40.17%,说明外源葡萄糖缓解盐胁迫诱导黄瓜幼苗生长的抑制。
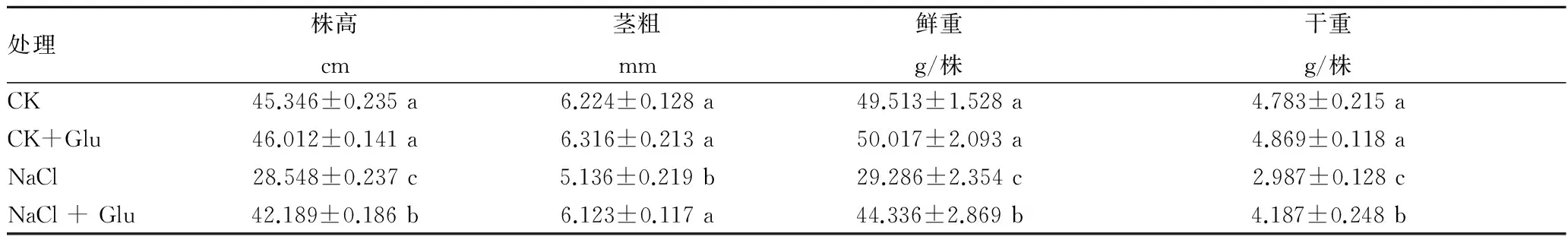
表1 外源葡糖糖对盐胁迫下黄瓜幼苗生长的影响
注:每个值都是由3个重复的平均值±标准误差。不同字母表示差异达0.05显著水平。
2.2 葡萄糖对盐胁迫下黄瓜幼苗光合色素含量的影响由表2可知,盐胁迫下,黄瓜幼苗叶片叶绿素a(Chl a)、Chl(a+b)含量和Chl a/Chl b显著下降,与对照相比分别降低了39.98%、26.16%和49.46%,而叶绿素b(Chl b)含量显著增加。根施葡萄糖处理显著提高盐胁迫下Chl a、Chl(a+b)和Chl a/Chl b的值,与盐胁迫相比分别增加了51.31%、23.62%和93.48%,而Chl b含量显著下降。在正常营养液栽培条件下,根施葡萄糖对黄瓜幼苗光合色素含量没有明显的影响。
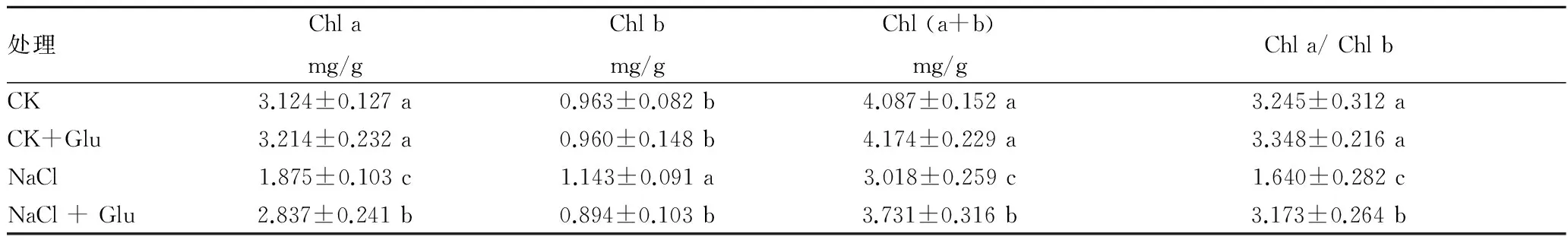
表2 外源葡萄糖对盐胁迫下黄瓜幼苗光合色素含量的影响
注:每个值都是由3个重复的平均值±标准误差。不同字母表示差异达0.05显著水平。
2.3 葡萄糖对盐胁迫下黄瓜幼苗光合作用的影响由图1可知,盐胁迫下,黄瓜幼苗叶片Pn、Gs和Tr显著下降,与正常营养液栽培相比分别下降了62.44%、57.44%和65.68%,而盐胁迫显著增加Ci,比对照增加了19.70%。外源葡萄糖处理显著提高了黄瓜叶片Pn、Gs和Tr,与单纯盐胁迫处理相比分别增加了100.15%、61.10%和145.58%,并且降低了Ci。在正常营养液栽培条件下,外源葡萄糖处理对黄瓜幼苗叶片光合作用无明显影响。
2.4 葡萄糖对盐胁迫下黄瓜植株体内离子分布的影响由表3可知,盐胁迫下,黄瓜不同器官中Na+和Cl-含量明显增加,而Cl-增加的幅度高于Na+;与正常营养液栽培相比,盐胁迫下黄瓜幼苗植株叶片、茎中和根中Na+含量分别增加了585.12%、508.87%和258.04%,而叶片、茎中和根中Cl-含量分别增加了2 043.62%、2 419.39%和1 239.47%;盐胁迫下,黄瓜不同器官中K+和Mg2+含量均明显下降,而K+下降的幅度高于Mg2+;与对照相比,叶片、茎中、根中K+和Mg2+含量分别下降了62.02%、81.77%、72.93%和44.57%、59.22%、74.07%。外源葡萄糖处理明显逆转了盐胁迫下黄瓜植株体内离子含量的变化。葡萄糖处理明显降低盐胁迫下黄瓜植株中Na+和Cl-含量,与单纯盐胁迫相比黄瓜叶片、茎、根中Na+、Cl-含量分别降低了58.26%、35.53%、52.70%和41.89%、35.76%、33.99%;同时,葡萄糖明显增加盐胁迫下黄瓜叶片、茎、根中K+和Mg2+含量,与盐胁迫相比分别增加了111.64%、216.72%、97.10%和54.90%、61.91%、92.86%。在正常营养液栽培条件下,施用外源葡萄糖对黄瓜幼苗不同组织中的离子含量无明显的影响。
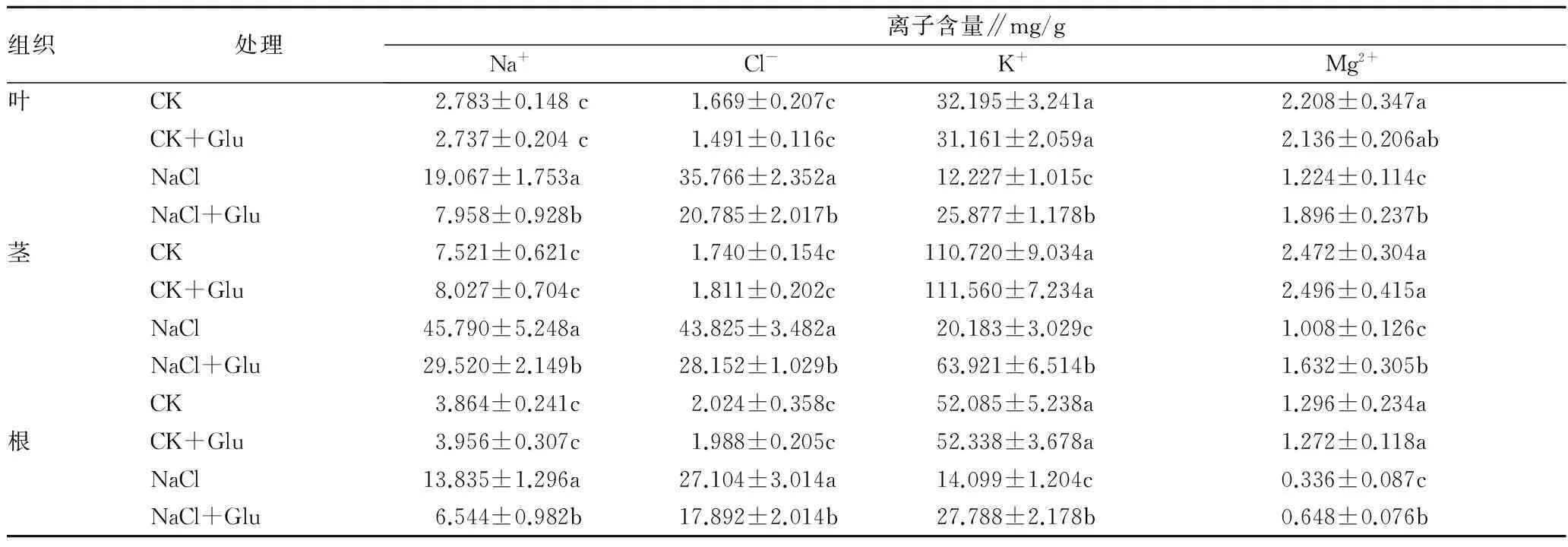
表3 外源葡萄糖对盐胁迫下黄瓜幼苗根、茎和叶中离子含量的影响
注:每个值都是由3个重复的平均值±标准误差。不同字母表示差异达0.05显著水平。
3 讨论
研究表明,65 mmol/L NaCl胁迫处理7 d后,黄瓜幼苗生长受到显著抑制,而施用2 mmol/L葡萄糖可明显提高盐胁迫下黄瓜幼苗的株高、干重和鲜重。这可能是由于葡萄糖改善了盐胁迫下黄瓜幼苗的光合作用。
光合作用是地球上所有生物体获取能量和物质的基础。提高光合作用的效率是提高农作物产量的又一重要途径。研究表明,盐胁迫导致植物光合效率下降主要包括气孔因素和非气孔因素2个方面。判断的依据主要是看Pn、Ci和Gs三者的变化趋势[14]。如果Pn下降,那么伴随着Ci和Gs的同时下降,基本上可以确定净光合速率的下降主要是由气孔因素引起的;反之,如果Gs下降,而Ci维持不变甚至上升,则Pn的下降是由叶肉细胞同化能力下降或光合器官组分等非气孔因素所致。该试验表明,在盐胁迫下,黄瓜幼苗叶片Pn、Ci和Gs显著降低,而Ci显著升高,表明盐胁迫引起光合速率的下降主要是由非气孔因素所致。施用外源葡萄糖处理可显著缓解盐胁迫诱导黄瓜幼苗叶片Pn、Ci和Gs的下降,并降低Ci的浓度。这与于翠等[15]在葡萄糖缓解盐胁迫下山楂光合特性上的研究结果相一致,表明葡萄糖提高盐胁迫下黄瓜幼苗叶片光合速率主要是通过作用于非气孔因素。
光合色素是一类含脂的色素,存在于叶绿体内基粒类囊体上,主要包含叶绿素、反应中心色素和辅助色素,在光合作用中参与光能吸收、传递或原初光化学反应等过程。高等植物和大部分藻类的色素主要是由叶绿素 a、叶绿素 b和类胡萝卜素(包括胡萝卜素和叶黄素)组成[1]。研究表明,盐胁迫对高等植物光合色素含量的影响依赖于试验材料、盐处理浓度及处理时间。王加真等[16]通过研究不同盐胁迫程度下沟叶结缕草Chl a和 Chl b含量的变化,发现在高浓度盐胁迫条件(1.5、2.0 mmol/L NaCl)下所有光合色素含量都减少,中等胁迫浓度(1 mmol/L NaCl)下光合色素含量先增加后减少,而在低浓度条件(0.5 mmol/L NaCl)下光合色素含量有增加的趋势。试验中,65 mmol/L NaCl处理显著降低黄瓜幼苗叶片Chl a、Chl a+b和Chl a/b的值,暗示盐胁迫可能诱导叶绿素降解酶活性的增加,从而促进叶绿素降解[4]。外源施用葡萄糖处理显著缓解盐胁迫下黄瓜幼苗Chl a的降低,并且提高叶绿素a/b的比值,表明葡萄糖可能抑制叶绿素降解酶的活性,保持其结构的稳定性,并且使黄瓜叶片具有较高的叶绿素含量,有助于黄瓜叶片对光能的吸收,提高光能转化效率,从而保证盐胁迫下黄瓜幼苗光合作用的正常进行[1]。
植物光合作用在盐胁迫下的响应与植物自身阻止盐分离子向体内运输以及维持细胞内的离子平衡密切相关[17]。当细胞外Na+和Cl-含量累积到一定临界值时,细胞内的水分子快速地从水通道离开细胞,造成细胞失水。与此同时,Na+、Cl-可分别通过Na+/K+、Cl-通道进入细胞质,然后进入叶绿体体内,虽然离子在细胞中运动的具体机制目前仍不清楚,但是光合器官中较高浓度的Na+和Cl-含量将抑制光合酶活性[18]。另外,植株体内Na+和Cl-的过量积累将会抑制K+和Mg2+的吸收,而K+和Mg2+又是植物光合作用中多种酶的活化剂,其含量的减少势必会进一步加剧光合作用的抑制。Li等[19]研究表明,随着盐胁迫处理浓度的增加,红树林植株叶片中积累的Na+和Cl-含量也相应增加,使得植物细胞体内养分吸收动态平衡发生紊乱,导致光合作用受到抑制。该试验结果表明,施用外源葡萄糖处理可有效降低黄瓜植株体内Na+和Cl-含量,并且抑制Na+和Cl-由植株体内向地上部的运输,提高植株体内K+和Mg2+含量,说明葡萄糖作为一种渗透调节物质和能量物质,可直接或间接地维持细胞的离子选择性,通过调节过量盐分离子进入植株体内,维持黄瓜幼苗体内养分离子的吸收平衡,缓解盐分离子对光合机构的毒害,进而提高盐胁迫下黄瓜幼苗光合效率。而对于葡萄糖如何调节盐分离子在植株体内的运输和转运还需进一步的研究。
[1] 束胜,郭世荣,孙锦,等.盐胁迫下植物光合作用的研究进展[J].中国蔬菜,2012(18):53-61.
[2]SUDHIR P R,MURTHY S D S.Effects of salt stress on basic processes of photosynthesis[J].Photosynthetica,2004,42(4):481-486.
[3]STEPIEN P,KLOBUS G.Water relations and photosynthesis inCucumissativusL.Ieaves under salt stress[J].Biologia Plantarum,2006,50(4):610-616.
[4]ZHANG R H,LI J,GUO S R,et al.Effects of exogenous putrescine on gas-exchange characteristics and chlorophyll fluorescence of NaCl-stressed cucumber seedlings[J].Photosynthesis Research,2009,100(3):155-162 .
[5]MEGDICHE W,HESSINI K,GHARBI F,et al.Photosynthesis and photosystem II efficiency of two salt-adapted halophytic seashoreCakilemaritimaecotypes[J].Photosynthetica,2008,46(3):410-419.
[6] 胡梦芸,李辉,李倩影,等.花后干旱和低氮胁迫下外源葡萄糖对小麦产量性状的影响[J].中国农学通报, 2012,28(27):118-123.
[7] 胡梦芸,李辉,张颖君,等.水分胁迫下葡萄糖对小麦幼苗光合作用和相关生理特性的影响[J].作物学报,2009,35(4):724-732.
[8] 曹光峰,郭洪海,田高中,等.施加外源葡萄糖对甜菜响应盐胁迫的影响[J].安徽农业科学,2012,40(8):4494-4495.
[9] 周红菊.水杨酸和葡萄糖对盐胁迫下玉米种子萌发的缓解作用[J].湖北农业科学,2012,51(8):1539-1540.
[10] 尹相博,于立芝,汤丽娟.Ca2+和葡萄糖对盐胁迫下红小豆种子萌发的影响[J].广东农业科学,2013(21):39-42.
[11] 凌腾芳,宣伟,樊颖瑞,等.外源葡萄糖、果糖和NO供体(SNP)对盐胁迫下水稻种子萌发的影响[J].植物生理与分子生物学学报,2005,31(2):205-212.
[12]HOLDEN M.Chlorophylls[M]//GOODWIN T W.Chemistry and Biochemistry of Plant Pigments.London.London,Academic Press,1965:461-488.
[13] 王宝山,赵可夫.小麦叶片中Na、K提取方法的比较[J].植物生理学通讯,1995,31(1) :50-52.
[14] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[15] 于翠,吕德国,杨磊,等.葡萄糖对盐胁迫下山楂幼苗光合荧光特性的影响[J].沈阳农业大学学报,2009,40(4):408-412.
[16] 王加真,夏更寿,李建龙,等.高盐胁迫对沟叶结缕草叶片光合色素含量的影响[J].上海交通大学学报,2007,25(6):583-586.
[17]SIMON P,ROBINSON W,JOHN S D.Photosynthesis and ion content of leaves and isolated chloroplasts of salt-stressed spinach[J].Plant Physiol,1983,73:238-242.
[18]WANG R,CHEN S,DENG L,et al.Leaf photosynthesis,fluorescence response to salinity and the relevance to chloroplast salt compartmentation and anti-oxidative stress in two poplars[J].Trees,Struct and Funct,2007,21(5):581-591.
[19]LI N Y,CHEN S L,ZHOU X Y,et al.Effect of NaCl on photosynthesis,salt accumulation and ion compartmentation in two mangrove species,Kandelia candeln and Bruguiera gymnorhiza[J].Aquatic Botany,2008,88:303-310.
Effects of Exogenous Glucose on Photosynthesis and Ion Distribution of Cucumber Seedlings under Salt Stress
WANG Ju-xiang
(Xuzhen Comprehensive Agricultural Service Center of Nanling County,Wuhu,Anhui 241000)
[Objective] The research aimed to investigate the mechanism of the relief of exogenous glucose on cucumber seedlings exposed to salt stress.[Method] Taken sensitivity pattern cucumber ‘Jinchun 2’as material,the effects of exogenous glucose on plant growth,chlorophyll content,gas exchange parameter and ion distribution of cucumber seedlings exposed to salt stress were studied by hydroponics.[Result] 65 mmol/L NaCl salt stress induced a severe reduction of growth,chlorophylls content and photosynthesis.Application of exogenous glucose (2 mmol/L glucose) alleviated the reduction of growth and net photosynthetic rate (Pn) in salt stressed-cucumber plants.Salt stress resulted in a significant accumulation of Na+and Cl-in roots,stems and leaves,but decreased the levels of K+and Mg2+.However,application of glucose to salt-stressed plants counteracted the adverse effects of excess ion accumulation.[Conclusion] Exogenous glucose inhibited the transportation of Na+and Cl-from roots to leaves,decreased the accumulation of Na+and Cl-in different tissues under salt stress,which was associated with an improvement in photosynthetic efficiency.
Glucose; Cucumber; Salt stress; Growth; Photosynthesis; Ion distribution
汪菊香(1975-),女,安徽芜湖人,农艺师,从事瓜果蔬菜技术方面的研究。
2014-11-21
S 642.2
A
0517-6611(2015)01-007-04
