不同糖类稀释液对低温保存杜泊羊鲜精的影响
2015-02-27李清泉石剑华张广和韩天龙赤峰市农牧科学研究院内蒙古赤峰02403吉林大学动物医学学院吉林长春30062赤峰市农畜产品质量安全管理站内蒙古赤峰024000
毛 冉,李清泉,石剑华,王 敏,2,张广和,韩天龙,2*(.赤峰市农牧科学研究院,内蒙古 赤峰 02403;2.吉林大学 动物医学学院,吉林 长春 30062;3.赤峰市农畜产品质量安全管理站,内蒙古 赤峰 024000)
不同糖类稀释液对低温保存杜泊羊鲜精的影响
毛冉1,李清泉1,石剑华1,王敏1,2,张广和2,3,韩天龙1,2*(1.赤峰市农牧科学研究院,内蒙古 赤峰 024031;2.吉林大学 动物医学学院,吉林 长春 130062;3.赤峰市农畜产品质量安全管理站,内蒙古 赤峰 024000)
[摘要]为了比较添加不同糖类(葡萄糖、果糖、D-半乳糖和蔗糖)稀释液对杜泊羊鲜精品质的影响,试验选用3岁健康杜泊种公羊3只,采集精液,等量分装,分别加入等量等温的含不同糖类的精液稀释保存液,并在0 h、6 h、24 h、30 h、48 h、54 h、72 h和78 h对精子活率、质膜完整率和顶体完整率进行检测。结果表明,混合糖精子活力、质膜完整率和顶体完整率都最高,与其他组差异显著(P<0.05);D-半乳糖组质膜完整率比葡萄糖组和果糖组高,差异显著(P<0.05),其他指标三者差异不显著(P>0.05);蔗糖组效果较差,与其他组差异显著(P<0.05),对照效果最差,与其他组差异极显著(P<0.01);有效存活时间和生存指数混合糖组最高。结果提示:添加葡萄糖、果糖和D-半乳糖的混合糖作为杜泊羊新鲜精液的保存液效果较好。
[关键词]杜泊羊;精液稀释液;糖;鲜精;品质
糖类在精液稀释保存液中有多种作用。首先,糖类是精液稀释保存液中重要的渗透压保护剂,能够在亲水组织中替代水分子,防止精子膜结构因渗透压变化而造成损伤[1],有利于精子膜结构的完整,从而提高精子活力[2-3];其次,糖类可为精子补充能量,维持细胞基本代谢,减少精子自身能量消耗,延长精子在体外的存活时间,提高精子受精能力[4-5]。目前我国大部分养殖场杜泊羊都是采用冻精进行人工授精,但受胎率较低,在60%左右且不稳定,而用常规液态保存的精液进行人工授精后效果比冻精好,且费用低、操作程序简单,但是鲜精稀释保存液大多数保存时间短,给生产带来很多不便。综合国内外资料,羊冻精保存稀释液主要有三类,即Tris-柠檬酸-糖类组合、EDTA-柠檬酸钠-糖类组合和柠檬酸盐-糖类组合[6],都含有糖类;熊前等研究发现,含糖的稀释液优于不含糖的稀释液[7],而目前关于精子在体外长时间培养期间的糖代谢研究尚少[8],所以筛选出适宜鲜精体外保存的糖类稀释保存液非常重要。
本研究以杜泊羊为研究对象,通过比较稀释液中添加葡萄糖、果糖、D-半乳糖、蔗糖对精液品质的影响,以期,筛选出有利于杜泊羊鲜精液保存的最佳糖类稀释液。
1材料与方法
1.1试验动物
精液采自某羊场3只健康杜泊种公羊,年龄3岁,按常规饲养管理。
1.2试验主要试剂
新鲜卵黄液;葡萄糖(Glucose,C6H12O6,180.16),蔗糖(Sucrose,C12H22O11,342.29),柠檬酸钠(Sodium Citrate,C6H5Na3O7·2H2O,294.10)均购自天津市致远化学试剂有限公司;果糖(Fructose,C6H12O6,180.16)购自上海恒远生化制剂有限公司;D-半乳糖(D-galactose,C6H12O6,180.16)购自北京博奥公司;瑞氏-姬姆萨复合染液,购自Solarbio公司;灭菌蒸馏水。
1.3稀释液的组成
采用本实验室对8种常用精液稀释液进行筛选后得出的效果较好的配方(柠檬酸钠-卵黄为基础,pH值为6.8)作为基础配方,分别添加不同的糖类组成试验用稀释液(见表1)。
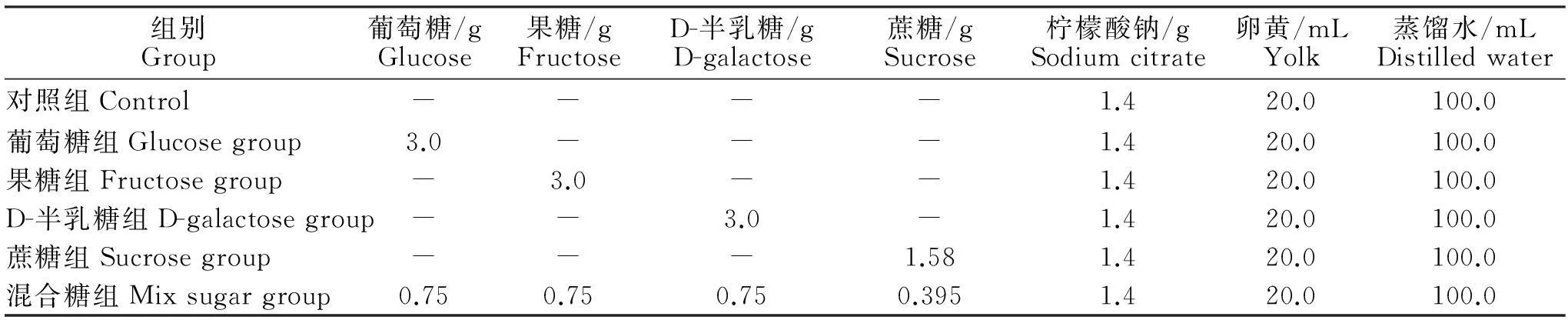
表1 含不同糖类的精液稀释液配方
1.4精液采集与处理
采用假阴道法采集精液,精液采集后放入预热的集精杯中,立即送往实验室,室温下进行活率检测。为防止因杜泊羊个体差异造成的试验误差,把活率达到0.8以上、色泽和气味正常且密度3.5×109个/mL以上的精液进行混合,等量分装6份,分别加入预温好的6种稀释液(按照精液与稀释液1∶2稀释),每组设1个重复,置于4 ℃保存。隔3 d后,继续按上述方法采集精液检测作为重复,重复2次。
1.5检测指标
1.5.1精子活率的检测取上述保存0 h、6 h、24 h、30 h、48 h、54 h、72 h、78 h的精液,用生理盐水进行1∶10稀释后,光学显微镜下400 ×观察活率并记录,每次设3个重复。
依据精子活率检测结果,分别计算精子有效存活时间和精子生存指数。精子有效存活时间是指精子活力在0.6以上的保存时间;精子生存指数是指平均存活时间,表示精子活力下降速度,即相邻两次精子活力的平均数与间隔时间乘积的总和。
1.5.2精子质膜完整率取10 μL精液加入100 μL果糖柠檬酸钠等温低渗液中,37 ℃孵育30 min。400 ×显微镜下计数弯尾精子数。每次检测200个精子。
1.5.3精子顶体完整率用瑞-姬氏染色法测定精子顶体完整率[9]。于1000 ×显微镜下观察顶体完整数,每次检测200个精子。顶体完整率=顶体完整精子数/计数精子数×100 %。
1.6数据分析
采用SPSS18.0软件进行方差分析,采用标准差(mean±SD)表示 。
2结果与分析
2.1不同糖类稀释液对鲜精活率、存活时间和生存指数的影响
由表2可知,精子经含不同糖类稀释液保存后,精子活力随保存时间的延长而逐渐下降。6 h时,对照组精子活率下降到62%,混合糖组活率最高为90%;24 h时,对照组降到45%,混合糖组仍可达到82%,葡糖组、果糖组和D-半乳糖组仅次于混合糖组,活率可达到78%,蔗糖组差,活率为63%,对照组最差;48 h时精子活率大于60%的只有葡萄糖组、果糖组、D-半乳糖组和混合糖组,对照组已经降到12%;78 h时还有存活的只有葡萄糖组、果糖组、D-半乳糖组和混合糖组,且活率达40%以上,其中混合糖组活率最高,对照组和蔗糖组活率为0。

表2 不同糖类稀释液中精子的平均活率
由表3知,混合糖组最高精子的有效存活时间为57.7 h,是对照组的9倍,与其他组差异显著(P<0.05);其次是葡萄组、果糖和D-半乳糖组,为49 h左右,三者间差异不显著(P>0.05),是对照组的7倍;蔗糖组效果相对较差,有效存活时间为28.1 h,是对照组的4倍,与其他组差异显著(P<0.05)。
生存指数表示精子活率下降速度,指数越高,说明活率越强,品质越好。由表3可知,混合糖组精子生存指数达到60.0以上,与其他组差异显著(P<0.05);其次是葡萄组、果糖组和D-半乳糖组,可达到50.0以上,三者间差异不显著(P>0.05);蔗糖组差,为30.5,与其他组差异显著(P<0.05),对照组最差,与其他组差异显著(P<0.05)。

表3 不同糖类稀释液稀释中精子的存活时间及生存指数
注:同行数据相同字母表示差异不显著(P>0.05);不同字母表示差异显著(P<0.05)。
Notes:In same line,same lowercase superscripts mean insignificant difference(P>0.05),different lowercase superscripts mean significant difference(P<0.05) .
2.2不同糖类稀释液对精子质膜完整率的影响
由表4可知,随着时间的延长,各组精子的质膜完整率逐渐下降。6 h时,混合糖组质膜完整率最高,为86.6%,与其他组差异显著(P<0.05),葡萄组、果糖和D-半乳糖组效果次之,三者差异不显著(P>0.05);48 h精子质膜完整率大于60%的只有D-半乳糖组和混合糖组,且混合糖组最高,为63.7%,D-半乳糖组为60.1%,二者相比差异显著(P<0.05);葡萄组和果糖组次之,二者差异不显著(P>0.05);蔗糖较差,与其他组差异显著(P<0.05);对照组最差,与其他组差异极显著(P<0.01);78 h时,质膜完整率以混合糖最高,其次是D-半乳糖组,差异显著(P<0.05)。

表4 不同糖类稀释液中精子质膜完整率
注:同列数据相同字母表示差异不显著(P>0.05);不同字母表示差异显著(P<0.05),大写字母不同者差异极显著;(P<0.01)。下同。
Notes:In same column,same lowercase superscripts mean insignificant difference(P>0.05),different lowercase superscripts mena significant difference(P<0.05),and different uppercase mean extremely significant difference(P<0.01) .The same below.
2.3不同糖类稀释液对精子顶体完整率的影响
由表5可知,鲜精液稀释保存液中精子顶体完整率随着时间的延长而降低,48 h精子顶体完整率大于70%的只有葡萄组、果糖组、D-半乳糖组和混合糖组,且混合糖组最高,但与葡萄组、果糖组和D-半乳糖组相比无显著性差异(P>0.05);蔗糖组次之,与其他组差异显著(P<0.05),对照组效果最差;78 h时,葡萄组、果糖组、D-半乳糖组和混合糖组顶体完整率仍可达到60%,各组间差异不显著(P>0.05)。

表5 不同糖类稀释液中精子顶体完整率
3讨论
用羊冻精进行人工授精繁殖的受胎率低于自然配种及鲜精人工授精[10]。冻精经过冷冻和解冻过程后使有效精子浓度降低,且冷冻精子的质膜、顶体结构都会受到破坏,这些都影响着冻精受胎率。鲜精精子活率高、密度大、受胎率高,生产中平均受胎率能达到70%以上。但鲜精稀释后在高温保存时活率下降快,精子的有效存活时间较短,仅数小时过后即会失去应用价值[11]。
目前,常用的精液稀释液中糖类主要有果糖、葡萄糖及蔗糖等,且多数都应用于冻精,在杜泊羊鲜精稀释保存液上研究的相对少,尤其是D-半乳糖研究的更少。
精子活率是反映精子功能状态的一个重要指标,是保证精子通过雌性生殖道并与卵子相遇、穿透卵膜的重要条件[12]。张叔山等[13]比较了在冷冻保存液中添加不同水平海藻糖、蔗糖和乳糖对猪精液冷冻保护的效果,结果表明,添加3种双糖均能提高精液的冷冻保护效果,其中海藻糖和蔗糖的保护效果显著高于乳糖和对照组。
活率高的精子不等于精子质膜完整,精子质膜受到破坏,会导致其存活率和受精率的下降,死精子则完全丧失了膜的通透性[14-15],同样失去受精能力。精子质膜的完整性对于维持自身新陈代谢、获能、顶替反应、粘附和穿透卵母细胞透明带等至关重要[16],所以精子质膜完整性是精子死活的一个间接检测指标[17]。本研究显示混合糖效果最好,其次是D-半乳糖,48 h精子质膜完整率都大于60%,二者差异显著(P<0.05),再次是葡萄糖和果糖,蔗糖效果差。研究表明葡萄糖、果糖及D-半乳糖均能对精子的质膜完整率起到较好的保护作用,其中D-半乳糖效果优于葡萄糖和果糖;蔗糖效果差。
拥有完整的顶体才能发生顶体反应,这是受精成功的关键。如果精子的顶体落破损或缺失,顶体酶类丢失,受精过程就不能进行[18]。因此,顶体完整率是评价精液品质一项重要指标。本研究显示葡萄糖、果糖和D-半乳糖都能提高精子顶体完整率。72 h时,精子顶体完整率均大于60%,其中混合糖组最高,但与葡萄糖、果糖和D-半乳糖组相比无显著性差异(P>0.05)。说明葡萄糖、果糖和D-半乳糖在保护顶体完整过程中差别不大。
精子存活时间和存活指数检查与受精率密切相关,同时也是鉴定稀释液和精液处理效果的一种方法[19-20]。精子存活时间是指精子在体外的总生存时间,而精子生存指数是指平均存活时间,表示精子活率下降速度。精子存活时间越长,指数越大,说明精子生活率越强,品质越好[21]。本研究显示精子的有效存活时间葡萄糖、果糖和D-半乳糖和混合糖组较高,达到48 h以上,其中混合糖组最高达到57.7 h,与葡萄糖、果糖和D-半乳糖组相比差异显著(P<0.05);生存指数只有混合糖组达到60.0以上。
本研究中,有糖类添加的稀释保存液组精子各项指标都显著高于对照组,且差异极显著(P<0.01),不同糖类对精子的作用存在一定的差别。D-半乳糖除在质膜完整率上较葡萄糖、果糖好外,其他指标三者差异不显著(P>0.05);蔗糖效果较差,有的研究认为添加蔗糖的精液稀释液保存效果好,可能因为不同糖类对同一种动物精子保护效果不同,同一种糖对不同种动物精子冷冻保护效果也存在差别;对照效果最差。因混合糖中含有蔗糖,且蔗糖组效果较差,因此稀释液中添加葡萄糖、果糖和D-半乳糖混合效果可能会更好,有待进一步试验证实。
4结论
本研究表明,鲜精稀释保存液中添加葡萄糖、果糖和D-半乳糖的混合糖,有利于维持精液品质和延长精子在体外的有效存活时间;其次是添加D-半乳糖的精液稀释液;添加蔗糖的精液稀释液效果最差。
参考文献:
[1]Fernandez-Santos M R, Martinez-Pastor F, Garcia-Macias V, et al. Extender osmolality and sugar supplementation exert a complex effect on the cryopreservation of Iberian red deer (Cervus elaphus hispanicus) epididymal spermatozoa[J]. Theriogenology, 2007, 67(4): 738-753.
[2]包宋权,梁世忠,韦明宇,等.聚维酮碘对常温保存猪精子质量的影响[J].中国兽医学报.2011, 31(1): 118-125.
[3]高飞,岳奎忠,杨增明.猪精液液态保存的研究进展[J].中国畜牧杂志.2004, 4(6): 46-49.
[5]Gómez-Fernández J, Gómez-Izquierdo E, Tomás C, et al. Effect of different monosaccharides and disaccharides on boar sperm quality after cryopreservation[J]. Animal Reproduction Science, 2012, 133(1): 109-116.
[6]杨凌, 张乐颖, 袁明,等. 杜泊羊细管冻精不同稀释液效果的比较[J]. 中国畜牧杂志, 2007, 43(21):14-16.
[7]熊前, 吴衍, 李川武,等. 犬精液稀释液的筛选试验[J]. 中国畜牧兽医, 2010, 37(11):219-221.
[8]张利. 猪精子在液态保存过程中葡萄糖代谢的研究[D]. 哈尔滨:东北农业大学, 2014.
[9]张少华,张春香,岳文斌,等.稀释液中添加棉籽糖对冻融后绵羊精液品质的影响[J].中国畜牧兽医,2011, 38(12): 138-141.
[10]韩飞.不同浓度卵黄离心及精液透析处理对猪精子冷冻效果的影响[D].陕西 杨凌:西北农林大学,2009.
[11]赵金红,彭海梅,周鹏,等.酉州乌羊精液品质评定及稀释液配方研究[J].中国农学通报,2014,30(20): 6-10 .
[12]张婷.四种糖类对猪精液冷冻保存效果的研究[D].陕西 杨凌:西北农林科技大学,2008.
[13]张树山,李青旺,李刚,等.海藻糖、蔗糖和乳糖对猪精液冷冻保存效果的影响[J].西北农林科技大学学报:自然科学版,2006,34(6): 41-45.
[14]Burks D J, Saling P M. Molecular mechanisms of fertilization and activation of development[J]. Animal Reproduction Science, 1992, 28(1): 79-86.
[15]Malo C, Gil L, Gonzalez N, et al. Comparing sugar type supplementation for cryopreservation of boar semen in egg yolk based extender[J]. Cryobiology, 2010, 61(1): 17-21.
[16]李素文.细胞生物学试验指导[M].北京:高等教育出版社/施普林格出版社,2001.
[17]Agca Y, Gilmore J, Byers M, et al. Osmotic characteristics of mouse spermatozoa in the presence of extenders and sugars[J]. Biology of Reproduction, 2002, 67(5):1 493-1 501.
[18]李新红,邹兴淮,朱淑文,等.不同糖类对蓝狐精子常温及冷冻保存特性的影响[J].上海交通大学学报,2004, 22(4):334-338.
[19]张忠诚.家畜繁殖学[M].北京:中国农业出版社,2000.
[20]Saravia F, Wallgren M, Nagy S, et al. Deep freezing of concentrated boar semen for intra-uterine insemination: effects on sperm viability[J]. Theriogenology, 2005, 63(5):1 320-1 333.
[21]Amirat L, Tainturier D, Jeanneau L, et al. Bull semen in vitro fertility after cryopreservation using egg yolk LDL: a comparison with Optidyl○R, a commercial egg yolk extender[J]. Theriogenology, 2004, 61(5): 895-907.
Effect of Sugar Dilutions on Cryopreserved Fresh Semen Quality of Dorper Sheep
MAO Ran1,LI Qing-quan1,SHI Jian-hua1,WANG Min1,2,ZHANG Guang-he2,3,HAN Tian-long1,2,*
(1.ChifengAcademyofAgricultureandAnimalHusbandrySciences,Chifeng,InnerMongolia024031,China.
2.CollegeofVeterinaryMedicine,JilinUniversity,Changchun, 130062,China;
3.ChifengAgriculturalandLivestockProductsQualityandSafetyManagementStation,Chifeng,InnerMongolia024000,China.)
Abstract:To compare the effect of semen dilution supplemented with different sugars (glucose,fructose,galactose and sucrose) on the fresh semen quality of Dorper sheep,semen of three healthy Dorper sheep (3-year-old) were randomly divided into six groups,and added equal amounts of isothermal different sugars to semen dilutions,to detect their sperm motility,membrane integrity, acrosome integrity, survival time and survival index respectively at 0 h,6 h,24 h,30 h,48 h,54 h,72 h and 78 h. The results showed that the the sperm motility,the membrane integrity and the acrosome integrity were highest in semen dilution within mixture sugar; Compared with other groups, the difference is significant(P<0.05);D-galactose membrane integrity was better than glucose group and fructose group, the difference is significant(P<0.05),other indicators were not significant in other indexes (P>0.05), the addition of sucrose was poor,it is significantly different with other groups, the worst results was in the control group,there revealed extremely significant difference with other groups(P<0.01);Effective survival time and survival index of mixture sugar group was the highest. The results suggest that adding glucose, fructose and galactose mixture sugar to semen dilution works better in preserving the fresh semen of Dorper sheep.
Key words:Dorper sheep;semen extender;sugar;fresh semen;quality
[文章编号]1005-5228(2015)12-0024-05
[中图分类号]S811.5
[文献标识码]A
*[通讯作者]韩天龙(1983-),男,内蒙古赤峰人,在读博士,副研究员,主要从事临床兽医学与动物营养学研究。E-mail:hantian212@sina.com
[作者简介]毛冉(1985-),女,内蒙古赤峰人,硕士,助理研究员,主要从事临床兽医学研究。E-mail:maorank1@163.com
[基金项目]赤峰市农牧科学研究院自选项目(NkZZ201405)
*[收稿日期]2015-04-30修回日期:2015-05-11
