表达猪瘟病毒E0-E2基因重组腺病毒疫苗在兔体上的免疫原性分析
2015-02-27张小苗杨玉艾陶晓珊李晓成范根成孙永科云南农业大学动物科学技术学院云南昆明6500青岛易邦生物工程有限公司山东省动物疫苗重点实验室山东青岛664中国动物卫生与流行病学中心山东青岛660
张小苗,张 恒,杨玉艾,张 志,孙 健,陶晓珊,李晓成,范根成*,孙永科*(.云南农业大学动物科学技术学院,云南昆明6500;.青岛易邦生物工程有限公司山东省动物疫苗重点实验室,山东青岛664;.中国动物卫生与流行病学中心,山东青岛660)
表达猪瘟病毒E0-E2基因重组腺病毒疫苗在兔体上的免疫原性分析
张小苗1,2△,张恒2△,杨玉艾1,张志3,孙健2,陶晓珊2,李晓成3,范根成2*,孙永科1*
(1.云南农业大学动物科学技术学院,云南昆明650201;2.青岛易邦生物工程有限公司
山东省动物疫苗重点实验室,山东青岛266114;3.中国动物卫生与流行病学中心,山东青岛266032)
摘 要:研究表达猪瘟病毒E0-E2基因重组腺病毒疫苗(rAd-E0-E2)在兔体上的免疫原性,并确定其最小免疫保护剂量。将rAd-E0-E2按10倍梯度稀释为107.0IFU、106.0IFU、105.0IFU,分别免疫接种家兔,14 d后,用猪瘟脾淋苗对各组兔子进行攻毒。结果107.0IFU组和猪瘟脾淋苗组均未出现定型热反应(0/4),脾重/体重指数比值分别为0.055%、0.05%,脾组织切片均未见充血、淤血,用RT-PCR和IFA方法均未检测到脾脏内有猪瘟脾淋苗病毒;106.0IFU组3/4出现定型热反应,脾重/体重指数比值为0.074%,脾组织切片3/4可见充血、淤血,用RT-PCR和IFA方法可检测到3/4脾脏有猪瘟脾淋苗病毒;105.0IFU组和对照组全部出现定型热反应(4/4),脾重/体重指数比值分别为0.099%和0.102%,脾组织切片充血、淤血严重,用RT-PCR和IFA方法均可检测到兔子脾脏内有猪瘟脾淋苗病毒。结果表明与对照组均不保护和猪瘟脾淋苗组全部保护相比,rAd-E0-E2在兔体的最小免疫保护剂量为107.0IFU,本研究成功完成了rAd-E0-E2在兔体上的免疫原性分析。
关键词:猪瘟病毒;E0-E2基因;重组腺病毒疫苗;兔;免疫原性
猪瘟(Classical swine fever,CSF)是由黄病毒科瘟病毒属的猪瘟病毒(Classical swine fever virus,CSFV)引起的一种猪的高度接触性传染病,病死率极高,给世界养猪业造成了巨大的经济损失。我国面对这样的烈性传染病采用疫苗接种来预防其发生,降低发病率和死亡率。猪瘟疫苗的发展经历了早期的灭活疫苗、弱毒疫苗、基因工程疫苗。目前广泛使用的是弱毒疫苗,我国批准使用的弱毒疫苗是由中国兽医药品监察所研制的猪瘟兔化弱毒疫苗[1]。长期以来,猪瘟兔化弱毒疫苗的普遍使用,使CSFV野毒株及兔化弱毒抗原发生了变异,出现了慢性感染、隐性感染等非典型流行形式,很难区分猪群中的疫苗免疫猪和野毒感染猪,致使疫情难以控制,或造成免疫失败,这不但影响猪群中猪瘟的净化,而且给猪肉出口造成障碍[2-3]。为此,研制更安全、更高效可以进行鉴别诊断的新型基因工程标记疫苗是全世界养猪业的迫切要求。本实验室从pMD18-T-E0质粒、pMD18-T-E2质粒中扩增编码E0、E2基因,构建重组腺病毒穿梭质粒pAd Track-E0、pAd Track-E2。通过PET32a载体将E0和E2基因串联,形成PET-E0-E2,然后再将E0-E2克隆到腺病毒穿梭载体上得到重组腺病毒穿梭质粒pAd Track-E0-E2,转化到大肠埃希菌BJ5183感受态细胞中,得到重组腺病毒骨架载体pAd Easy-E0-E2,转染人胚胎肾细胞(HEK 293),获得了含有目的基因的重组腺病毒(rAd-E0-E2)[4-7]。通过对家兔接种10倍梯度稀释的rAd-E0-E2,14d后用猪瘟脾淋苗攻毒,每隔6h测兔体温,通过体温的变化、脾重/体重指数比(%)、脾脏组织病理学变化、RT-PCR和IFA方法对猪瘟脾淋毒攻毒兔进行检测和分离鉴定等技术共同判断说明rAd-E0-E2在兔体的免疫保护效力以及最小免疫保护剂量。分析表达猪瘟病毒E0-E2基因重组腺病毒疫苗(rAd-E0-E2)在兔体的免疫原性,确定出最小免疫保护剂量[8]。
1 材料与方法
1.1材料
1.1.1试验用病毒、疫苗、细胞、实验动物 猪瘟重组腺病毒疫苗(rAd-E0-E2),≥2×107.0IFU/mL[9],
其毒价测定采用IFA方法[10-11]得到,由青岛易邦生物工程有限公司技术中心(山东省动物疫苗重点实验室)冻干保存,作为试验样品稀释接种家兔;猪瘟活疫苗(兔源)简称猪瘟脾淋苗,批号201401,20头份/mL,由青岛易邦生物工程有限公司冻干苗车间生产,用于作为本试验的阳性对照;ST细胞,由本实验室液氮罐保存;1.5kg~3kg健康易感SPF家兔购自青岛康大兔业发展有限公司。
1.1.2主要试剂及仪器 双抗、1×PBS、80%冷丙酮、500 mL/L甘油,柱式动物RNAout提取试剂盒,北京天恩泽公司产品;两步法RT-PCR试剂盒、Taq PCR Master Mix,TaRaKa公司产品;体温计,上海鹿得医疗器械贸易有限公司产品;玻璃研磨均浆器,涿州市琦瑞玻璃制品厂产品;电子天平(JA1103型),上海民桥精密科学仪器有限公司产品;核酸电泳仪(YYD-8C型),北京六一仪器厂产品;PCR仪(Applied Biosystems),爱普拜斯应用生物系统贸易(上海)有限公司产品;BIO-RAD Gel Doc XR+凝胶成像系统,美国伯乐产品;CO2培养箱(RCO3000T-5-VBC),REVCO产品;荧光显微镜,Olympus公司产品。
1.2方法
1.2.1免疫前后体温测定 购回兔子的第3天开始上下午各测体温1次,连续测3d,从28只兔子中挑选体温波动不大(±0.5℃)的20只,随机分成5组,每组4只,1、2、3组按照107.0、106.0、105.0IFU/只剂量肌肉注射rAd-E0-E2疫苗;4组肌肉注射每头份150倍稀释的猪瘟脾淋苗;5组为生理盐水对照。同时上、下午各测体温1次,连续测3d。
1.2.2攻毒前后体温测定 免疫后第14d攻毒,用无菌生理盐水将每头份猪瘟脾淋苗稀释150倍,通过耳静脉注射给每组家兔,攻毒剂量为1mL/只,攻毒前2d和攻毒当天上、下午各测体温1次,攻毒24h后,每隔6h测体温1次,连续测3d至体温恢复正常。
1.2.3攻毒后脾重/体重指数 将攻毒后体温恢复正常的家兔称重、解剖取脾脏称重,计算脾重/体重指数比(%),通过图表说明rAd-E0-E2受保护组与未受保护组的差异情况,同时做脾脏切片,观察脾脏的病理变化。
1.2.4RT-PCR检测脾脏中猪瘟脾淋毒 取各组家兔脾脏用匀浆器充分研磨,按柱式动物RNAout提取试剂盒提取RNA,以猪瘟脾淋苗特异性引物进行RT-PCR检测脾脏中的猪瘟脾淋疫苗毒,进一步证明rAd-E0-E2的保护效力[12-14]。
1.2.5IFA分离鉴定脾脏中猪瘟脾淋毒 取各组家兔脾脏加PBS(含双抗)低温下充分研磨,组织悬液离心后经0.22μm滤器过滤。同时,将猪睾丸细胞系(ST细胞)铺平于6孔板中,当细胞长到80%单层时,接种过滤的悬液,盲传3代。将ST细胞用冷丙酮2℃~8℃固定30min,1×PBS洗涤3次,将1∶300稀释的猪瘟病毒特异性抗体加到固定好的ST细胞上,37℃孵育1h,1×PBS洗涤3次,再加1∶500稀释的FITC标记的兔抗猪IgG,37℃孵育1h,1×PBS洗涤3次,6孔板中每个孔加适量500 mL/L甘油,在荧光显微镜下观察试验结果[15]。
2 结果
2.1免疫前、免疫后实际测温结果
按照1.1的方法进行实际测温,将结果绘制时间-体温曲线(图1),从图1中可以看出,免疫前各组家兔体温波动不大;用rAd-E0-E2(107.0、106.0、105.0IFU)免疫组家兔体温在正常范围内,用猪瘟脾淋苗免疫组家兔出现兔体反应热(≥40.5℃)与常规猪瘟脾淋苗检测结果一致[16]。

图1 免疫前后实际测温Fig.1 Actual temperature detected before and after immunization
2.2rAd-E0-E2对免疫兔的保护作用
免疫14d后,各组兔子用猪瘟脾淋苗攻毒,将实际测温情况绘制时间-体温曲线(图2),从图2中可以看出,攻毒前2d各组免疫兔体温在正常波动范围内(<40.5℃),攻毒后107.0IFU组(0/4)和猪瘟脾淋苗组(0/4)均未出现定型热反应,106.0IFU组(3/4)出现定型热反应,105.0IFU(4/4)出现定型热反应,对照组(4/4)出现定型热反应[17-18]。
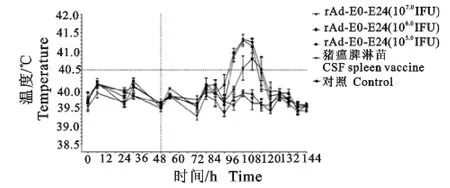
图2 用猪瘟脾淋毒攻毒后免疫兔产生的定型热反应Fig.2 Fever reactions of the immunized rabbits following challenge with CSF spleen virus
2.3攻毒后脾重/体重指数
经脾重/体重指数比分析发现(图3),107.0IFU组与105.0IFU组、107.0IFU组与对照组差异显著(P<0.05);猪瘟脾淋苗组与105.0IFU组、猪瘟脾淋苗组与对照组异显著(P<0.05);然而,107.0IFU组与106.0IFU组、107.0IFU组与猪瘟脾淋苗组、106.0IFU组与105.0IFU组、106.0IFU组与猪瘟脾淋苗组、106.0IFU组与对照组、105.0IFU组与对照组差异不显著(P>0.05)。

图3 脾重/体重指数比Fig.3 Percentage of spleen weight/body weight
2.4脾脏病理组织学观察
将攻毒后体温趋于正常的兔子剖检,取脾脏做石蜡切片,显微镜下观看脾脏病理组织变化(图4)。107.0IFU组(图4A)攻毒后脾组织切片未见充血、淤血;106.0IFU组(图4B)攻毒后脾组织切片未见充血、淤血,而106.0IFU组(图4C)攻毒后脾组织切片充血、淤血严重;105.0IFU组(图4D)攻毒后脾组织切片充血、淤血严重;猪瘟脾淋苗组(图4E)攻毒后脾组织切片未见充血、淤血;对照组(图4F)攻毒后脾组织切片充血、淤血严重。
2.5RT-PCR检测攻毒后免疫兔脾脏内猪瘟脾淋毒病毒
以猪瘟脾淋苗特异性引物为模板进行RT-PCR扩增,经琼脂糖凝胶电泳检测,结果表明,107.0IFU组(0/4)和猪瘟脾淋苗组(0/4)攻毒后均未检测到猪瘟脾淋苗病毒,对照组(4/4)均检测到猪瘟脾淋苗病毒;106.0IFU组(3/4)能检测到猪瘟脾淋苗病毒、105.0IFU组(4/4)均检测到猪瘟脾淋苗病毒(表1)。

图4 不同组脾脏病理组织学观察结果(HE,200×)Fig.4 Histopathological observation results of spleen in different groups(HE,200×)
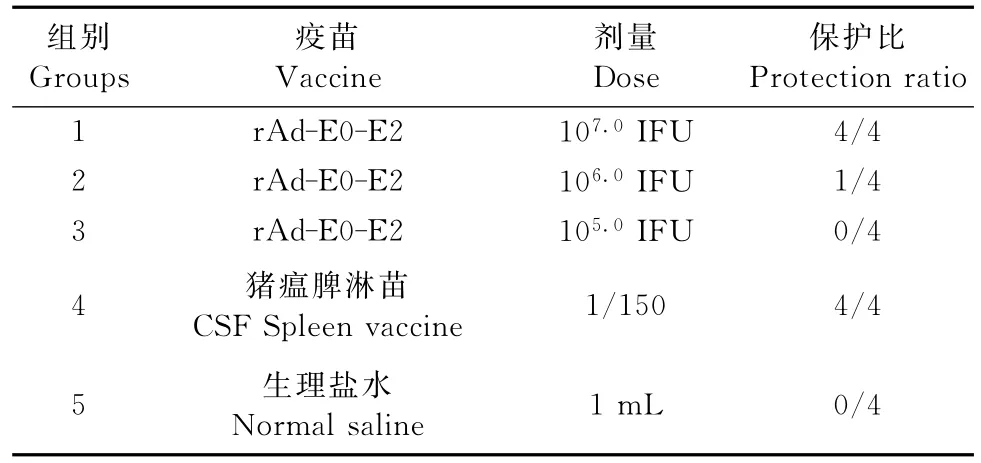
表1 RT-PCR检测猪瘟脾淋毒病毒Table 1 RT-PCR detection of CSF spleen virus
2.6IFA分离鉴定脾脏中猪瘟脾淋毒
间接免疫荧光(IFA)结果显示,107.0IFU组(图5A)和猪瘟脾淋苗组(图5E)均未出现特异性绿色荧光(0/4);而对照组(图5F)均出现特异性绿色荧光(4/4);106.0IFU组(图5B)能起保护作用的兔子IFA检测未出现特异性绿色荧光(1/4),而106.0IFU组(图5C)没有能起保护作用的兔子IFA检测出现特异性绿色荧光(3/4);105.0IFU组(图5D)IFA检测出现特异性绿色荧光(4/4)。
3 讨论
本研究是在前期已经构建的表达猪瘟病毒E0-E2基因重组腺病毒疫苗(rAd-E0-E2)的基础上,以SPF家兔作为实验动物模型,通过测兔体定型热反应、脾重/体重指数比、RT-PCR、IFA、病理组织学变化等免疫学、病理学、分子生物学技术共同评价了rAd-E0-E2在兔上的免疫保护效力。

图5 不同组脾脏IFA特异性鉴定(200×)Fig.5 Specificity identification of spleens in different groups by indirect IFA(200×)
通过以上方法比较分析发现,107.0IFU组和猪瘟脾淋苗组均未出现定型热反应(0/4);脾组织切片未见充血、淤血;用RT-PCR和IFA方法均未检测到兔子脾脏内猪瘟脾淋苗病毒,说明rAd-E0-E2 (107.0IFU)在兔体的免疫攻毒保护试验中起到保护作用(4/4)。106.0IFU组出现定型热反应(3/4);相对应的兔脾组织切片可见充血、淤血(3/4);用RTPCR和IFA方法可检测到对应兔子脾脏内猪瘟脾淋苗病毒(3/4),说明rAd-E0-E2(106.0IFU)在兔体的免疫攻毒保护试验中起到保护作用(1/4)。105.0IFU组和对照组全部出现定型热反应(4/4);脾组织切片充血、淤血严重(4/4);用RT-PCR和IFA方法均可检测到兔子脾脏内猪瘟脾淋苗病毒(4/4),说明rAd-E0-E2(105.0IFU)在兔体的免疫攻毒保护试验中没有起到保护作用(0/4)。以上结果进一步分析表明,rAd-E0-E2可诱导机体产生猪瘟特异性免疫,此抗体在最小免疫保护剂量是107.0IFU时对猪瘟脾淋苗病毒攻击具有保护作用。试验中脾重/体重指数比、RT-PCR、IFA、病理组织学变化检测结果与家兔体温反应结果一致,四种试验方法检测结果可以有效地对体温反应可疑或者轻热的家兔进行判定,避免了体温反应结果产生的不确定性。本试验结果的一致性为四种试验方法用于rAd-E0-E2在家兔上的免疫原性分析提供有力依据。
根据中华人民共和国兽用生物制品规程(2000版)和中华人民共和国兽药典(2010年版)规定,现行的猪瘟疫苗免疫效力检验主要依靠家兔或猪进行动物试验[19-20]。因用猪进行检验成本太高、不易操作、耗时长,故在生产实际中多采用兔体定型热反应,但是兔体定型热反应仍然存在试验耗时、操作繁琐、重复性较差、敏感性较低等缺点,且受试验动物的个体差异、环境因素等多方面影响,因此本试验通过比较rAd-E0-E2家兔体温反应热与脾重/体重指数比、RT-PCR、IFA、病理组织变化检测结果的相关性,给出了脾重/体重指数比、RT-PCR、IFA、病理组织学变化等方法用于rAd-E0-E2在家兔上的免疫原性分析的可行性。本研究依然采用家兔进行效检,同时用以上四种方法进行验证,避免了传统方法因家兔质量和环境等因素对体温检测结果的影响,提高了检测结果的可靠性和可重复性。
本试验通过表达猪瘟病毒E0-E2基因重组腺病毒疫苗(rAd-E0-E2)在兔体上的免疫原性分析,不仅能够检验rAd-E0-E2的保护效力,还确定出最小免疫保护剂量,有利于rAd-E0-E2效力质量检测应用,更对后期的大规模生产培养工艺优化具有积极的评价指导作用,具有广阔的应用前景。
参考文献:
[1] Sun S Q,Yin S H,Guo H C,et al.Genetic typing of classical swine fever virus isolates from China[J].Transb Emerg Dis,2013,60(4):370-375.
[2] Leifer I,Everett H,Hoffmann B,et al.Escape of classical swine fever C-strain vaccine virus from detection by C-strain specific real-time RT-PCR caused by apoint mutation in the prime-binding site[J].J Virol Meth,2010,166(1-2):98-100.
[3] Everett HE,Crudgington BS,Sosan-Souule O,et al.Differential detection of classical swine fever virus challenge strains in C-strain vaccinated pigs[J].BMC Vet Res,2014,10(1):281.
[4] 孙永科,杨玉艾,张彦明,等.表达猪瘟病毒石门株E0抗原的重组腺病毒构建及免疫性的研究[J].畜牧兽医学报,2007,38 (5):482-487.
[5] 孙永科,杨玉艾,张彦明,等.表达猪瘟病毒石门株E2抗原的重组腺病毒构建及免疫性研究[J].病毒学报,2007,23(2):137-141.
[6] 杨玉艾,初晓辉,孙永科,等.猪瘟病毒E0和E2蛋白融合表达的重组腺病毒构建及免疫保护性研究[J].中国预防兽医学报,2010,32(6):419-423.
[7] 孙永科.表达猪瘟病毒石门株E0/E2基因重组腺病毒的构建
及其免疫效果研究[D].陕西杨凌:西北农林科技大学,2007.
[8] 李传龙,张 恒,崔治中,等.ALV-J相关的鸡急性纤维肉瘤发病模型的建立[J].中国农业科学,2012,45(3):548-555.
[9] Sun Y K,Yang Y A,Zheng H L.Co-expression of Erns and E2 genes of classical swine fever virus by replication-defective recombinant adenovirus completely protects pigs against virulent challenge with classical swine fever virus[J].Res Vet Sci,2013,94:354-360.
[10] 张 恒,李传龙,崔治中,等.禽白血病A亚群病毒gp85的单因子血清制备及其特异性鉴定[J].微生物学报,2011,51(1):134-140.
[11] 张恒,范根成,杜元钊,等.一种猪瘟病毒基因重组腺病毒载体疫苗病毒含量测定方法[P].中华人民共和国国家知识产权局.CN 104535764A,2015.04.22.
[12] 蒋 卉,戴志红,王在时,等.猪瘟兔化弱毒疫苗效力检验替代方法研究Ⅰ家兔效力检验ELISA方法初探[J].中国兽医杂志,2013,49(5):9-12.
[13] 祖立闯,谢金文,沈志强,等.猪瘟疫苗质量的替代检验方法研究进展[J].动物医学进展,2015,36(2):76-79.
[14] 陈 锴,姚华伟,王长江,等.荧光定量PCR作为猪瘟兔化弱毒疫苗效价检验替代方法的研究与应用[J].中国农业科学,2013,46(1):162-169.
[15] 李春红,唐满华,陈瑞爱.猪瘟兔化弱毒疫苗效检替代方法研究进展[J].当代畜牧,2014(12):34-38.
[16] 何 雷,张彦明,徐彦召,等.共表达猪瘟病毒E2基因和猪白细胞介素2基因的重组腺病毒的构建及其免疫原性研究[J].病毒学报,2010,26(5):385-391.
[17] 何 雷,张彦明,向 华,等.表达猪白介素2基因重组腺病毒的构建及其免疫增强作用[J].西北农业学报,2010,19(11):1-7.
[18] 孙 元,祁巧芬,仇华吉,等.表达猪瘟病毒E2蛋白的重组腺病毒的构建及其在兔体内的免疫原性分析[J].生物工程学报,2008,24(10):1734-1739.
[19] 农业部第四届兽用生物制品规程委员会.中华人民共和国兽用生物制品规程[M].北京:化学工业出版社,2000.
[20] 中国兽药典委员会.中华人民共和国兽药典[M].北京:中国农业出版社,2011.
Immunogenicity Analysis of Recombinant Adenoviruses Expressing E0-E2 Genes of Classical Swine Fever Virus Vaccine in Rabbits
ZHANG Xiao-miao1,2,ZHANG Heng2,YANG Yu-ai1,ZHANG Zhi3,
SUN Jian2,TAO Xiao-shan2,LI Xiao-cheng3,FAN Gen-cheng2,SUN Yong-ke1
(1.College of Animal Science and Technology,Yunnan Agricultural University,Kunming,Yunnan,650201,China;
2.Key Laboratory for Animal Vaccine of Shandong Province,YEBIO Bioengineering Co.Ltd of Qingdao,
Qingdao,Shandong,266114,China;3.China Animal Health and Epidemiology Center,Qingdao,Shandong,266032,China)
Abstract:Study on the immunogenicity of recombinant adenoviruses expressing E0-E2genes of classical swine fever virus vaccine(rAd-E0-E2)in rabbits and determination of the minimum vaccination dose were conducted.Ten-fold dilution of rAd-E0-E2into 107.0IFU,106.0IFU,105.0IFU was made.Rabbits were vaccinated by each dilution and challenged with CSF spleen vaccine virus 14dpi.In group 107.0IFU and group CSF spleen vaccine,there were no Stereotypia thermal response(0/4),the mean value of spleen weight/ body weight in both groups were respectively 0.055%,0.05%,the histopathologic examination of the spleens turned out without hyperemia or congestion.There was no CSF spleen vaccine virus detected by RT-PCR and IFA methods;In Group 106.0IFU,3/4rabbits showed Stereotypia thermal response,the mean value of spleen weight/body weight was 0.074%,the histopathologic examination of the spleens showed 3/ 4hyperemia or congestion.3/4CSF spleen vaccine virus is detected by RT-PCR and IFA methods;In Group 105.0IFU and the control group,all appeared Stereotypia thermal response(4/4),the mean values of spleen weight/body weight in both were respectively 0.099%,0.102%,the histopathologic examination of the spleens showed serious hyperemia and congestion,CSF spleen vaccine virus was detected by RT-PCR and IFA methods.Compared to the control group,which offers 0% protection and group CSF spleen vaccine,which offers 100% protection,the minimum vaccination dose of rAd-E0-E2to protect the rabbit is 107.0IFU.This study successfully completed the immunogenicity analysis of rAd-E0-E2and detemined the minimum vaccination dose in rabbits.
Key words:Classical swine fever virus;E0-E2gene;recombinant adenovirus vaccine;rabbit;immunogenicity
作者简介:张小苗(1989-),女,云南保山人,硕士研究生,主要从事分子病原学与免疫学研究。张 恒(1987-),男,山东新泰人,硕士,兽医师,主要从事动物分子病毒学与新型动物疫苗研究。△同等贡献作者。*通讯作者
基金项目:云南省高校兽医公共卫生重点实验室资助(A3007954)
收稿日期:2015-07-09
中图分类号:S852.651
文献标识码:A
文章编号:1007-5038(2015)09-0008-05