欧洲型猪繁殖与呼吸综合征病毒感染仔猪病理学特征及其组织内病毒分布
2015-02-27刘丽颖王辉暖周铁忠辽宁医学院畜牧兽医学院辽宁锦州200吉林大学动物医学院吉林长春0062营口市动物疫病预防控制中心辽宁营口5004
李 冰,刘丽颖,王辉暖,周铁忠*(.辽宁医学院畜牧兽医学院,辽宁锦州200;2.吉林大学动物医学院,吉林长春0062;.营口市动物疫病预防控制中心,辽宁营口5004)
欧洲型猪繁殖与呼吸综合征病毒感染仔猪病理学特征及其组织内病毒分布
李冰1,2,刘丽颖3,王辉暖1,周铁忠1*
(1.辽宁医学院畜牧兽医学院,辽宁锦州121001;2.吉林大学动物医学院,吉林长春130062;3.营口市动物疫病预防控制中心,辽宁营口115004)
摘 要:为了研究仔猪感染欧洲型猪繁殖与呼吸综合征(PRRS)的病理学特征及其病毒在组织内的分布特点,用辽宁分离毒株EU-PRRSV LNEU12接种健康仔猪14d后,扑杀所有仔猪,观察病理学特征并采用免疫组织化学方法分析组织内抗原分布情况。结果表明,欧洲型PRRS主要的病理变化是多发性间质性肺炎和淋巴结炎;病毒主要分布在肺脏、淋巴结、脾脏和脑组织中,其次为肝脏和肾脏。证明PRRS典型病理变化的产生与PRRSV分布情况具有明显的相关性。
关键词:猪繁殖与呼吸综合征病毒;欧洲型;病理学特征;病毒分布;仔猪
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome viruses,PRRSV)引起猪的以母猪繁殖障碍和各种年龄段猪呼吸系统障碍为特征的传染病[1]。PRRS自1987年首次发生于美国以来,北美、欧洲及亚洲等多个国家均有发生和流行,给世界养猪业造成巨大的经济损失,已经成为危害全球养猪业最严重的传染病之一[2]。PRRSV是一种有囊膜、正链RNA病毒,属于动脉炎病毒科动脉炎病毒属成员[3]。目前,PRRSV主要分为2个基因型,即基因Ⅰ型(欧洲型)和基因Ⅱ型(美洲型)。研究表明,不同基因型毒株的毒力有所不同,而引起发病猪的临床症状却比较相似,其中美洲型毒株引起的呼吸道症状更加严重[4]。1991年初中国台湾首次暴发以来,PRRS已在中国普遍存在,特别是在西南地区猪群感染率高达90%,而且所分离的毒株(包括HP-PRRSV)均以美洲型为主[5]。2011年在北京、内蒙古首次分离到PRRSV欧洲型毒株以来,福建、江西、浙江、辽宁等地陆续分离到了欧洲型毒株,而且猪只感染有上升趋势[6-8]。目前,我国关于PRRSV的研究多数集中在美洲型毒株,而对近年来分离的欧洲型PRRSV缺乏系统研究。本试验采用欧洲型猪繁殖与呼吸综合征病毒辽宁分离株(EUPRRSV LNEU12)感染仔猪,观察病理学特征及分析组织内抗原的分布情况,为进一步研究病毒在猪体内的持续感染状况和阐明EU-PRRSV的致病机制奠定理论基础。
1 材料与方法
1.1材料
1.1.1毒株 欧洲型猪繁殖与呼吸综合征病毒辽宁分离株LNEU12(KM196101),由辽宁医学畜产品质量安全与工程省级重点实验室保存。
1.1.2试验用动物 30日龄健康仔猪5头,由辽宁医学院实验动物中心提供,经RT-PCR检测PRRS抗原为阴性。随机分为2组,A组3头为试验组,B组2头为对照组。猪只的饲养管理按照常规程序封闭饲养。
1.1.3主要试剂 DAB、兔抗猪二抗为上海索莱宝生物科技有限公司产品;EU-PRRS阳性血清由军事医学科学院军事兽医研究所馈赠;防脱片为北京中杉金桥生物技术有限公司产品;甲醛、苏木素、PBS缓冲液、柠檬酸盐缓冲液、30 mL/L甲醇-H2O2溶液、盐酸酒精分化液等按常规方法配制。
1.2方法
1.2.1人工感染 按照文献[9]建立的人工感染方法进行病毒接种。将试验组猪只饲养至30日龄时,A组滴鼻接种EU-PRRSV LNEU12株的细胞培养物2mL/头(104.8TCID50/mL);B组滴鼻接种无PRRSV的细胞培养物2mL/头。隔离饲养,每天观察仔猪临床表现,于攻毒14d后扑杀所有猪只。
1.2.2病理剖检及样品采集 攻毒14d后扑杀所有猪只,按常规的病理剖检技术进行尸检,并详细记录各器官的病理变化,同时采集病死猪的肺、淋巴结、脑、心、肝、脾、肾、肾上腺和部分空肠,用100mL/L福尔马林溶液固定。
1.2.3病原检测 无菌操作挑取攻毒猪只的脾脏、肺脏,在血琼脂平板上划线进行细菌分离,经37℃培养24h后观察结果。同时采集试验猪的肺、脾、肾、淋巴结等组织,经混样处理,采用张战峰等[10]建立的RT-PCR方法检测试验猪EU-PRRSV感染情况。另外,采用已建立的方法对试验猪进行NAPRRSV、CSFV的PCR检测[11-12]。
1.2.4病理组织学观察 按常规石蜡切片技术方法制作组织切片,经HE染色,应用光学显微镜观察病理组织学变化并记录结果。
1.2.5免疫组织化学检测 采用间接免疫组织化学酶标染色法(SABC),将防脱组织切片60℃烤片2h,水化后高压抗原修复,经100mL/L小牛血清封闭后,滴加EU-PRRS阳性血清(一抗),湿盒4℃过夜,甩干摇洗后加入羊抗猪过氧化物酶标抗体(二抗)湿盒37℃孵育30min,DAB显色后,经苏木素复染、盐酸分化、脱水、封片、镜检。试验设一抗阴性对照,在阴性对照成立情况下,被检样品中出现棕褐色显色,则判为阳性;不出现棕褐色显色,则判为阴性。
2 结果
2.1病原检测结果
血琼脂血平板上没有任何细菌生长;对试验猪的组织进行EU-PRRSV的RT-PCR检测,均可扩增出约576bp大小的条带(图1),美洲型PRRSV传统毒株、变异毒株和猪瘟病毒的检测结果均为阴性。2.2 剖检变化结果
试验猪A组接种病毒3d后,体温升高到39.6℃,攻毒第9天时体温最高达40.5℃。出现厌食、嗜睡、呼吸困难、耳部皮肤轻度发绀等症状,对照猪B组未出现明显的异常表现。攻毒14d后扑杀所有猪只,按常规的病理剖检技术进行尸检。主要病变在肺和淋巴结,肺脏间质增宽,有不同程度的充血、出血,暗红或灰红色病灶处实变,切面气管腔内有黏液性分泌物;全身淋巴结肿大,其中肺门淋巴结、下颌淋巴结、腹股沟深浅淋巴结、肠系膜淋巴结肿大明显,切面多汁;脑软膜血管充血明显;肝脏表面有大小不等云雾样灰白色病灶;脾脏轻度肿大、淤血;肾脏有轻度的充血、出血;其他器官变化不明显(图2)。
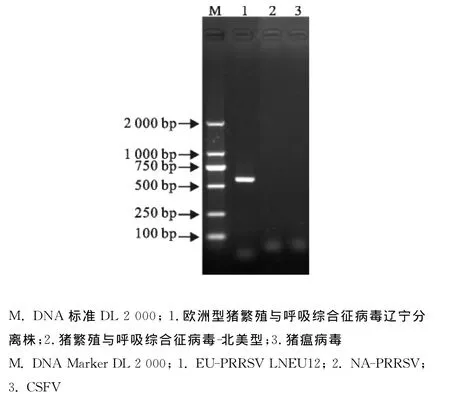
图1 感染仔猪病原学PCR检测结果Fig.1 PCR results for pathogens of infected piglets
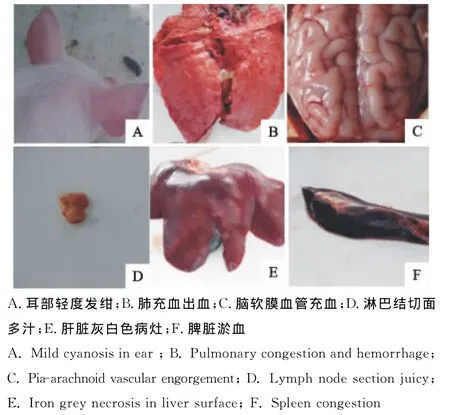
图2 感染仔猪的主要症状与剖检变化Fig.2 The main clinical signs and lesions of infected piglets
2.3病理组织变化
肺主要呈多发性间质性肺炎,肺间质增宽,间质内分散多量的细胞碎片和红细胞,肺泡壁不完整,个别肺泡腔内含有浆液、少量白细胞和红细胞;淋巴结组织内淋巴细胞、网状细胞坏死,数量减少,淋巴窦内可见多核巨噬细胞,淋巴组织充血、大量红细胞渗出。脑血管扩张充血出血,血管壁外围间隙增宽有少量炎性细胞,神经细胞不同程度变性坏死,出现卫星现象和噬神经现象;脾脏淤血、出血,淋巴细胞、网状细胞坏死,脾窦间隙内布满大量红细胞;肝脏淤血、肝细胞变性;肾小管上皮细胞发生颗粒变性、水泡变性和脂肪变性,严重的发生坏死,间质充血、出血及炎性细胞浸润,详见图3。
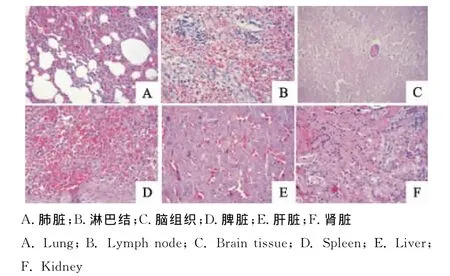
图3 感染仔猪的病理组织变化(HE,200×)Fig.3 The histopathological lesions of infected piglets(HE,200×)
2.4免疫组织化学观察结果
免疫组织化学观察结果显示,EU-PRRSV存在于多种组织器官,主要有肺、淋巴结、脾脏、脑组织、肝脏、肾脏,其中阳性强度较高的器官为肺脏、淋巴结、脾脏和脑组织,其次为肝脏和肾脏。心肌、空肠和肾上腺组织未发现阳性细胞分布。
肺间质的巨噬细胞胞浆、毛细血管内皮细胞胞浆检测到了阳性抗原;淋巴结的阳性细胞主要分布在髓索内、皮质和髓质淋巴窦周围;脑组织神经元胞浆和胶质细胞见有阳性反应;脾脏的阳性细胞主要分布于脾小体和脾窦周围;肝脏的汇管区浸润的少量巨噬细胞中检测到阳性抗原;肾小管间质的单核细胞和毛细血管内皮细胞检测到阳性抗原,详见图4。
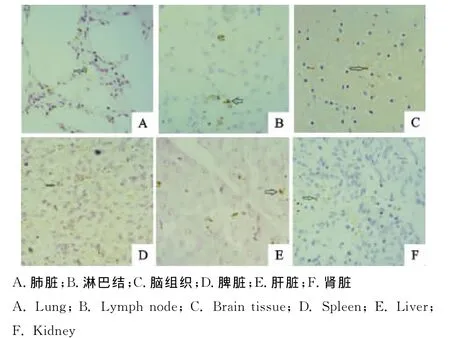
图4 免疫组织化学染色结果(IHC,400×)Fig.4 Immunohistochemical staining results(IHC,400×)
3 讨论
本研究用欧洲型分离毒株进行人工感染健康仔猪后,试验猪出现了发热、厌食、呼吸困难、皮肤轻度发绀,但未出现急性死亡现象;剖检观察到病变主要在肺脏和淋巴结,其次为脑和肾脏。Kim H K等[7]报道用EU-PRRSV G2446株攻毒仔猪,其剖检变化主要在肺脏、淋巴结和心肌组织,这一特点与本试验结果基本相似。1996年郭宝清等报道引起仔猪发生蓝耳病的毒株为美洲型,其发病特点为呼吸困难、耳部皮肤发绀、体温升高、全身淋巴结肿大、肺脏淤血、间质增宽等,以上特点与本试验结果也很相似。这也证实了不同基因型的PRRSV引起猪发病后的症状与病变基本相似的特点(高致病性猪蓝耳病除外)。但是,本次攻毒试验中发现除了肺、淋巴结和脑以外,在肾脏和胃黏膜也出现了病理变化,这可能与分离株的毒力有关,也可能与试验环境条件等因素有一定关系。目前认为猪繁殖与呼吸障碍综合征是多因素共同作用的结果,临床和人工复制的差异较大,试验感染不能全部复制出临床上典型的病变。
对试验感染的仔猪组织器官进行组织病理学观察发现,绝大部分脏器都有明显的组织学病变,其中肺脏的多发性局灶性间质性肺炎最为明显,其次为淋巴结炎和非化脓性脑炎变化,这与Kim H K等报道的欧洲型猪繁殖与呼吸综合征的病理组织学变化基本一致。另外,本试验也观察到了脾脏、肝脏和肾脏的眼观病变,但病变较轻且不明显,而显微镜下可观察到一定组织学病变并且免疫组化染色后也可观察到阳性细胞,这说明了EU-PRRSV可以在脾脏、肝脏和肾脏中复制。
通过间接免疫组化法对试验猪主要器官中的抗原进行了定位,发现EU-PRRSV抗原主要存在于肺脏、淋巴结、脑、脾脏、肝脏和肾脏的巨噬细胞中,并且存在于这些细胞的胞浆内,这表明PRRSV的原始靶细胞为巨噬细胞,病毒的复制是在胞浆内进行的。从各组织中出现阳性信号的强弱程度来看,肺脏、淋巴结的阳性信号最强,脑组织、脾脏的阳性信号依次较弱,肝脏、肾脏的阳性信号最弱,心肌、空肠和肾上腺组织未发现阳性细胞。从EU-PRRS病猪的病理组织学观察结果来看,肺脏、淋巴结、脑组织、肝脏、脾脏和肾脏等组织器官均有病理变化,剖检可见其典型病变在肺脏、淋巴结和脑组织,这与免疫组化所检测到的PRRSV抗原分布结果相一致,以上研究结果可以证明PRRS典型病理变化的产生与PRRSV分布情况具有明显的相关性。
参考文献:
[1] 敬晓棋,孟建斌,高晓阳,等.猪繁殖与呼吸综合征病毒免疫抑制研究进展[J].动物医学进展,2012,33(10):75-78.
[2] Neumann E J,Kliebenstein J B,Johnson C D,et al.Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States[J].J Am Vet Med Assoc,2005,227(3):385-392.
[3] Cavanagh D.Nidovirales:A new order comprising Coronaviridae and Arteriviridae[J].Arch Virol,1997,142(3):629-633.
[4] Han K,Seo H W,Park C,et al.Comparative pathogenesis of type 1(European genotype)and type 2(North American genotype)porcine reproductive and respiratory syndrome virus in infected boar[J].Virol J,2013(10):156.
[5] 代 军,雷 蕾,任志华.猪繁殖与呼吸综合征防控研究进展[J].动物医学进展,2014,35(4):97-101.
[6] Nanhua Chen,Zhen Cao,Xiuling Yu,et al.Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China[J].J Gen Virol,2011,92 (7):880-890.
7 Zhou ZLiu QHu Det al.Complete genome sequence of a European genotype porcine reproductive and respiratory syndrome virus in China[J].Genome Announc,2013,1(3):e00175-13.
[8] Li B,Gao S,Zhou T.et al.Complete genome sequence of European genotype porcine reproductive and respiratory syndrome virus strain LNEU12in northern China[J].Genome Announc,2014,2(5):e00957-14.
[9] Kim H K,Lee C S,Kang B K,et al.Experimental infection of a newly emerging Korean type I porcine reproductive and respiratory syndrome virus isolate in colostrum-deprived pigs[J]. Virol J,2011,17(8):177.
[10] 张战峰,李肖梁,张 莹,等.欧洲型PRRSV RT-PCR检测方法的建立及ORF7基因序列比较[J].动物医学进展,2007,28 (5):26-29.
[11] 周铁忠.辽宁省猪繁殖与呼吸综合征分子流行病学调查及免疫防制研究[D].吉林长春:吉林大学畜牧兽医学院,2010.
[12] 于学辉,刘内生,姜 平,等.用RT-PCR技术诊断猪繁殖与呼吸综合征[J].畜牧与兽医,1999,31(1):18-20.
Pathological Features and Antigen Distribution in Tissues of Piglets Infected with EU-PRSSV
LI Bing1,2,LIU Li-ying3,WANG Hui-nuan1,ZHOU Tie-zhong1
(1.College of Animal Husbandry and Veterinary Medicine,Liaoning Medical University,Jinzhou,Liaoning,121001,China;
2.College of Veterinary Medicine,Jilin University,Changchun,Jilin,130062,China;
3.Yingkou Center for Disease Control and Prevention,Yingkou,Liaoning,115004,China)
Abstract:In order to investigate the pathological features of piglets infected with European-type porcine reproductive and respiratory syndrome viruses and its distribution characteristics of the viruses in the tissues,healthy piglets were inoculated with isolated EU-PRRSV LNEU12.After 14days,all the piglets were killed to observe the pathological features and analyze the distribution of antigen in the tissues using immunohitochemical method.The results showed that the main pathological lesions of European-type PRRS are multiple interstitial pneumonia and lymphadenitis;Viruses are mainly distributed in the lungs,lymph nodes,spleen,and brain tissues,while livers and kidneys in the second place.The results proved that the generation of typical pathological lesions of PRRS is obviously relevant to the antigen distribution of PRRSV.
Key words:Porcine reproductive and respiratory syndrome;European-type;pathological feature;antigen distribution;piglet
作者简介:李 冰(1975-),男,辽宁锦州人,兽医博士,主要从事家畜传染病学研究。*通讯作者
基金项目:辽宁省教育厅科研项目(L2014327);辽宁省百千万人才工程资助项目(2014921012)
收稿日期:2015-01-24
中图分类号:S852.31;S852.659.6
文献标识码:A
文章编号:1007-5038(2015)07-0067-04