小麦及其近缘物种中类燕麦储藏蛋白Avenin-like基因的克隆综述
2015-02-27孙杨柳
孙杨柳
(湖北省恩施州生产力促进中心,湖北恩施 445000)
小麦及其近缘物种中类燕麦储藏蛋白Avenin-like基因的克隆综述
孙杨柳
(湖北省恩施州生产力促进中心,湖北恩施 445000)
介绍了小麦的品质及品质的形成、小麦的储藏蛋白及储藏蛋白的分类。综述了近年来关于类燕麦储藏蛋白Avenin-like基因发现、Avenin-like基因的胚乳特异性表达的时空表达模式以及Avenin-like基因的启动子的作用元件和时空表达特异性研究。
Avenin-like基因;胚乳特异性表达;启动子
小麦的品质主要包含营养品质和加工品质[1]。其中小麦的营养品质主要是指所含的营养物质对生物体营养需要的适合性和满足程度,包括营养成分含量的多少和各种营养成分是否全面和均衡。小麦的加工品质是指小麦籽粒对制粉以及制作不同食品的适应性和满足程度,主要包括一次加工品质即磨粉品质和二次加工品质即食品加工品质。磨粉品质是指籽粒在辗磨为面粉的过程中,品质对磨粉工艺的满足程度,主要包括籽粒容重、灰分、硬度、出粉率、面粉白度等。小麦的食品加工品质包括烘烤和蒸煮后的质量,烘烤品质主要指出粉率、灰分、粉色、细度、沉降值、α-淀粉酶活性等指标,蒸煮品质主要指吸水率、搅拌特性、面筋延伸性和抗延性[2]。物质组成决定加工品质,小麦加工品质很大程度上取决于面团流变学特性,与小麦储藏蛋白的组分关联密切[3-8]。
面粉加水之后经过搅拌后形成面团,其大致的分子机理为:谷蛋白亚基通过分子间二硫键交联,然后形成纤维状大分子聚合体,从宏观上表现为弹性的形成。醇溶蛋白在分子内在二硫键、氢键等的共同作用下形成球状结构,通过非共价键穿插在谷蛋白网络构架中,在宏观上表现为面团具有延展性[9]。面团的弹性和黏性用面团的流变学特性来描述。
1924年,Osborne[10]根据种子中贮藏蛋白的溶解条件,将贮藏蛋白分为两大类。其中第一大类为面筋蛋白,主要含有麦谷蛋白和麦醇溶蛋白。麦谷蛋白约占45%,可以溶于稀酸或稀碱,由17~20条多肽链构成,呈纤维状,水合时无黏性,弹性好,决定面团弹性。麦醇溶蛋白约占40%,醇溶性,由一条多肽链构成,仅有分子内二硫键和较紧密的三维结构,呈球形,多由非极性氨基酸组成,富含谷氨酰胺和脯氨酸,故水合时黏性好,参与面团延展性[11]。第二大类主要为非面筋蛋白,主要包括清蛋白和球蛋白。清蛋白可溶于水或低浓度盐溶液,约占蛋白总量的2.5%;球蛋白可溶于稀释的盐溶液中但不能溶于水,约占蛋白总量的5%。
1 类燕麦储藏蛋白Avenin-like基因及蛋白的发现
1.1 类燕麦储藏蛋白Avenin-like基因的发现2001年,Anderson等[12]将小麦授粉后的种子与种子胚乳特异性EST进行杂交,其cDNA文库是小麦授粉后5~30 d的种子cDNA文库,发现了一类新的小麦胚乳特异性表达基因,然后BLAST对比分析,证明该小麦胚乳特异性表达的基因与燕麦Avenin储藏蛋白基因相似度最高。
2004年,Li等[13]分别以小麦的胚、胚乳以及未授粉子房的RNA反转录的DNA为探针,与小麦授粉后12 d的种子cDNA文库进行差异杂交,结果证明4个基因类似于燕麦Avenin蛋白编码基因,并研究了这类小麦Avenin-like蛋白编码基因在各个组织中的表达模式,进一步证明了该类基因只在胚乳中特异性表达。
2005年,Vensel等[14]通过质谱技术以及双向电泳技术,将小麦开花后10~36 d的胚乳中分离出的蛋白质经序列比较分析后发现了5个类似于燕麦的蛋白质,通过研究证明该类蛋白质是小麦新型种子储藏蛋白。
2005年,Drea等[15]应用高通量原位杂交技术,检测小麦胚乳发育早期基因表达模式,将检测到种子发育期间有多个Avenin-like蛋白编码基因在胚乳中特异性表达,这些表达产物被证明类似于小麦储藏蛋白。
2005年Dupont等[16]从小麦种子胚乳中分离得到一个新型蛋白质,然后通过试验表明小麦胚乳中这类蛋白与燕麦Avenin蛋白相似度很高。
1.2 类燕麦储藏蛋白Avenin-like蛋白的研究2006年,Kan等[17]利用构建的小麦和山羊草开花后14 d的种子cDNA文库与小麦胚乳特异性表达的EST芯片杂交,结果显示为阳性克隆,将阳性克隆的基因序列和推导的蛋白质序列经BLAST比较分析后,因这种基因与小麦储藏蛋白基因Avenin同源性较高,故将这种基因命名为Avenin-like基因,将其相应的蛋白命名为Avenin-like蛋白。
依据Avenin-like蛋白的结构差异,可以分为Avenin-like type a和Avenin-like type b 2种蛋白,分别含有约148和265个氨基酸残基,分子量分别约为16 kDa和30 kDa[17]。已分离的小麦Avenin-liketypea基因Avenin-liketypeb基因长度分别为450和855 bp。
2008年,陈鹏等[18-19]利用小麦及其近缘物种各种山羊草为研究材料,克隆得到了23个ALPtype-b同源基因,然后利用半定量PCR技术及Western-blot杂交分析验证,结果表明,该基因在胚乳中特异性表达。并证明这些Avenin-like蛋白存在典型的“半胱氨酸-半胱氨酸”,即“Cys-Cys”结构域。陈鹏等[20-21]利用实时荧光定量即RT-PCR技术证明Avenin-like基因的时空表达模式,Avenin-like基因在根、茎、叶、花等其他组织中均无表达,但在胚乳中特异性表达。
2 类燕麦储藏蛋白Avenin-like基因的启动子研究
2.1 类燕麦储藏蛋白Avenin-like基因启动子的克隆和元件分析基于类燕麦储藏蛋白Avenin-like基因在胚乳中特异性表达的特性,2012年,宋斐等[22]对ALPtype-B基因启动子的克隆及其功能进行了研究。
采用实时荧光定量PCR即RT-PCR分析发现,ALPtype-B基因在小麦胚乳中表达,但在根、茎、叶和花等其他组织中均无表达,表明ALPtype-B基因的表达具有胚乳特异性。运用反向PCR技术,从小麦鄂恩1号中克隆得到ALPtype-B基因的上游1.664 bp启动子序列。应用PLACE和plantCARE等数据库分析了该1.664 bp启动子元件,发现该启动子除具备启动子的基本元件TATA-box、CAAT-box外,还含有胚乳特异性表达的元件,如GCN4元件、TGTAAAG元件、Skn-motif元件、AACA元件等[23](图1)。
基于对启动子顺式作用元件序列的生物信息学分析,为了进一步分析鉴定上述启动子元件的作用,以载体pBI121为基本框架,构建了包括ALPtype-B基因上游1,664 bp序列及4个分别含有不同序列长度的5′端缺失启动子序列999、785、550和290 bp在内的5个双元表达载体,并以其长度为基础分别命名为载体pALP-17、pALP-10、pALP-8、pALP-6和pALP-3,表达载体的报告基因均是GUS基因(图2)。
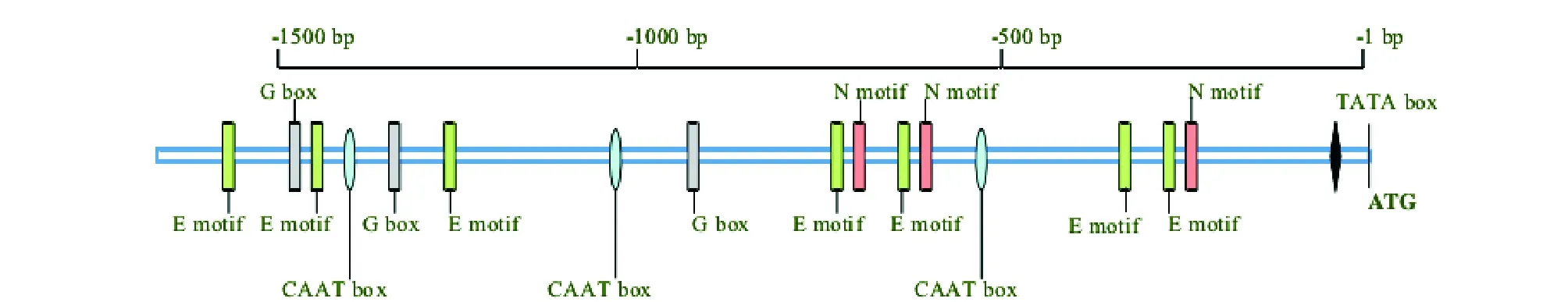
图1 启动子元件分析[23]
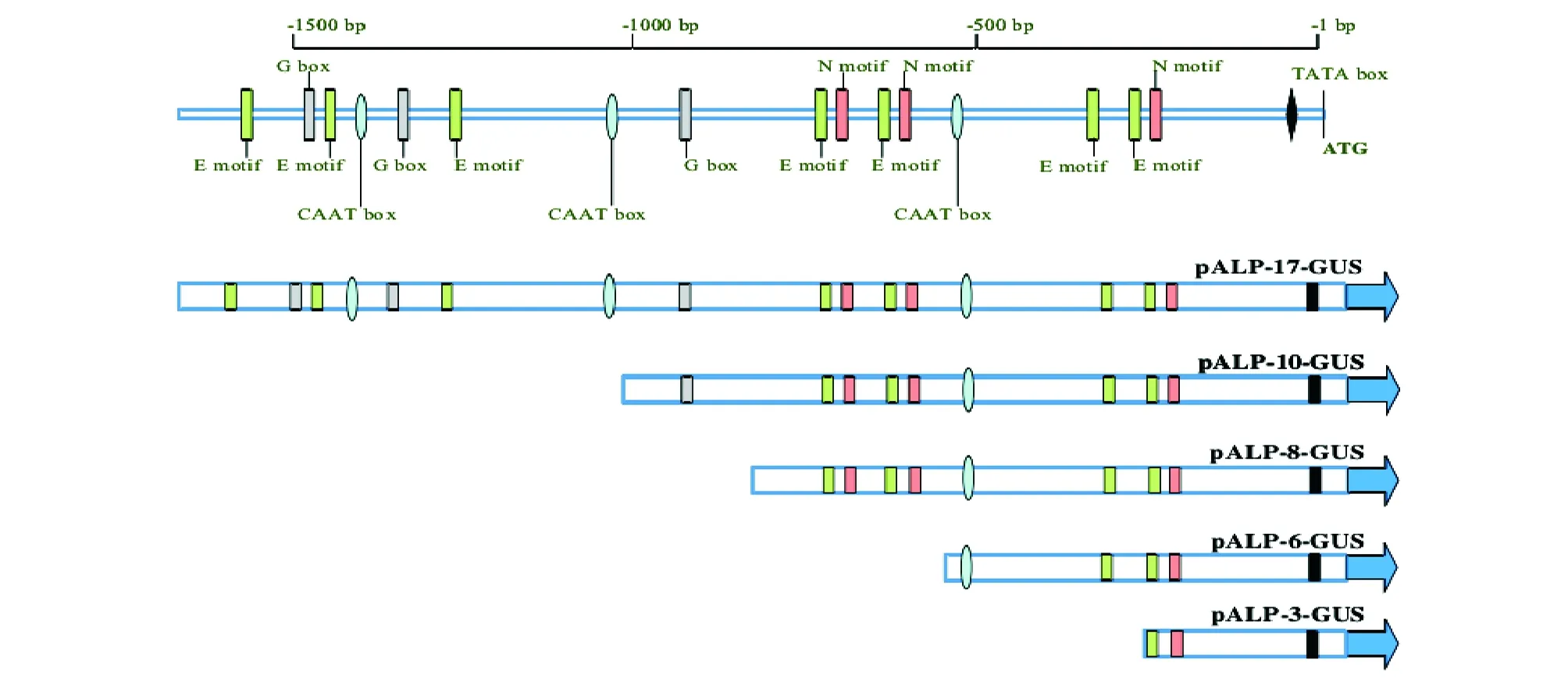
图2 缺失载体构建[23]
2.2 类燕麦储藏蛋白Avenin-like基因启动子的特异性表达分析将上述5个pALP-17、pALP-10、pALP-8、pALP-6和pALP-3双元表达载体转化于烟草中,获得了转基因植株,其中转化pALP-3、pALP-8和pALP-10表达载体的转基因烟草阳性植株各5株,转化pALP-6表达载体的转基因烟草阳性植株4株,转化pALP-17表达载体的转基因烟草阳性植株19株。
对获得的T0代阳性转基因烟草植株进行GUS组织化学检测,进行定性研究,其原理是报告基因GUS(β-葡聚糖苷酶)可将X-Gluc水解成蓝色物质,因此具有GUS活性的部位或位点呈现蓝色或蓝色斑点,可用肉眼或显微镜观察到。证实ALPtype-B基因启动子可驱动报告基因在烟草胚乳中表达,但在烟草其他组织如根、茎、叶和花中并未检测到报告基因GUS基因的表达。然后对转基因烟草进行GUS荧光定量分析,其中转化有pALP-3的种子GUS活性达到273.06 nmol/(mg蛋白·hr),这个值是阴性对照种子[14.25 nmol/(mg蛋白·hr)]的近20倍,说明prolamin-box元件可以保持启动子驱动报告基因在胚乳中本底水平的表达;同时研究证明随着启动子序列长度的增加,至-785 bp启动子驱动报告基因达到最高GUS活性即447.86 nmol/(mg蛋白·hr),推测ESP-like元件与RY motif元件可能共同作用构成一个强胚乳特异性上调元件;而后则逐渐降低直至173.68 nmol/(mg蛋白·hr),由此推测在-785 bp启动子上游和下游,分别有较强的下调和上调顺式作用元件,而G-box并未发挥其远端上调作用[22]。
3 需要进一步研究的工作
对各显著启动子元件进行缺失突变分析和点突变分析,并对含有潜在的显著上调、下调顺式作用元件的区段进行更加精细地截取并进行转基因研究。
以转基因小麦为材料,通过凝胶组织分析鉴定具有显著上调、下调作用顺式作用元件的特异结合蛋白,以期找到新的反式作用因子,为深入研究小麦胚乳特异性表达调控机制提供新方向。
通过基因枪法将pALP-17载体转入小麦,进一步明确该小麦ALPtype-B基因启动子在禾本科植物中的表达特性,为该启动子在基因工程中的应用奠定基础。
[1] 何中虎,晏月明,庄巧生,等.中国小麦品种品质评价体系建立与分子改良技术研究[J].中国农业科学,2006,39(6):1091-1101.
[2] 杨春玲,关立,侯军红,等.小麦品质遗传研究进展与品种选育[J].麦类作物学报,2007,11(3):12-17.
[3] BELTON P S.On the elasticity of wheat gluten[J].Journal of Cereal Science,1999,29(2):103-107.
[4] DOBRASZCZYK B J,MORGENSTERN M P.Rheology and the breadmaking process[J].Journal of Cereal Science,2003,38(3):229-245.
[5] HEY R L.Effect of flour quality characteristics on puff pastry baking performance[J].Cereal Chem,1993,70:392-396.
[6] SHEWRY P R,NAPIER J A,TATHAM A S.Seed Storage Proteins:Structures and Biosunthesis[J].Plant Cell,1995,7(7):945-956.
[7] PAYNE P I,CORFIELD K G,HOLT L M,et al.Correlations between the inheritance of certain high-molecular-weight subumits of glutenin and bread-making quality in progenies of six crosses of bread wheat[J].J Sci Food Agric,1981,32(1):51-60.
[8] PAYNE P I.genetics of Wheat Storage Proteins and the Effect of Allelic Variation on Bread-Making Quality[J].Annual Reviews in Plant Physiology,1987,38(1):141-153.
[9] SHEWRY P R,TATHAM A S.Disulphide Bonds in Wheat Gluten Proteins[J].Journal of Cereal Science,1997,25(3):207-227.
[10] OSBORNE T B.The vegetable proteins[M].London:Longmans,Green and Company,1924:667-674.
[11] SHEWRY P R,HALFORD N G.Cereal seed storage proteins:structures,properties and role in grain utilization[J].Soc Experiment Biol,2002,53:947-958.
[12] ANDERSON O D,HSIA C C,ADALSTEINS A E,et al.Identification of several new classes of low-molecular-weight wheat gliadin-related proteins and genes[J].TAG Theoretical and Applied Genetics,2001,103(2):307-315.
[13] LI J R,WANG F,ZHAO X Y,et al.Analysis of Seed-expressed Sequence Tags in Triticum aestivum[J].Acta Botanica Sinica,2004,46(3):363-370.
[14] VENSEL W H,TANAKA C K,CAI N,et al.Developmental changes in the metabolic protein profiles of wheat endosperm[J].PROTEOMICS,2005,5(6):1594-1611
[15] DREA S,LEADER D J,ARNOLD B C,et al.Systematic Spatial Analysis of Gene Expression during Wheat Caryopsis Development[J].The Plant Cell,2005,17(8):2172-2178.
[16] DUPONT F M,CHAN R,LOPEZ R,et al.Sequential extraction and quantitative recovery of gliadins,glutenins,and other proteins from small samples of wheat flour[J].J Agric Food Chem,2005,53(5):1575-1584.
[17] KAN Y,WAN Y,BEAUDOIN F,et al.Transciptome analysis reveals differentially expressed storage protein transcripts in seeds of Aegilops and wheat[J].Journal of Cereal Science,2006,44(1):75-85.
[18] CHEN P,WANG C D,LI K X,et al.Cloning expression and characterization of novel avenin-like genes in wheat and related species[J].Journal of Cereal Science,2008,48(3):734-740.
[19] 陈鹏.小麦及其近缘物种中新型储藏蛋白基因avenin-like的克隆和功能研究[D].武汉:华中科技大学,2008.
[20] 陈鹏,汪长东,黄阜峰,等.拟斯卑尔脱山羊草基因的克隆与表达研究[J].生物技术通报,2008(5):122-125.
[21] 陈鹏,李茹,金刚,等.三芒山羊草中新型储藏蛋白基因avenin-like的克隆及分析[J].生物技术,2009,19(4):1-3.
[22] 宋斐.胚乳特异性ALPtype-B基因启动子的克隆及其功能分析[D].武汉:华中科技大学,2012.
[23] 孙杨柳.小麦储藏蛋白基因avenin-like b启动子的表达特性研究[D].武汉:华中科技大学,2011.
Review of Cloning of Wheat and Related Species Class Oat Storage ProteinAvenin-likeGene
SUN Yang-liu
(Productivity Promotion Center of Enshi Autonomous Prefecture, Enshi, Hubei 445000)
The quality and quality formation of wheat, storage protein and classification were described.The discovery of theAvenin-likestorage protein gene, and spatiotemporal expression patterns in the endosperm-specific expression, and the promoter elements and temporal specificity expresstion were reviewed.
The gene ofAvenin-like; Endosperm-specific expression; Promoter
国家转基因重大专项(2011ZX08010004-004)。
孙扬柳(1987- ),女,湖北黄冈人,助理工程师,硕士,从事小麦基因功能分析。
2015-02-02
S 188
A
0517-6611(2015)08-040-03
