丹参素衍生物的合成
2015-02-27秦方刚方佳成白亚军郑晓晖
秦方刚,刘 佩,方佳成,白亚军,郑晓晖
(西北大学 生命科学学院, 陕西 西安 710069)
·生命科学·
丹参素衍生物的合成
秦方刚,刘 佩,方佳成,白亚军,郑晓晖
(西北大学 生命科学学院, 陕西 西安 710069)
在丹参素冰片酯的基础上,以原儿茶醛类似物为起始原料,经乙酰化,水解,酸化处理后得到中间体β-(3,4-二甲氧基苯基)丙酮酸、β-(3-羟基-4-甲氧基苯基)丙酮酸、β-(4-氯苯基) 丙酮酸。选择具有扩张血管等作用的烟酸、异烟酸以及具有促渗透作用的薄荷醇作为取代基,借助功能导向合成方法及“君-使化合物”的思想对中间体的羧基和α-羟基做进一步的结构优化,得到6种丹参素衍生物。通过MS,1H NMR,13C NMR对所合成化合物的结构进行表征,可为心血管药物的开发提供新的实体分子。
丹参素冰片酯;丹参素衍生物;功能导向合成;“君-使”化合物
丹参素及其衍生物具有良好的心血管保护与治疗作用[1-4]。其中,丹参素冰片酯(缩写为DBZ),化学名为(±)-3′,4′-二羟基苯基-2-羟基丙酸冰片酯,是郑晓晖课题组基于“君-使对药”的配伍原则设计合成的I类化学新药[5]。药理学研究表明:DBZ具有抗动脉粥样硬化[6-7]、抗脑缺血[8]、抗大鼠急性心肌缺血[9]、降低血压、改善心脏舒张功能[10]等作用。基于DBZ有如此良好的药理活性,本课题组在合成消旋DBZ的基础上,借助功能导向合成方法(Function-Oriented Synthesis, FOS)[11-13]对该分子做进一步的结构优化。本实验保留苯基乳酸的基本结构,修饰苯环、羧基及α-羟基,选择具有扩张血管、促进血管循环等作用的烟酸[14]及其同分异构体异烟酸[15],以及具有芳香开窍、促渗透作用的薄荷醇[16]作为取代基,合成了6种丹参素衍生物(图1),以期筛选出更具防治心脑血管疾病等作用的活性化合物。
丹参素衍生物合成路线[17]如下图所示。
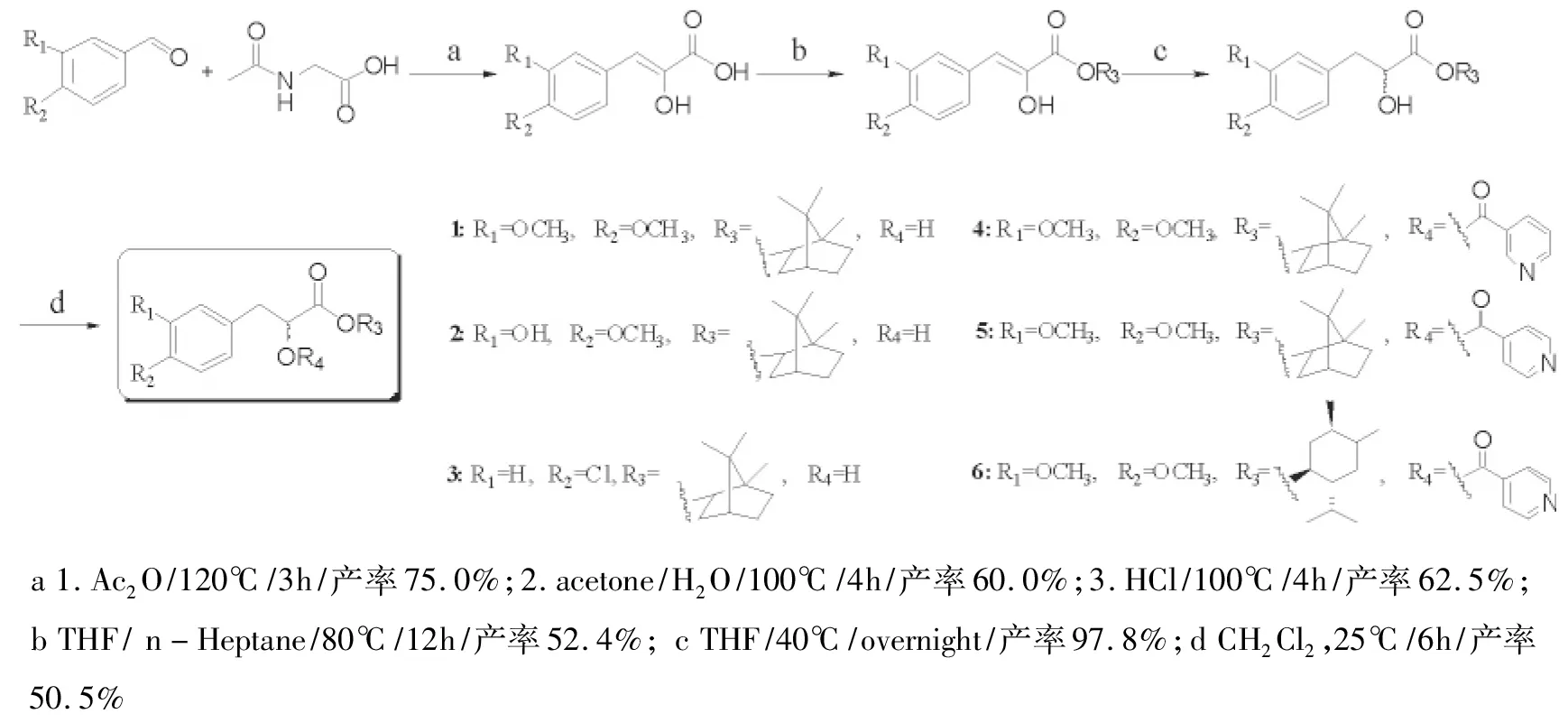
图1 6种丹参素衍生物的合成路线及结构Fig.1 The synthetic route of Danshensn derivatives
1 实验部分
1.1 主要仪器与试剂
Agilent 1200 series型HPLC-6520Q-TOF飞行时间质谱;Varian Gemini 2000(VnmrS 600MHz)型核磁共振仪(CDCl3为溶剂,TMS为内标);其他试剂均为分析纯。
1.2 丹参素衍生物的合成
1.2.1 2-甲基-4-(3,4-二甲氧基苄叉基) 口恶唑酮的合成 在1 000mL三颈烧瓶加入3,4-二甲氧基苯甲醛80.0g、N-乙酰甘氨酸77.7g、无水醋酸钠59.0g、醋酸酐170mL,搅拌,于120℃下回流3h,溶液呈红黑色,停止加热,冷却至室温,向其中加入500mL冰水,继续搅拌使溶液呈均匀乳浊液,底部有大量黄色晶体析出,抽滤,冰乙醇洗涤,真空干燥,得黄色晶体88.9g,收率75.0%。
同法制备:2-甲基-4-(3-乙酰氧基-4-甲氧基苄叉基)口恶唑酮101.3g,收率70.0%;2-甲基-4-(4-氯苄叉基)口恶唑酮90.9g,收率72.0%。
1.2.2β-(3,4-二甲氧基苯基)-α-乙酰氨基丙烯酸的合成 在1 000mL三颈烧瓶中加入2-甲基-4-(3,4-二甲氧基苄叉基)口恶唑酮74.0g、丙酮320mL、水320mL,搅拌,缓慢加热至沸,回流4h,稍凉后抽滤,滤液冷却至室温后,移至冰箱使析晶完全。抽滤,洗涤,真空干燥,得黄色晶体47.7g,收率60.0%。
同法制备:β-(3-乙酰氧基-4-甲氧基苯基)-α-乙酰氨基丙烯酸48.5g,收率55.2%;β-(4-氯苯基)-α-乙酰氨基丙烯酸43.4g,收率64.5%。
1.2.3β-(3,4-二甲氧基苯基)丙酮酸的合成 在1 000mL三颈烧瓶中加入β-(3,4-二甲氧基苯基)-α-乙酰氨基丙烯酸42.4g,1mol/L盐酸500mL,搅拌,加热回流4h。反应完毕后,停止加热,继续搅拌过夜,出现沉淀,抽滤,洗涤,真空干燥,得黄色晶体22.4g,收率62.5%。
同法制备:β-(3-羟基-4-甲氧基苯基) 丙酮酸19.6g,收率58.8%;β-(4-氯苯基) 丙酮酸21.0g,收率66.4%。
1.2.4β-(3,4-二甲氧基苯基)-丙酮酸冰片酯的合成 在500mL三颈烧瓶中加入β-(3,4-二甲氧基苯基)丙酮酸21.0g、冰片12.1g、对甲基苯磺酸4.5g,THF 120mL及正庚烷80mL,80℃回流12h。TLC监控反应,待原料反应结束后,用乙酸乙酯萃取3次(100mL×3),有机相用无水Na2SO4干燥。减压浓缩,硅胶柱分离v(石油醚):v(乙酸乙酯)=10∶1),得浅黄色油状物14.7g,收率为52.5%。
同法制备:β-(3-羟基-4-甲氧基苯基)丙酮酸冰片酯13.9g,收率51.3%;β-(4-氯苯基) 丙酮酸冰片酯15.8g,收率60.2%;β-(3,4-二甲氧基苯基)丙酮酸薄荷醇酯16.6g,收率58.3%。
1.2.5β-(3,4-二甲氧基苯基)-α-羟基丙酸冰片酯的合成 在200mL圆底烧瓶中加入β-(3,4-二甲氧基苯基)丙酮酸冰片酯14.1g、雷尼镍2.8g和THF 100mL,在搅拌下用N2置换除去体系中的空气,再用H2置换除去体系中的N2。通入H2保持温度在40℃,至H2不再被吸收为止。抽滤,减压浓缩,得浅黄色油状物13.8g,收率97.8%, ESI-MS(m/z): 362.2[M]+;1H NMR (600 MHz, CDCl3)δ6.84 - 6.75 (m, 3H), 4.95 - 4.88 (m, 1H), 4.48 - 4.42 (m, 1H), 3.87 (s, 3H), 3.86 (s, 3H), 3.13 - 3.06 (m, 1H), 2.99 - 2.90 (m, 1H), 2.41 - 2.25 (m, 2H), 1.90 - 1.86 (m, 1H), 1.77 - 1.73 (m, 1H), 1.71 - 1.67 (m, 1H), 1.35 - 1.29 (m, 1H), 1.24 - 1.18 (m, 1H), 0.97 (dd,J= 14.0, 3.4 Hz, 1H), 0.91 (s, 3H), 0.88 (s, 3H), 0.84 (s, 3H)。13C NMR (150MHz, CDCl3)δ174.56(s), 148.79(s), 147.99(s), 128.83(s), 121.51(s), 112.72(s), 111.17(s), 81.81(s), 77.39(s), 71.42(s), 48.84(s), 47.89(s), 44.79(s), 40.27(s), 40.04(s), 36.63(s), 27.95(s), 27.06(s), 19.66(s), 18.81(s), 13.57(s)。
同法制备:油状物β-(3-羟基-4-甲氧基苯基)-α-羟基丙酸冰片酯13.4g,收率95.2%, ESI-MS(m/z):349.0[M+1]+;1H NMR (600 MHz, CDCl3)δ9.83 (s, 1H), 6.81 (s, 1H), 6.76 (d, J = 8.2 Hz, 1H), 6.71 (d,J= 7.3 Hz, 1H), 5.59 (s, 1H), 4.91 (d,J= 9.8 Hz, 1H), 4.40 (s, 1H), 3.84 (s, 3H), 3.10 - 2.97 (m, 1H), 2.86 (dd,J= 14.0, 6.7 Hz, 1H), 2.41 - 2.28 (m, 1H), 1.85 (ddd,J= 24.8, 12.8, 8.0 Hz, 1H), 1.78 - 1.70 (m, 1H), 1.70 - 1.64 (m, 1H), 1.34 - 1.26 (m, 1H), 1.23 - 1.16 (m, 1H), 0.96 (dd,J= 13.9, 3.0 Hz, 1H), 0.89 (s, 3H), 0.86 (s, 3H), 0.83 (s, 3H)。13C NMR (150MHz, CDCl3)δ174.60(s), 145.49(s), 129.53(s), 120.94(s), 115.71(s), 110.62(s), 81.83(s), 71.45(s), 71.08(s), 55.97(s), 48.83(s), 47.89(s), 44.81(s), 40.15(s), 36.62(s), 27.94(s), 27.04(s), 19.68(s), 18.82(s), 13.54(s)。
油状物β-(4-氯苯基)-α-羟基丙酸冰片酯13.0g,收率92.8%, ESI-MS(m/z): 337.8[M+1]+;1H NMR (600 MHz, CDCl3)δ7.40 (d,J= 7.9 Hz, 2H), 7.34 (s, 2H), 7.13 (s, 1H), 4.99 (d,J= 9.5 Hz, 1H), 2.46 - 2.38 (m, 1H), 2.14 (s, 2H), 2.00 - 1.94 (m, 1H), 1.83 - 1.76 (m, 1H), 1.73 (t,J= 4.4 Hz, 1H), 1.42 - 1.35 (m, 1H), 1.31 - 1.27 (m, 1H), 1.25 (s, 2H), 1.09 (dd,J= 13.7, 2.0 Hz, 1H), 0.94 (s, 3H), 0.90 (s, 3H), 0.89 (s, 3H)。13C NMR (150MHz, CDCl3)δ168.23(s), 165.46(s), 130.78(s), 129.66(s), 128.73(s), 124.53(s), 81.97(s), 49.02(s), 47.89(s), 44.88(s), 36.59(s), 31.93(s), 29.70(s), 27.97(s), 27.34(s), 23.66(s), 19.69(s), 18.88(s), 13.59(s)。
油状物β-(3,4-二甲氧基苯基)-α-羟基丙酸薄荷醇酯12.7g,收率90.5%。365.4[M+1]+。
1.2.6β-(3,4-二甲氧基苯基)-α-(3-吡啶甲酰氧基)丙酸冰片酯的合成 在100mL单颈烧瓶中加入β-(3,4-二甲氧基苯基)-α-羟基丙酸冰片酯10.9g、烟酸5.54g,DMAP0.73g和二氯甲烷50mL,室温搅拌20min后,加入EDCI 8.63g,反应6h,TLC监控反应,待原料反应结束后,向反应体系中加入饱和NaHCO3溶液,调pH=7,用乙酸乙酯萃取3次(50mL×3),有机相用无水Na2SO4干燥。减压浓缩,硅胶柱分离v(石油醚):v(乙酸乙酯)=6∶1),得淡黄色油状物7.11g, 收率为50.5%, ESI-MS(m/z): 468.2[M+1]+;1H NMR (600 MHz, CDCl3)δ9.26 (s, 1H), 8.81 (d,J= 4.7 Hz, 1H), 8.35 - 8.27 (m, 1H), 7.42 (dd,J= 7.7, 4.9 Hz, 1H), 6.88 (d,J= 8.1 Hz, 1H), 6.83 (d,J= 7.9 Hz, 2H), 5.51 - 5.45 (m, 1H), 4.95 - 4.88 (m, 1H), 3.87 (s, 3H), 3.86 (s, 3H), 3.33 - 3.22 (m, 2H), 2.37 - 2.28 (m, 1H), 1.71 - 1.63 (m, 3H), 1.23 - 1.10 (m, 2H), 0.94 (dd,J= 13.9, 3.3 Hz, 1H), 0.88 (s, 3H), 0.84 (s, 3H), 0.73 (s, 3H)。13C NMR (150MHz, CDCl3)δ169.45(s), 164.57(s), 153.58(s), 150.75(s), 148.87(s), 148.19(s), 137.36(s), 128.01(s), 125.61(s), 123.46(s), 121.63(s), 112.47(s), 111.27(s), 81.58(s), 74.18(s), 55.87(s), 48.80(s), 47.82(s), 44.76(s), 37.15(s), 36.39(s), 29.70(s), 27.82(s), 26.94(s), 19.61(s), 18.78(s), 13.31(s)。
同法制备:油状物β-(3,4-二甲氧基苯基)-α-(对吡啶甲酰氧基)丙酸冰片酯6.3g, 收率45.2%, ESI-MS(m/z): 468.2[M+1]+;1H NMR (600 MHz, CDCl3)δ8.79 (d,J= 5.0 Hz, 2H), 7.84 (d,J= 5.1 Hz, 2H), 6.89 - 6.77 (m, 3H), 5.49 - 5.43 (m, 1H), 4.94 - 4.86 (m, 1H), 3.86 (s, 6H), 3.32 - 3.20 (m, 2H), 2.38 - 2.27 (m, 1H), 1.68 - 1.62 (m, 3H), 1.22 - 1.08 (m, 2H), 0.92 (dd,J= 13.9, 3.0 Hz, 1H), 0.87 (s, 3H), 0.83 (s, 3H), 0.77 (s, 3H)。13C NMR (150MHz, CDCl3)δ169.26(s), 164.52(s), 150.67(s), 148.88(s), 148.24(s), 136.75(s), 127.93(s), 122.83(s), 121.58(s), 112.50(s), 111.25(s), 81.65(s), 74.39(s), 55.86(s), 48.80(s), 47.82(s), 44.76(s), 37.10(s), 37.01(s), 36.41(s), 36.36(s), 29.70(s), 27.83(s), 26.94(s), 19.61(s), 18.79(s), 13.31(s)。
油状物β-(3,4-二甲氧基苯基)-α-(对吡啶甲酰氧基)丙酸薄荷醇酯7.74g,收率55.3%, ESI-MS(m/z): 470.2[M+1]+;1H NMR (600 MHz, CDCl3)δ8.88 (d,J= 4.4 Hz, 2H), 8.02 (d,J= 4.4 Hz, 2H), 7.38 (s, 1H), 7.19 (d,J= 8.4 Hz, 1H), 7.15 (d,J= 1.5 Hz, 1H), 6.84 (d,J= 8.4 Hz, 1H), 4.83 (td,J= 10.8, 4.2 Hz, 1H), 3.88 (s, 3H), 3.68 (s, 3H), 2.10 (d,J= 11.8 Hz, 1H), 1.95 - 1.86 (m, 1H), 1.68 (d,J= 13.1 Hz, 3H), 1.56 - 1.46 (m, 1H), 1.43 - 1.35 (m, 1H), 1.16 - 0.98 (m, 3H), 0.91 (d, J = 6.5 Hz, 3H), 0.87 (d,J= 7.0 Hz, 3H), 0.80 (d,J= 6.9 Hz, 3H)。13C NMR (150MHz, CDCl3)δ162.88(s), 161.85(s), 150.96(s), 150.66(s), 148.83(s), 136.11(s), 135.49(s), 128.32(s), 127.58(s), 124.58(s), 124.37(s), 123.12(s), 112.37(s), 111.07(s), 76.16(s), 60.39(s), 55.90(s), 55.61(s), 47.13(s), 40.71(s), 34.15(s), 31.42(s), 26.31(s), 23.49(s), 21.98(s), 20.71(s), 16.38(s)。
2 结果与讨论
本文在功能导向合成方法以及“君-使化合物”的指导下,将冰片、薄荷醇、烟酸以及异烟酸等生物活性分子通过共价键的形式与丹参素分子结合起来,形成一组新分子实体,合成了6个丹参素酯类衍生物。期望该类新分子实体不仅综合具有丹参素、冰片或薄荷醇、烟酸或异烟酸的生物活性,同时还体现出中药组方中的“协同增效”作用,从而产生新的生物活性,为心血管药物的开发提供新的实体分子。此外,合成的6个化合物经核磁氢谱分析,含有冰片基团的新分子实体。其冰片基团上的甲基氢均含有另外一组化学位移值(约占20%),说明化合物中某一手性中心可能发生变化。推测其产生主要原因为合成条件不当所导致。
今后,对于如何降低这类差向异构体手性中心变构,将在其生物活性测定后,通过优化合成反应条件进一步解决。后期,该类化合物的设计,还将引入计算机辅助分子模拟研究,并结合后续药理实验进行验证,进而佐证或补充基于功能导向合成方法以及“君-使化合物”设计思路的合理性及可行性。
[1] CHEN Y S, LEE S M, LIN Y J, et al. Effects of Danshensu and salvianolic acid B from Salvia miltiorrhiza Bunge (Lamiaceae) on cell proliferation and collagen and melanin production[J].Molecules, 2014, 19(2): 2029-2041.
[2] WANG T, FU F H, HAN B, et al. Danshensu ameliorates the cognitive decline in streptozotocininduced diabetic mice by attenuating advanced glycation end product-mediated neuroinflammation[J].Journal of Neuroimmunology, 2012, 245(1-2): 79-86.
[3] ZHOU X L, CHAN S W, TSENG H L, et al. Danshensu is the major marker for the antioxidant and vasorelaxation effects of Danshen (Salvia miltiorrhiza) water-extracts produced by different heat water-extractions[J].Phytomedicine, 2012, 19(14): 1263-1269.
[4] WEN A D, XIONG L, SUN X L, et al. Neuroprotective effect of Danshensu derivatives as anti-ischaemia agents on SH-SY5Y cells and rat brain[J].Bioscience Reports, 2013, 33(4): 677-688.
[5] 郑晓晖. 三组君-使对药及其体内效应物质的研究[D].西安:西北大学,2007.
[6] 李静, 周洁, 刘勤社, 等. 丹参素冰片酯干预TLR4信号通路抗动脉粥样硬化的机制研究[J].陕西中医, 2012, 33(5): 627-636.
[7] 李静, 刘亚荣, 刘勤社, 等. 丹参素冰片酯对大鼠腹主动脉中TLR4、NF-κB和IL-6mRNA表达的实验研究[J].陕西医学杂志, 2012, 41(4): 392-394.
[8] 郑晓晖, 张群正, 王世祥, 等.β-(3, 4-二羟基苯基)-α-羟基丙酸冰片酯、其合成方法和用途:中国, 1868998[P].2006-11-29.
[9] 田海林, 周晓伟, 陈明, 等. 丹参素冰片酯的不对称合成研究[J].中国药物化学杂志, 2012, 22(2): 113-115.
[10] 刘少静. 丹参素冰片酯的结构表征、质量控制及其药代动力学研究[D].西安:西北大学,2009.
[11] SUSAN L M, MICHAEL K H, ERIN A C, et al. Function-Oriented synthesis: biological evaluation of laulimalide analogues derived from a last step cross metathesis diversification strategy[J].Mol pharmaceutics, 2008, 5(5): 829-838.
[12] PAUL A W, JEREMY L B, STACEY E B, et al. Design, synthesis and evaluation of potent bryostatin analogs that modulate PKC translocation selectivity[J].PNAS, 2011, 108(17): 6721-6726.
[13] PAUL A W, VISHAL A V, THOMAS J P, et al. Function-Oriented synthesis, step economy and drug design[J].Acc Chem Res, 2008, 41(1): 40-49.
[14] 李钟玉, 李临生. 烟酸、烟酰胺的研究进展[J].化工时刊, 2003, 17(2): 6-9.
[15] 张姝, 白金泉, 郭丰艳, 等. 异烟酸合成研究进展[J].化学试剂, 2010, 32(3): 219-222.
[16] 齐红艺, 李莉, 吴纯洁. 薄荷醇促渗透作用的研究进展[J].时珍国医国药, 2006, 17(9): 1776-1778.
[17] BAI Y J, ZHANG Q Z, JIA P, et al. Improved process for pilot-scale synthesis of Danshensu ((±)-DSS) and its enantiomer derivatives[J].Org Process Res Dev, 2014, 18(12): 1667-1673.
(编 辑陈镱文)
Synthesis of Danshensu derivatives
QIN Fang-gang, LIU Pei, FANG Jia-cheng, BAI Ya-jun, ZHENG Xiao-hui
(College of Life Sciences, Northwest University, Xi′an 710069, China)
Based on the structure of bornylβ-(3,4-dihydroxyphenyl)-α-hydroxypropionate, 3-(3,4-dimethoxyphenyl)-2-hydroxyacrylic acid, 2-hydroxy-3-(3-hydroxy-4-methoxyphenyl) acrylic acid and 3-(4-chlorophenyl)-2-hydroxyacrylic acid have been synthesized from protocatechuic aldehyde analogs, and then subsequently suffering to acetylation, hydrolysis and acidification. Six Danshensu derivatives were successfully synthesized by using strategies of Function-Oriented Synthesis and ′Jun-Shi compounds′ and choosing nicotinic acid and isonicotinic acid with the effects of dilating blood vessels and DL-menthol with the effects of promoting the penetration as substituent. Their structures were identified by MS,1H NMR and13C NMR, and they were not reported in literature. It provided new entity compounds for the development of cardiovascular drugs.
bornylβ-(3,4-dihydroxyphenyl)-α-hydroxypropionate; Danshensu derivatives; Function-Oriented Synthesis; ′Jun-Shi compounds′
2014-09-01
陕西省国际科技合作重点基金资助项目(2012KW-45)
秦方刚,男,陕西汉中人,从事药物化学研究。
R932
:ADOI:10.16152/j.cnki.xdxbzr.2015-03-014
作者简介:郑晓晖,男,西北大学教授,从事中药复方成分分析、代谢和应答,创新药物研发等研究。
