碱性成纤维细胞生长因子及转化生长因子β1对鼻息肉成纤维细胞生长的调控作用
2015-02-27张炳煌高静
张炳煌 高静
·基础研究·
碱性成纤维细胞生长因子及转化生长因子β1对鼻息肉成纤维细胞生长的调控作用
张炳煌 高静
目的 体外研究碱性成纤维细胞生长因子(bFGF)及转化生长因子β1(TGF-β1)对人鼻息肉成纤维细胞(NPF)增殖及胶原合成的影响。方法 采用组织块培养技术进行人NPF的体外培养,使用不同浓度的bFGF、TGF-β1单独及联合作用于NPF。用四唑化合物[MTS(a)]比色法检测细胞的增殖,酶联免疫吸附测定法测定细胞培养上清液Ⅲ型胶原的含量。结果 TGF-β1单独使用时,随着其浓度梯度升高,对成纤维细胞增殖的抑制作用逐渐增强,差异有统计学意义(P<0.05);bFGF单独使用时,其浓度增高,可促进人NPF增殖,差异有统计学意义(P<0.05);bFGF和TGF-β1联合使用时对NPF细胞的增殖具有拮抗作用,差异有统计学意义(P<0.05)。随着bFGF、TGF-β1单独及联合作用诱导NPF产生的增殖变化,NPF分泌的Ⅲ型胶原的含量发生明显的浓度差异,差异有统计学意义(P<0.05)。结论 TGF-β1可以抑制人NPF增殖及Ⅲ型胶原的分泌,bFGF能够促进人NPF增殖及Ⅲ型胶原的分泌,两者联合具有拮抗作用,可能在鼻息肉的发生、鼻窦炎组织的重塑中发挥重要作用。(中国眼耳鼻喉科杂志,2015,15:272-275)
鼻窦炎;成纤维细胞;碱性成纤维细胞生长因子;转化生长因子β1;组织重塑
近年来,尽管规范的鼻内镜手术和抗炎药物应用使慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)的治疗效果有了较大的提高,但是仍有约1/5的CRS患者在术后5年内由于症状复发而再次手术,约1/3的患者在药物治疗后的2个月内复发。之所以临床疗效难于令人满意,在于CRS发病机制还不明确[1]。无论是在CRS伴鼻息肉(CRS with nasal polyps,CRSwNP)还是在CRS不伴鼻息肉(CRSsNP)中都发现了组织的重塑变化[2],碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)及转化生长因子β1(transforming growth factor β1,TGF-β1)在鼻窦炎黏膜重塑及鼻息肉的发生机制中可能起到重要作用。本课题通过研究bFGF和TGF-β1对体外鼻窦黏膜及鼻息肉成纤维细胞(nasal polyps fibroblast,NPF)生长调控和胶原蛋白分泌的影响,探讨bFGF及TGF-β1对黏膜重塑的可能作用机制。
1 材料与方法
1.1 材料 达尔伯克改良伊格尔培养基(Dulbecco modified Eagle medium, DMEM;HyClone)、胎牛血清(fetal bovine serum, FBS; PAA)、0.25%含乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)胰酶(Invitrogen)、双抗(PAA)、TGF-β1(PeproTech)、bFGF(PeproTech)、SV0001二步法免疫组织化学检测试剂盒(武汉博士德生物公司)、鼠抗波形蛋白单克隆抗体(武汉博士德生物公司)、人Ⅲ型胶原定量酶联免疫吸附测定(enzyme-linked immuno-sorbent assay, ELISA)试剂盒(北京艾然生物技术有限公司)、四唑化合物MTS(Promega)。
1.2 方法
1.2.1 成纤维细胞原代培养 本研究材料取自本科慢性鼻窦炎伴鼻息肉摘除手术患者(17~52岁,10例),术后都经病理确认符合鼻息肉病变。取鼻息肉标本置于无菌平皿中,用磷酸盐缓冲液(phosphate buffer saline, PBS)洗净血细胞,选择苍白色的鼻息肉组织剪成0.5~1 mm大小的组织块,再用基础培养液洗2~3次,洗净血细胞静置一段时间后弃上清液。加 4~5 滴细胞培养液,用吸管轻轻吹打后分次吸取组织块悬液,将其均匀排在15 mL培养皿,做好标记将培养皿置于37 ℃、2.5%CO2培养箱中静置2~3 h,待组织块贴壁后小心加入培养液(低糖DMEM+10% FBS),使培养液浸泡组织块,继续静止培养。每天小心取出培养皿置于相差显微镜下进行观察,24 h后可见组织块周边有细胞伸出,7 d后周围爬满细胞,2周后多数连接成片,可进行传代。2~3代可获得成纤维细胞长成片,然后用胰蛋白酶消化,继续培养。待细胞生长融合度为80%左右时进行传代培养。
1.2.2 人NPF鉴定 细胞传代至第4~7代用于实验。使用倒置相差显微镜进行NPF的形态学初步鉴定,并用波形蛋白单克隆抗体免疫组织化学染色进行细胞来源鉴定。
1.2.3 TGF-β1、bFGF单独及联合应用对NPF增殖的影响 实验组为不同浓度的TGF-β1和bFGF溶液,均用含1%FBS的DMEM配制成100、50、10、1 ng/mL 4个浓度,对照组为含1%FBS的DMEM,每浓度组4孔。分别在标准环境下孵育1、3、5 d后取出,每孔加入MTS(5 mg/mL)20 μL,继续培养4 h,用ELISA检测仪在λ=490 nm下测定吸光度(optical density,OD)值。
1.2.4 Ⅲ型胶原蛋白测定 取对数生长期NPF接种在96孔板中,5×104/孔,置37 ℃、5%CO2及饱和湿度下培养,24 h后换含1%血清DMEM培养液使细胞同步化,37 ℃继续孵育48 h,使细胞进入生长静止期。弃上清液,分别加入10%FBS、不同浓度的TGF-β1和bFGF药物,每天换液,继续培养5 d。用无菌管收集上清液,离心20 min左右(2 000~3 000 r/min)。按照Ⅲ型胶原蛋白试剂盒说明书操作,在λ=450 nm波长下依序测量各孔的OD值,计算各组Ⅲ型胶原蛋白浓度。
1.3 统计学处理 应用SPSS 16.0软件包进行统计学分析,各组数据以均数±标准差表示,组间比较采用t检验。先对各组数据进行正态性和方差齐性检验,满足条件者行单因素方差分析和配对t检验,设检验水准为0.05,P<0.05认为差异有统计学意义。
2 结果
2.1 NPF鉴定 倒置相差显微镜下,NPF胞体呈梭形或不规则三角形,中央可见卵圆形核,胞质向外伸出2~3个长短不齐的突起(图1)。免疫组织化学染色后出现棕色或棕褐色标记物者为波形蛋白阳性细胞(图2)。

图1. 倒置相差显微镜下的NPF(200×)

图2. 波形蛋白染色阳性的NPF(400×)
2.2 TGF-β1和bFGF单独作用时对人NPF增殖的影响 在培养基中单独加不同浓度的TGF-β1或bFGF,24 h后实验组各浓度组的细胞形态和细胞增殖情况与对照组相比变化不明显,差异无统计学意义(P>0.05);72 h和120 h,TGF-β1在1~100 ng/mL范围内,随浓度增加对NPF细胞的抑制作用明显增强,差异有统计学意义(P<0.01);bFGF在1~100 ng/mL浓度范围内表现为明显的促进NPF细胞增殖作用,差异有统计学意义(P<0.05)(表1)。
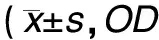
表1 TGF-β1和bFGF单独应用对NPF增殖的影响值)
注:a示TGF-β1单独作用组与相应对照组间差异有统计学意义(P<0.05);b示bFGF 单独作用组与相应对照组间差异有统计学意义(P<0.05)
2.3 TGF-β1和bFGF联合作用对人NPF增殖影响 浓度为10 ng/mL的TGF-β1和10 ng/mL的bFGF联合作用于人NPF,产生较明显的拮抗作用,与单独作用时比较,差异具有统计学意义(P<0.05)(表2)。
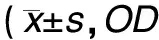
表2 TGF-β1和bFGF联合作用对NPF增殖
注:a示与对照组相比差异有统计学意义(P<0.05);b示与对照组相比差异有统计学意义(P<0.05);TGF-β1和bFGF浓度均为10 ng/mL
2.4 TGF-β1和bFGF对NPF胶原合成的影响 培养120 h后, TGF-β1在1~100 ng/mL范围内随浓度增加明显抑制NPFⅢ型胶原合成及分泌,bFGF在1~100 ng/mL浓度范围内能明显促进NPF细胞Ⅲ型胶原合成及分泌,差异具有统计学意义(P<0.05)。各组NPF表达Ⅲ型胶原的浓度值见表3。
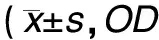
表3 TGF-β1和bFGF对NPF胶原合成
注:a示与联合作用组间差异有统计学意义(P<0.05)
3 讨论
组织重塑指正常构成成分及结构发生改变,多是应激反应的结果。有研究[3]发现,哮喘患者下呼吸道上皮结构和功能缺陷,继而引起上皮细胞持续活化并最终导致上皮下组织发生不可逆改变。下呼吸道和上呼吸道在很多疾病上存在着重要关联[4],在属于上呼吸道的CRS中也发现了类似的组织改变现象[2]。CRS是耳鼻咽喉头颈外科的常见病,可分为CRSwNP和CRSsNP两种[5]。早在1972年,Cauna等[6]就观察到CRSwNP除了有大量炎性细胞浸润外,在病理切片中还出现了成纤维细胞增生和基底膜增厚的组织结构异常。成纤维细胞是细胞外基质蛋白的最初来源,该类细胞可定植于纤维病灶并与邻近活性纤维病灶相连。同时,合成并沉积细胞外基质,导致组织重塑,进而影响鼻黏膜功能。理论上讲,抑制纤维化进程中的成纤维细胞增殖、活化及分化,在分子生物学角度可能对CRS的治疗具有重要的临床意义。
TGF-β1能够趋化并促进成纤维细胞分裂增殖及成熟分化,刺激成纤维细胞大量合成胶原蛋白Ⅰ、Ⅲ、Ⅳ型,同时可抑制胶原蛋白酶及纤溶酶原激活物的合成,增加蛋白酶抑制物的形成,促进细胞外基质的合成;促进合成释放多种细胞因子,提高其生物活性。
本实验研究结果显示,TGF-β1能够抑制NPF增殖及胶原蛋白的表达。在实验组和对照组应用TGF-β1第1天,细胞增殖情况无明显变化,可能TGF-β1和其相应受体结合需要一定的时间和过程,而在第3天及第5天,与对照组相比就表现出了明显的抑制细胞增殖作用,同样检测各组上清液中Ⅲ型胶原蛋白显示,TGF-β1在抑制细胞增殖的同时,也抑制了胶原蛋白的分泌。而bFGF在1~100 ng/mL浓度范围内表现为明显的促进作用,bFGF单独应用中也显示出了与细胞增殖情况相对应的胶原蛋白分泌。以往关于bFGF和TGF-β对于不同组织成纤维细胞的生长调控作用的研究结果,常出现不一致的结论。如傅亚娜等[7]研究发现TGF-β抑制人巩膜成纤维细胞的生长,而Schaafsma等[8]研究发现TGF-β能刺激肺成纤维细胞增殖及Ⅰ型胶原蛋白分泌,出现这种差异,可能是bFGF和TGF-β对不同细胞来源细胞增殖作用差异,提示组织重塑的机制是相当复杂的。
于睿莉等[9]研究也发现,在CRSwNP中发生上皮组织的脱落,鼻黏膜Ⅲ型胶原阳性且基底膜增厚,TGF-β1强阳性,而正常人鼻黏膜免疫组织化学染色显示这2项指标均呈阴性。在研究增厚的上皮下基底膜的超微结构和动态构造变化时发现,基底膜的增厚主要是由于胶原蛋白的沉积,这也是在下呼吸道和上呼吸道中发生组织重塑的重要标志。在哮喘患者的细支气管中基底膜的增厚主要是由胶原Ⅲ和Ⅴ型构成的网状纤维,这与病理中的纤维变性和瘢痕形成主要由胶原Ⅰ型构成,存在很大的区别[10],而在CRS黏膜重塑中主要以胶原Ⅲ和Ⅴ型构成为主[3]。
我们也研究了TGF-β1与bFGF联合应用对NPF细胞增殖及胶原蛋白分泌的影响,发现TGF-β1与bFGF具有拮抗作用,与单独作用相比,差异有统计学意义。Strutz等[11]发现,TGF-β诱导人肾成纤维细胞增殖的过程是通过bFGF介导的,这是导致成纤维细胞自主增殖的主要原因。Bosse等[12]研究发现,在人支气管平滑肌细胞的增殖过程中,TGF-β和FGF2发挥了协同作用。肺间质成纤维细胞增殖过程是由TGF-β介导的诱导细胞外FGF2释放和P38促分裂原活化蛋白激酶和c-Jun氨基端激酶的磷酸化而发挥作用。在CRS组织重塑中,TGF-β诱导的成纤维细胞变化可能与bFGF具有重要协同作用。这提示CRS组织黏膜重塑可能是多因素交叉的结果。但是在生理及病理条件下,生长因子的作用是极其复杂的,是多种因素共同作用的结果。生长因子的含量、相应受体的数量及细胞对其反应性的动态变化构成了生长因子调控的复杂性。在不同组织细胞中,可能还有其他细胞因子参与不同病理的形成,其具体机制极其复杂,将有待更多的相关研究发现。
[ 1 ] Tomassen P, Van Zele T, Zhang N, et al. Pathophysiology of chronic rhinosinusitis[J]. Proc Am Thorac Soc, 2011,8(1):115-120.
[ 2 ] Pawankar R, Nonaka M. Inflammatory mechanisms and remodeling in chronic rhinosinusitis and nasal polyps [J]. Curr Allergy Asthma Rep, 2007,7(3):202-208.
[ 3 ] Molet SM, Hamid QA, Hamilos DL. IL-11 and IL-17 expression in nasal polyps: relationship to collagen deposition and suppression by intranasal fluticasone propionate [J]. Laryngoscope, 2003,113(10):1803-1812.
[ 4 ] Bachert C, Patou J, Van Cauwenberge P. The role of sinus disease in asthma [J]. Curr Opin Allergy Clin immunol, 2006,6(1):29-36.
[ 5 ] 张罗, 周兵, 韩德民. 鼻窦炎的命名和分型现状 [J]. 中华耳鼻咽喉头颈外科杂志, 2008,43(8):627-630.
[ 6 ] Cauna N, Manzetti GW, Hinderer KH, et al. Fine structure of nasal polyps [J]. Ann Otol Rhinol Laryngol, 1972,81(1):41-58.
[ 7 ] 傅亚娜, 周翔天, 付小莹, 等. 碱性成纤维细胞生长因子和转化生长因子-β对人巩膜成纤维细胞的生长调控研究 [J]. 眼视光学杂志, 2008,10(3):186-189.
[ 8 ] Schaafsma D, McNeill KD, Mutawe MM, et al. Simvastatin inhibits TGFβ1-induced fibronectin in human airway fibroblasts [J]. Respir Res, 2011,12(1):113-122.
[ 9 ] 于睿莉, 朱冬冬, 董震. 慢性鼻-鼻窦炎鼻息肉内镜术后糖皮质激素对鼻黏膜重塑的影响 [J]. 中华耳鼻咽喉头颈外科杂志, 2006,41(10):773-776.
[10] Saglani S, Molyneux C, Gong H, et al. Ultrastructure of the reticular basement membrane in asthmatic adults, children and infants [J]. Eur Respir J, 2006,28(3):505-512.
[11] Strutz F, Zeisberg M, Hemmerlein B, et al. Basic fibroblast growth factor expression is increased in human renal fibrogenesis and may mediate autocrine fibroblast proliferation [J]. Kidney Int, 2000, 57(4): 1521-1538.
[12] Bosse Y, Thompson C, Stankova J, et al. Fibroblast growth factor 2 and transforming growth factor beta1 synergism in human bronchial smooth muscle cell proliferation [J]. Am J Respir cell Mol Biol, 2006,34(6):746-753.
(本文编辑 杨美琴)
Effects of basic fibroblast growth factor and transforming growth factor-β1 on the proliferation of fibroblasts from patients with nasal polyps
ZHANGBing-huang,GAOJing.
DepartmentofOtorhinolaryngology,theFirstAffiliatedHospitalofXiamenUniversity,Xiamen361003,China
GAO Jing, Email:GJDZB@126.com
Objective To investigate the effects of transforming growth factor-β1(TGF-β1) and basic fibroblast growth factor(bFGF) on the proliferation, collagen excretion of human nasal polyps fibroblast (NPF). Methods Human NPF was isolated and cultured.Nasal polyps fibroblast proliferation was measured by CellTiter 96®AQueous One Solution Cell Proliferation Assay(a),Collagen Ⅲ in the conditioned media was determined by enzyme-linked immunosorbent assay (ELISA). Results The impact of TGF-β1(1~100 ng/mL)on the growth of human NPF at different time(24, 72, 120 h) came up with different results.Various concentrations of TGF-β1 at 24 h could not inhibit the growth of NPF clearly; while TGF-β1(1,10,50,100 μmol/L) could inhibit the NPF growth at the extension of time(72,120 h). MTS colorimetric Am values showed a decreasing trend compared with the control group and the differences were statistically significant(allP<0.05). Various concentrations of TGF-β1 at 120 h could make type Ⅲ collagen in NPF supernatants gradually decrease,compared with the control group, and the difference was statistically significant (allP<0.01). bFGF in the concentrations of bFGF (1,10,50,100 ng/mL) could promote the NPF growth and the differences were statistically significant(allP<0.05).Combined application of TGF-β1 and bFGF showed an antagonistic effect compared with the control group. Conclusions TGF-β1 could inhibit the NPF growth,while bFGF could promote the NPF growth. TGF-β1 and bFGF may have an antagonistic effect on NPF, and may play a great role in the tissue remodeling of CRS. (Chin J Ophthalmol and Otorhinolaryngol,2015,15:272-275)
Sinusitis;Fibroblasts;Fibroblast growth factor 2; Transforming growth factor-β1;Mucosal remodeling
厦门大学附属第一医院耳鼻咽喉头颈外科 福建医科大学附属厦门第一医院耳鼻咽喉头颈外科 厦门 361003
高静(Email:GJDZB@126.com)
张炳煌为福建医科大学耳鼻喉科研究生 福州 350108
10.14166/j.issn.1671-2420.2015.04.013
2014-09-09)
