基因重组心肌肌钙蛋白I融合蛋白的抗肿瘤效应
2015-02-26雷光强刘朝阳姜懿纳李金萍曹勤燕刘凤鸣
雷光强,刘朝阳,姜懿纳,李金萍,曹勤燕,李 涛,刘凤鸣
(1.广西药用植物研究所,广西南宁 530024;2.中国医学科学院肿瘤研究所,北京 100021;3.湖南中医药大学药学院,湖南长沙 410208;4.常州大学制药与生命科学学院,江苏常州 213016;5.中国医学科学院基础医学研究所,北京 100050)
基因重组心肌肌钙蛋白I融合蛋白的抗肿瘤效应
雷光强1,刘朝阳2,姜懿纳3,李金萍4,曹勤燕1,李 涛5,刘凤鸣1
(1.广西药用植物研究所,广西南宁 530024;2.中国医学科学院肿瘤研究所,北京 100021;
3.湖南中医药大学药学院,湖南长沙 410208;4.常州大学制药与生命科学学院,江苏常州 213016;5.中国医学科学院基础医学研究所,北京 100050)
中国图书分类号:R-332;R322.12;R329.24;R364.3;R73-35;R977.6
摘要:目的 研究基因重组心肌肌钙蛋白I与人工短肽的融合蛋白(CIS)对肿瘤生长的作用。方法 用MTT法观察CIS体外对人脐静脉内皮细胞(HUVEC)生长的作用。利用鸡胚绒毛尿囊膜模型观察CIS对新生血管生长的影响。用6种小鼠肿瘤异位可移植模型观察CIS在体内对肿瘤生长的作用。结果 CIS对HUVEC细胞增殖具有明显抑制作用,并呈剂量依赖关系;鸡胚绒毛尿囊膜实验显示,CIS浓度为5、10 mg·L-1时,新生血管生成的数量明显减少;荷瘤鼠体内异位移植模型实验显示:CIS(10 mg·kg-1)处理组肿瘤生长缓慢,瘤体明显小于模型对照组,对S180肿瘤瘤重抑制率85.3%,对Lewis肺癌肿瘤瘤重抑制率87.0%,对H22肝癌肿瘤瘤重抑制率84.2%,对人小细胞肺癌H446肿瘤瘤重抑制率60.42%,对人可移植性肝癌SMMC7721肿瘤瘤重抑制率61.62%,对人胃低分化腺癌BGC823肿瘤瘤重抑制率为41.84%。结论 CIS在体外抑制HUVEC细胞的生长,在鸡胚绒毛尿囊膜实验中,CIS对新生血管生成有明显的抑制作用。在体内,CIS融合蛋白可有效抑制小鼠可移植肿瘤细胞的生长。CIS抗肿瘤效应很可能是通过抑制肿瘤组织中血管内皮细胞的增殖,进而减少肿瘤组织中新生血管生成的数量而达到的。
关键词:基因重组心肌肌钙蛋白融合蛋白;人脐静脉内皮细胞;鸡胚绒毛尿囊膜;移植瘤;肿瘤抑制作用;血管生成抑制剂;裸鼠
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.040.html
存在于肌组织中的76 ku的肌钙蛋白三聚体(troponin,Tn),主要参与调节肌肉收缩。它由3种亚基组成,分别是肌钙蛋白I(TnI,21 ku)、肌钙蛋白T(TnT,37 ku)和肌钙蛋白C(TnC,18 ku)。近十多年来,从非肌组织中提取的这3种蛋白亚基的功能学研究倍受重视。Moses等[1]于1999年首次从软骨组织中纯化提取出了TnI,并利用基因重组的人TnI在体外证实其具有抑制人脐静脉血管内皮细胞(HUVEC)增生的作用。同时,人TnI在鸡胚绒毛尿囊膜和小鼠角膜新生血管生成实验模型中,具有抑制新生血管生成作用,重组人TnI在B16小鼠恶性黑素瘤肺转移模型中,明显地抑制瘤细胞肺转移速率。随后,Feldman等[2]于2002年发现人TnI抑制血管内皮细胞增生的作用机制是通过与细胞bFGF竞争bFGF受体的结合。Kern等[3]找到TnI的活性位点,位于其氨基酸序列94-123的肽段具有抑制内皮细胞管腔形成、减少内皮细胞分裂、下调内皮细胞ICAM-1的表达、下调由CAPAN-1细胞所产生的VEGF-A的作用,抑制胰腺癌细胞的肝转移。Schmidt等[4]利用稳定转染的Morris肝癌细胞系(MH3924A)过量表达人TnI,与HUVEC共同培养后,发现过量表达的人TnI可减少HUVEC细胞的增殖速率,并增加HUVEC细胞的凋亡。同时,小鼠皮下荷瘤实验表明,肝癌细胞系中TnI的过量表达可减少肿瘤细胞的增生,促进肿瘤细胞的凋亡而抑制肿瘤细胞的生长。有研究表明,鲨鱼TnI也有抑制新生血管生成及肿瘤生长的作用[5-9],鲨鱼TnI与人源TnI有68.9%的同源性,其中活性多肽(Lys91-Leu123)与人源TnI有78.8%的同源性。基于上述研究,我们试图寻找具有临床应用前景的,可阻断肿瘤血管发生,进而减缓或阻断肿瘤细胞生长的人源骨骼肌型肌蛋白。本工作利用北京亿利高科生物工程技术研究所克隆重组的以人心肌组织的TnI为母板,以人工短肽为融合序列合成的融合蛋白(简称CIS),在体外大肠杆菌中高效表达纯化后,采用体外细胞学实验、鸡胚绒毛尿囊膜实验以及体内小鼠荷瘤动物模型实验,检测CIS对肿瘤细胞生长的作用及其可能作用机制,为进一步探究此融合蛋白的
抗癌药效奠定研究基础。
1 材料与方法
1.1试剂与药品 RPMI 1640培养基、胎牛血清、胰蛋白酶购自Hyclone公司。MTT、DMSO购自于Sigma公司。贝伐珠单抗注射液(安维汀,Avastin injection)人源化抗-VEGF单克隆抗体,罗氏制药有限公司产品,2~8℃冷藏避光保存,进口注册标准JS20050034。
1.2细胞 人脐静脉内皮细胞(HUVEC)细胞株购自于解放军军事医学科学院。S180腹水瘤细胞株、Lewis肺癌细胞株、H22肝癌细胞株由北京中国医学科学院肿瘤研究所提供。人小细胞肺癌H446细胞株、人可移植性肝癌SMMC7721细胞株、人胃低分化腺癌BGC823细胞株由北京中国医学科学院肿瘤研究所提供。
1.3实验小鼠 昆明小鼠、C57BL小鼠、ICR小鼠、Balb/c裸鼠16~18 g,SPF级,中国医学科学院实验动物研究所提供,实验动物质量合格证号SCXK(京)2009-0004。
1.4方法
1.4.1人心肌肌钙蛋白融合蛋白(CIS)体外表达纯化 本实验研究制品由北京亿利高科生物工程技术研究所提供,是以心肌肌钙蛋白I亚基为母板,以人工短肽为融合序列而合成的融合蛋白(CIS),构建于PET21a载体中,原核表达产物为29 ku的蛋白,SDS-PAGE法检测,结果对灰度值进行计算。CIS为体外表达并经过层析柱纯化的产物,除蛋白质外,不含有其它大分子物质,CIS蛋白质纯度为96.7%,溶剂为20 mmol·L-1PBS(150 mmol·L-1NaCl),pH 7.4的缓冲液。
1.4.2体外培养HUVEC增殖抑制实验 实验分为空白对照组、生理盐水对照组和CIS实验组(CIS 3组不同浓度)。HUVEC细胞按内皮细胞常规法进行培养,将培养生长正常的HUVEC细胞按每孔5× 104细胞分别接种于96孔板,37℃培养12 h后,换含有不同浓度CIS的新鲜培养液,空白对照换含有等体积生理盐水的新鲜培养液。37℃培养24 h和48 h,然后用MTT法测定细胞增殖状态。取出96孔培养板,每孔加入MTT溶液(5 g·L-1)20 μL,37℃继续培养4 h后终止培养,小心吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解,选择490 nm波长,在酶标仪上测定各孔的吸光值。计算CIS对细胞增殖的影响。抑制率/%=吸光值(CIS)/吸光值(生理盐水对照组)×100%。
1.4.3鸡胚绒毛尿囊膜实验 将30只种蛋置于(37±0.5)℃培养箱孵育,d 3剥开鸡蛋外壳,将发育中的鸡胚转移入无菌培养皿中继续培养。随即将鸡胚分为3组(10只鸡胚/组),选择在鸡胚卵黄囊血管区放置直径为7 mm无菌滤纸片,分别滴加不同浓度的无菌CIS溶液10 μL(5、10 mg·L-1)和无菌10 μL PBS溶液。每12 h滴加1次,连续3 d,观察鸡胚新生血管生成情况,并拍照记录结果。
1.4.4CIS对小鼠移植瘤S180肉瘤抑制实验 取昆明小鼠48只,实验分为磷酸盐缓冲液(PBS)对照组和CIS实验组1、5、10 mg·kg-1。实验开始前,每只鼠分别于腋窝皮下接种S180腹水瘤细胞株,4× 106细胞,随机分4组,每组12只,24 h后分别皮下注射PBS和不同浓度的CIS融合蛋白质溶液,每日2次,上、下午各1次,连续注射7 d。末次给药结束后,观察荷瘤鼠肿瘤生长情况,于停药后d 2处死动物,完整剖取肿瘤组织,并称量小鼠体重和瘤重,计算肿瘤抑制率。肿瘤抑制率/%=CIS实验组瘤体组织重量/PBS对照组瘤体组织重量×100%。实验组肿瘤抑制率与对照组相比较,用t-test检验(Office Excel软件)进行统计学分析,计算是否具有统计学意义。
1.4.5CIS对小鼠移植瘤Lewis肺癌生长抑制实验在超净台内取2只Lewis肺癌C57BL荷瘤小鼠,脱颈椎处死,无菌条件下取瘤组织,用生理盐水制成匀浆液。另取C57BL 6周龄小鼠30只,于每只小鼠右腋皮下接种匀浆液,每只0.2 mL,含4×106细胞,接种后d 2随机分成3组:PBS模型对照组和CIS实验组5、10 mg·kg-1,每组10只。24 h后分别皮下注射PBS和CIS,每日2次,上、下午各1次,连续注射10 d。末次给药结束后,观察荷瘤鼠表现,于停药后d 2处死动物,完整剖取瘤结并称瘤重和体重,按上述“1.4.4”中同样方法计算肿瘤抑制率,并进行统计学分析。
1.4.6CIS对小鼠移植瘤H22肝癌生长抑制实验在超净台内抽取H22肝癌荷瘤小鼠腹水,用无菌生理盐水将收集到的肿瘤细胞浓度调整为2×1010·L-1。取ICR小鼠30只,右前肢腋皮下接种,每只小鼠0.1 mL,于接种24 h后随机分为3组:PBS对照组和CIS组5、10 mg·kg-1,每组10只。3 d后分别皮下注射PBS和CIS,每日2次,连续注射12 d。末次给药结束后,观察荷瘤鼠表现,于停药后d 2处死动物,完整剖取瘤结并称瘤重和体重,按上述“1.4.4”中同样方法计算肿瘤抑制率并进行统计学分析。
1.4.7 CIS对人小细胞肺癌H446细胞株裸鼠移植瘤生长抑制实验 在超净台内取已在裸鼠体内传代生长良好的人肺癌H446肿瘤结节,无菌操作制成瘤细胞液,每组6只,共3组。每只小鼠0.1 mL,7 ×109·L-1,接种于裸鼠腋窝皮下。待肿瘤生长至可触及时(约100 mm3),分别皮下注射基因重组CIS和生理盐水(模型对照)、阳性贝伐珠单抗(Ava-stin injection,人源化抗人VEGF单克隆抗体注射液,美国罗氏公司产品)。基因重组CIS(5 mg· kg-1),每日2次,上、下午各1次,连续注射20 d。贝伐珠单抗(5 mg·kg-1)每周注射2次,共注射6次。于实验开始后,每4日用卡尺测一次皮下肿瘤长径和短径体积,末次给药结束后24 h,处死动物,完整剖取瘤结并称瘤重和体重,观察皮下移植瘤的生长情况,按上述“1.4.4”中同样方法计算肿瘤抑制率,并进行统计学分析。肿瘤体积=(长径×短径2)/2,以时间为横轴,肿瘤体积为纵轴,绘制肿瘤生长曲线。
1.4.8CIS对人可移植性肝癌SMMC7721细胞株裸鼠移植瘤生长抑制实验 取已在裸鼠体内传代生长良好人可移植性肝癌SMMC7721细胞肿瘤结节,无菌操作制成瘤细胞液,接种于裸鼠腋窝皮下,步骤同实验“1.4.7”。
1.4.9CIS对人胃低分化腺癌BGC823细胞株裸鼠移植瘤生长抑制实验 取已在裸鼠体内传代生长良好人胃低分化腺癌BGC823细胞肿瘤结节,无菌操作制成瘤细胞液,接种于裸鼠腋窝皮下,步骤同实验“1.4.7”。
2 结果
2.1CIS纯度检测 采用12%的SDS-PAGE胶进行电泳,结果显示,实验药品CIS电泳纯度为96.7%。

Fig 1 CIS purity detection by SDS-PAGE
2.2CIS对体外培养HUVEC细胞增殖影响 体外MTT实验结果显示,与生理盐水对照组相比,CIS对细胞增殖抑制作用呈剂量依赖关系。48 h,终浓度为1、5、10 mg·L-1时,CIS对HUVEC细胞增殖抑制率分别为49.5%、74.5%和81.1%(Tab 1)。

Tab 1 CIS decreased proliferation rate of HUVEC
2.3CIS对鸡胚绒毛尿囊膜血管生成的影响 鸡胚绒毛尿囊膜实验结果显示,与PBS对照组相比(Fig 2A),在覆盖CIS的鸡胚局部,由尿囊膜发出的新生血管数量明显减少或断裂(Fig 2B、2C),提示CIS融合蛋白具有抑制鸡胚新生血管生成作用。
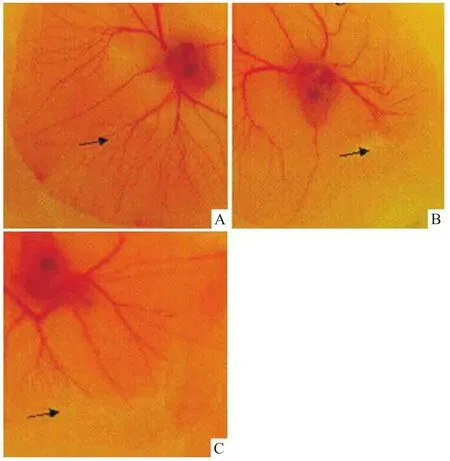
Fig 2 CIS reduced angiogene-sis on chick chorioallantoic membrane
2.4CIS对小鼠S180腹水瘤的抑制作用 实验结果表明,与PBS对照相比,CIS可明显抑制S180腹水瘤细胞在小鼠体内的生长,肿瘤抑制率为68.6% ~85.3%,呈剂量依赖性,且未见任何明显的毒副反应(Tab 2)。

Tab 2 Inhibitory effect of CIS on cell growth in mouse S180 ascites sarcoma model
2.5CIS对小鼠Lewis肺癌生长的影响 实验结果表明,与PBS对照相比,CIS可明显抑制Lewis肺癌细胞在小鼠体内的生长,肿瘤抑制率为81.0%
(CIS 5 mg·kg-1)和87%(CIS 10 mg·kg-1),且未见明显的毒副反应(Tab 3)。显微镜下观察结果与S180腹水瘤实验相似,基因重组CIS注射组肿瘤颜色苍白,毛细血管稀少,很少出血,坏死多。

Tab 3 Inhibitory effect of CIS on tumor cells’growth in Lewis L.C.mouse model
2.6CIS对小鼠H22肝癌生长的影响 实验结果表明,与PBS对照相比,CIS可明显抑制H22肝癌细胞在小鼠体内的生长,肿瘤抑制率分别为76.9% (CIS 5 mg·kg-1)和84.2%(CIS 10 mg·kg-1),且未见明显的毒副反应(Tab 4)。显微镜下观察结果与S180腹水瘤实验相似,基因重组CIS注射组肿瘤颜色苍白,毛细血管稀少,很少出血,坏死多。

Tab 4 Inhibitory effect of CIS on tumor cell growth in H22 hepatoma mouse model
2.7CIS对人小细胞肺癌H446细胞株裸鼠移植瘤生长的影响 实验结果表明,与对照相比,基因重组CIS可明显抑制小细胞肺癌H446细胞在裸鼠体内生长,肿瘤抑制率为60.42%,且未见任何毒副反应。阳性药贝伐珠单抗的抑制率为61.51%(Tab 5)。肿瘤生长曲线显示(Fig 3),CIS给药组体内肿瘤细胞生长明显减缓,其生长速度与贝伐珠单抗处理组相近,说明基因重组CIS的抑瘤效果与贝伐珠单抗的作用相近似。

Tab 5 Inhibition of CIS on transplanted small cell lung cancer cells growth in H446 for nude mice model

Fig 3 Tumor volume after administration of CIS on nude mice bearing H446 tumors
2.8CIS对人可移植性肝癌SMMC7721细胞株裸鼠移植瘤生长影响 实验结果表明,与对照组比较,基因重组CIS可明显抑制可移植性肝癌SMMC7721细胞在裸鼠体内生长,肿瘤抑制率为61.62%,且未见任何明显毒副反应。阳性药贝伐珠单抗的抑瘤率为63.37%(Tab 6、Fig 4),结果表明基因重组CIS具有与贝伐珠单抗相近似的抑瘤效果。

Tab 6 Inhibition of CIS on transplanted human hepatoma SMMC7721 cells in nude mice model

Fig 4 Tumor volume after administration of CIS on nude mice bearing SMMC7721 tumors
2.9CIS对人胃低分化腺癌BGC823细胞株裸鼠移植瘤生长影响 结果表明,与对照相比,基因重组
CIS可明显抑制胃低分化腺癌BGC823细胞在裸鼠体内生长,肿瘤抑制率为41.83%,且未见任何毒副反应。阳性药贝伐珠单抗的肿瘤抑制率为47.83% (Tab 7、Fig 5),结果表明基因重组CIS的抑瘤效果与贝伐珠单抗作用相近似。

Tab 7 Inhibition of CIS on transplanted human hepatoma BGC823 cells in nude mice

Fig 5 Tumor volume after administration of CIS on nude mice bearing BGC823 tumors
3 讨论
肿瘤血管生成抑制剂是当今抗肿瘤新药研究最活跃的领域之一。目前,已有数十种肿瘤血管生成抑制剂处于研发的不同阶段,有抑制基底膜降解药物、直接抑制内皮细胞增殖药物、抑制血管生成刺激因子药物、抑制内皮细胞特异性整合素/生存信号药物、其它药物有如碳氧氨咪唑等。多个研究小组报道[10-11],重组的人骨骼肌TnI和鲨鱼软骨提取的TnI具有抑制人脐静脉血管内皮细胞的增生、肿瘤细胞的凋亡、抑制B16小鼠恶性黑素瘤细胞的肺转、抑制胰腺癌细胞CAPAN-1的肝转移等作用,且这些作用与其抑制新生血管生成有关[2-4]。我们对心肌TnI的抗肿瘤作用进行了研究,表明重组人心肌TnI也具有抗肿瘤作用(未发表资料),但重组的人TnI在血液中半衰期短是其不足。我们利用基因工程技术,制备了以人心肌TnI与人工短肽的融合蛋白-CIS,进行体外表达,纯化,再进行药效学初筛,然后选择出高活性的融合蛋白CIS,在体外高效表达,发酵,纯化,获得了高纯度在血液中稳定性较高的基因重组人心肌肌钙蛋白融合蛋白(CIS)。我们的体内实验证实了CIS对小鼠S180腹水瘤、小鼠Lewis肺癌、小鼠H22肝癌、人小细胞肺癌H446细胞株裸鼠移植瘤、人可移植性肝癌SMMC7721细胞株裸鼠移植瘤、人胃低分化腺癌BGC823细胞株裸鼠移植瘤均有明显的抑制作用,说明基因重组CIS具有与人骨骼肌TnI和鲨鱼软骨中提取的TnI相似的肿瘤抑制作用。体外实验证实了CIS可明显抑制HUVEC细胞的增殖和鸡胚绒毛尿囊膜新血管的生成,同时体内实验也发现,CIS给药组瘤组织具有肿瘤组织毛细血管稀少、很少出血、坏死多等血管生成抑制表象。这些实验结果说明重组CIS的抗肿瘤作用与其肿瘤血管生成抑制作用有关。我们的实验同时采用已上市的肿瘤血管生成抑制剂贝伐单抗作为阳性对照药物,进行了其抑瘤作用效果的比较,实验结果表明,CIS抑制肿瘤生长的效果与贝伐单抗相近。因而,我们揭示了一个全新的以心肌TnI全序列为母板,与人工短肽融合形成的新的融合蛋白CIS具有明显的抗肿瘤作用,且其作用很可能是通过对血管内皮细胞的生长抑制而影响新生血管生成的机制来完成的。这为进一步研究CIS融合蛋白的抗肿瘤应用奠定了基础。
参考文献:
[1] Moses M A,Wiederschain D,Wu I,et al.Troponin I is present in human cartilage and inhibits angiogenesis[J].Proc Natl Acad Sci USA,1999,96(6):2645-50.
[2] Feldman L,Rouleau C.Troponin I inhibits capillary endothelial cell proliferation by interaction with the cell's bFGF receptor[J].Microvasc Res,2002,63(1):41-9.
[3] Kern B E,Iv J H B,Antoniu B A,et al.Troponin I peptide (Glu94-Leu123),a cartilage-derived angiogenesis inhibitor:in vitro and in vivo effects on human endothelial cells and on pancre-atic cancer[J].J Gastrointest Surg,2003,7(8):961-9.
[4] Schmidt K,Hoffend J A,Kiessling F,et al.Troponin I overex-pression inhibits tumor growth,perfusion,and vascularization of morris hepatoma[J].J Nuclear Med,2006,47(9):1506-14.
[5] Xie Q,Yao S,Chen X,et al.A polypeptide from shark troponin I can inhibit angiogenesis and tumor growth[J].Mol Biol Rep,2012,39(2):1493-501.
[6] Langer R,Brem H,Falterman K,et al.Isolations of a cartilage factor that inhibits tumor neovascularization[J].Science,1976,193(4247):70-2.
[7] Oikawa T,Ashino-Fuse H,Shimamura M,et al.A novel angio-genic inhibitor derived from Japanese shark cartilage(I).Extrac-tion and estimation of inhibitory activities toward tumor and embry-
onic angiogenesis[J].Cancer Lett,1990,51(3):181-6.
[8] Béliveau R,Gingras D,Kruger E A,et al.The antiangiogenic a-gent neovastat(AE-941)inhibits vascular endothelial growth fac-tor-mediated biological effects[J].Clin Cancer Res,2002,8(4):1242-50.
[9] 刘先俊,周辉云,邓显锋.人骨骼肌肌钙蛋白C在大肠杆菌中的表达及其抗肿瘤作用[J].中国生物化学与分子生物学报,2005,21(5):586-90.
◇消 息◇
[9] Liu X J,Zhou H Y,Deng X F.Human ThC expressed in E.coli and its effect on anti-tumor[J].Chin J Biochem Mol Biol,2005,21(5):586-90.
[10]Ara M,Hyodo M,Ohga N,et al.Identification and expression of troponin T,a new marker on the surface of cultured tumor endo-thelial cells by aptamer ligand[J].Cancer Med,2014,3(4):825-34.
[11]Chen C,Liu J B,Bian Z P,et al.Cardiac troponin I is abnormal-ly expressed in non-small cell lung cancer tissues and human canc-er cells[J].Int J Clin Exp Pathol,2014,7(4):1314-24.
Inhibitory effect of tumor growth of recombinant protein fused with cardiac troponin I and artificial peptide
LEI Guang-qiang1,LIU Zhao-yang2,JIANG Yi-na3,LI Jin-ping4,CAO Qin-yan1,LI Tao5,LIU Feng-ming1
(1.Guangxi Medical Botanical Institute,Nanning 530024,China;2.Cancer Institute and Hospital,Chinese Academy of Medical Sciences,Beijing 100021,China;3.School of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,China;4.School of Pharmaceutical Engineering&Life Science,Changzhou University,Changzhou Jiangsu 213016,China;5.Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,Beijing 100050,China)
Abstract:Aim To examine the inhibitory effect of re-combinant cardiac troponin fusion protein composed of subunit I and artificial peptide which was called CIS on tumor growth.Methods The CIS’s effect on the growth of human umbilical vein endothelial cells(HU-VEC)was examined using MTT assay in vitro.Chick chorioallantoic membrane model was applied to study the alteration of angiogenesis treated with purified re-combinant CIS protein.The effect of tumor growth trea-ted with CIS was observed using several in vivo mice xenograft models.Results There was a statistically significant reduction in HUVEC cell proliferative rate when the cells were treated with purified CIS fusion protein,which was also shown in a dose-dependent manner.A decreased amount of new blood vessel for-mation(angiogenesis)on chick embryo chorioallantoic membranes was observed in recombinant CIS protein treated group compared to the untreated control group. A significant inhibition of tumor growth rate was a-chieved in CIS treated mice compared to CIS untreated control mice in 6 different mouse xenograft models.Conclusions The fusion protein CIS shows the inhibi-tory effect on the tumor growth in our in vivo mouse models,and such inhibition could be mediated by the mechanism of CIS’s effect on the decrease of HUVEC cell proliferation and further the reduction of angiogen-esis in tumor tissues.This work could provide the foundation for the in-depth investigations on the phar-maceutical application of CIS targeting anti-tumor ther-apy.
Key words:recombinant fusion protein of myocardial troponin I(CIS);human umbilical vein endothelial cell(HUVEC);chick chorioallantoic membrane (CAM);xenograft tumor;inhibition of tumor growth;anti-angiogenesis;nude mice
作者简介:雷光强(1978-),男,助理研究员,研究方向:生物制药,E-mail:44277288@qq.com;刘凤鸣(1959-),男,博士,教授,研究方向:肿瘤分子生物学、基因工程药物,通讯作者,E-mail:mfliu1986@yahoo.com
基金项目:广西科学研究与技术开发计划(No桂科攻14124004-2-14)
收稿日期:2015-07-09,修回日期:2015-08-16
文献标志码:A
文章编号:1001-1978(2015)11-1580-06
doi:10.3969/j.issn.1001-1978.2015.11.020
