siRNA沉默survivin增强hNIS转染的鼻咽癌细胞株对131碘的敏感性
2015-02-24钟兴,弓健,郭斌,徐浩
钟 兴, 弓 健, 郭 斌, 徐 浩
(暨南大学附属第一医院1.医学影像中心超声科;2.核医学科,广东广州510632)
siRNA沉默survivin增强hNIS转染的鼻咽癌细胞株对131碘的敏感性
钟 兴1, 弓 健2, 郭 斌2, 徐 浩2
(暨南大学附属第一医院1.医学影像中心超声科;2.核医学科,广东广州510632)
目的:研究Survivin特异性小片段干扰RNA(siRNA)能否增强人钠碘同向转运体(hNIS)转染的鼻咽癌细胞株(CNE-2-hNIS)对131碘的放射敏感性.方法:设计并合成针对survivin基因的特异性siRNA,利用脂质体法转染CNE-2-hNIS细胞,通过实时荧光定量聚合酶链式反应(RT-qPCR)和Western blot方法检测细胞survivin基因沉默效果.CCK-8、克隆形成实验和AnnexinV FITC/PI双染流式细胞仪检测131碘孵育后对细胞增殖和凋亡的影响.结果:Survivin siRNA转染CNE-2-hNIS细胞72 h后,细胞的survivin基因mRNA和蛋白表达明显降低,Si-survivin组较SiRNA-NC组细胞增殖率降低,131碘孵育后,Si-survivin组较SiRNA-NC组细胞增殖率降低,凋亡率增高,差别有统计学意义(P<0.05).结论:Survivin特异性siRNA能显著沉默CNE-2-hNIS细胞的survivin基因的表达,增加CNE-2-hNIS对131碘的放射敏感性.
survivin; RNA干扰; 鼻咽癌; 钠/碘同向转运体; 碘放射性同位素
[Key words]survivin; siRNA; sodium/iodide symporter(NIS); nasopharyngeal carcinoma; iodine radioisotopes
鼻咽癌(Nasopharyngeal carcinoma,NPC)是中国南方及东南亚地区最常见的恶性肿瘤之一,放疗是其首选的治疗方法,但是对于放疗不敏感、放疗后病灶残留或复发,以及发生远处转移的患者,不少学者正积极探索其他有效的治疗手段.钠/碘同向转运体(sodium/iodide symporter,NIS)基因转染非甲状腺源的肿瘤细胞以介导放射性核素治疗肿瘤的研究,为探索内放射治疗肿瘤提供了一个新的研究领域[1-2].通过前期实验,本项目组已成功建立稳定表达hNIS的鼻咽癌细胞株CNE-2-hNIS,使得原本不能摄碘的鼻咽癌细胞能够摄取放射性核素131碘,经体内、外实验证实131碘能一定程度抑制hNIS转染鼻咽癌细胞增殖,并诱导其凋亡[3-4],但要达到治疗鼻咽癌的效果,仍需加强131碘对鼻咽癌的治疗作用.研究显示[5],鼻咽癌组织中survivin基因mRNA和蛋白质有着高表达,并且癌组织中的这种高表达与患者的不良预后密切相关.体外研究结果显示,许多恶性肿瘤细胞中,特别是具有放射抵抗的细胞中可以检测到Survivin的表达上调,Survivin的高表达与肿瘤细胞对放射抗性密切相关[6,7].为了进一步提高131碘对CNE-2-hNIS细胞的治疗效果,本组利用RNA干扰技术,沉默CNE-2-hNIS细胞株中survivin基因的表达,探讨survivin基因表达抑制后的CNE-2-hNIS细胞能否提高对131碘的敏感性,从而达到增强131碘的治疗效果.
1 材料与方法
1.1 材料
脂质体lipofectamine 2000及胎牛血清购自美国Invitrogen公司,RPMI-1640培养基购自GBICO公司.cDNA反转录试剂盒iScript cDNA Synthesis Kits购自Bio-Rad.iTaqTMUniversal SYBR®Green Supermix购自Bio-Rad.辣根过氧化物酶标记的山羊抗小鼠二抗购自Proteintech,ECL试剂盒购自Milipore.蛋白预览marker购自TransGene Biotech.Survivin抗体购自美国CST公司.
1.2 siRNA设计、合成和转染
Survivin siRNA的设计与合成由上海吉玛制药技术有限公司完成.在6孔板中接种处于对数生长期的CNE-2-hNIS(5×105/每孔),待细胞生长至密度达到60%~70%进行转染.转染过程参考lipofectamine 2000转染试剂说明书.转染分2组:转染Survivin siRNA为Si-survivin组(实验组),转染随机对照为SiRNA-NC组(对照组),转染步骤按照说明书进行.转染后72 h进行后续的实验.
1.3 RT-qPCR检测survivin m RNA的表达
Si-survivin组和SiRNA-NC组细胞弃培养液后PBS冲洗3次,通过Trizol法提取总RNA,用cDNA合成试剂盒反转录合成cDNA.设计特异性引物分别扩增survivin和内参Actin(survivin引物序列:上游5′-AGGCTGGCTTCATCCACTGC-3′,下游5′-TGTTCCTCTATGGGGTCGTCA-3′,Actin引物序列:上游5′-AGAGCTACGAGCTGCCTGAC-3′,下游5′-AGCACTGTGTTGGCGTACAG-3′).qPCR反应采用两步法.反应体系:iTaq Universal SYBR Green Supermix 7.5μL,上游引物0.3μL,下游引物0.3μL,cDNA 1μL,ddH2O 5.9μL.反应条件:95℃2 min,95℃10 s,60℃30 s 39个循坏.溶解曲线程序按照iTaqTNUniversal SYBR®Green Supermix说明书设计.
1.4 Western-blot鉴定Survivin蛋白的表达
Si-survivin组和SiRNA-NC组细胞弃培养上清液,用冰冷的磷酸盐缓冲液(PBS)漂洗细胞2次,加入预冷的细胞裂解液(50 mmol/L Tris-HCl,150 mmol/L NaCl,质量分数为0.02%叠氮钠,质量分数为0.1%SDS,质量分数为1%NP-40,质量分数为0.5%去氧胆酸钠,100 mg/L苯甲基磺酰氟(PMSF),1 mg/LA protinin)150μL,用细胞刮将细胞刮下,收集到1.5 mL离心管中,冰浴20 min后,于4℃、12 000×g离心15 min,收集上清液.蛋白样品与等体积2×上样buffer混匀,煮沸5 min,每孔上样10μL,质量分数为12%SDS-聚丙烯酰胺凝胶电泳分离样品.分离的蛋白质电转移到PVDF膜上,用封闭液(质量分数为5%脱脂奶粉溶于TBS-T)室温封闭1 h,将膜与用封闭液稀释的Ⅰ抗(小鼠抗人Survivin单克隆抗体1∶400)室温孵育2 h,TBS-T洗膜15 min×3次,将膜与辣根过氧化物酶标记的山羊抗小鼠IgG第Ⅱ抗体(1∶2 000)室温孵育1 h,TBS-T洗膜15 min×3次,加入ECL试剂显色发光,在暗室中用X-光胶片曝光,显影和定影.
1.5 Cell Counting Kit-8(CCK-8)检测131碘作用后的细胞增殖活性
Si-survivin组和SiRNA-NC组细胞常规培养,5 ×105/孔的密度接种于六孔板中,37℃、体积分数为5%CO2条件下过夜培养,弃去旧的培养液,用平衡Hank′s缓冲液(bHBSS)液清洗细胞2遍后,分别加入0、100μCi/mL的131碘的bHBSS,在37℃、体积分数为5%CO2条件下孵育7 h,吸弃含131碘的bHBSS,并用bHBSS液清洗数遍,胰酶消化,加培养液轻轻吹打成单细胞悬液,细胞计数,然后以5×103个/孔、3×103个/孔、1×103个/孔的密度分别接种于96孔板中(共7块),每孔体积200μL.37℃、体积分数为5%CO2条件下常规培养.分别于培养第1、2、3、4、5、6、7天后,每天取一块96孔板,每孔加入CCK-8 10μL,避免气泡带入孔内干扰读数,37℃继续孵育2 h.用酶标仪在450 nm波长处测定吸收光度,并计算肿瘤细胞增殖率.细胞增殖率=(实验组吸光度A值一空白组A值)/(对照组A值一空白组A值)×100%.
1.6 细胞克隆形成实验
Si-survivin组和SiRNA-NC组细胞常规培养,以5×105/孔的密度接种于六孔板中,37℃、体积分数为5%CO2条件下过夜培养,弃去旧的培养液,用bHBSS液清洗细胞2遍后,分别加入0、100μCi/mL131碘的bHBSS,在37℃、体积分数为5%CO2条件下孵育7 h,吸弃含131碘的bHBSS,并用bHBSS液清洗数遍,胰酶消化,加完全培养基轻轻吹打成单细胞悬液,细胞计数,以200个/孔的密度接种于六孔板中.37℃、体积分数为5%CO2条件常规培养14 d,培养期间要适时更换培养液.培养14 d后,弃旧培养液,PBS小心浸洗2次,加纯甲醇5 mL固定15 min,弃固定液,加适量龙胆紫溶液染色10 min,然后流水缓慢洗去染色液,空气干燥.在显微镜下计数大于50个细胞的克隆数,并计算克隆形成率:克隆形成率=克隆数/接种细胞数(100%).
1.7 AnnexinV FITC/PI双染流式细胞仪检测131I作用后细胞凋亡
Si-survivin组和SiRNA-NC组常规培养,以5× 105/孔的密度接种于六孔板中,37℃、体积分数为5%CO2条件下过夜培养,次日,弃去旧的培养液,用bHBSS液清洗细胞2遍后,加入0、100μCi/mL131碘的bHBSS,在37℃、体积分数为5%CO2条件下孵育7 h,吸弃含131碘的bHBSS,并用bHBSS液清洗数遍,更换完全培养基继续培养,每天观察细胞的变化,于24、48、72 h分别用质量分数为0.25%含乙二胺四乙酸(EDTA)胰蛋白酶分别消化细胞,用含血清的RPMI1640完全培养液终止消化.将收集细胞约1× 106个/mL,1 000 rpm室温离心5 min,弃去上清.用PBS洗涤细胞2次,室温1 000 rpm离心5 min,弃去上清,重悬于1 mL PBS中.取100μL细胞,约1× 105个细胞,加5μL PI和5μL AnnexinV/FTTC,室温下避光孵育15 min.加400μL孵育缓冲液,1h内进行流式细胞仪检测.在双变量流式细胞仪的散点图上,左下象限(FTTC-/PI-)显示活细胞;右上象限(FITC+/PI+)是晚期凋亡细胞;而右下象限(FTTC+/PI-)为凋亡细胞.
1.9 统计学处理
采用SPSS 10.0统计软件,计量资料实验数据以均数±标准差表示,应用t检验进行两均数间的差异性分析.
2 结果
2.1 Survivin基因表达的鉴定
RT-qPCR结果表明,Si-survivin组的Survivin mRNA表达较SiRNA-NC组降低,两组间差异有统计学意义(P=0.000 2),见图1.Western blot结果表明,Si-survivin组的Survivin蛋白表达较SiRNA-NC组明显降低,见图2.
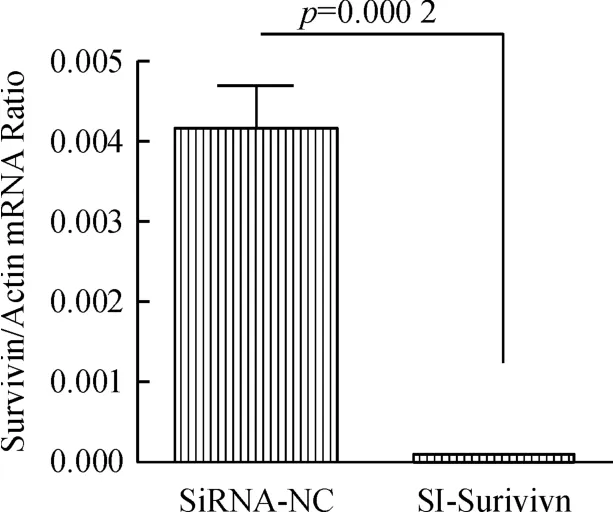
图1 RT-qPCR检测Si-survivin组和SiRNA-NC组中Survivin mRNA表达情况Fig.1 Survivin mRNA in Si-survivin group and SiRNA-NC group was detected by RT-qPCR

图2 Western blot检测Si-survivin组和SiRNA-NC组中的Survivin蛋白的表达Fig.2 Expression of Survivin protein in Si-survivin group and SiRNA-NC group was detected by Western blot
2.2 131碘作用后细胞增殖和凋亡的变化
CCK-8检测结果表明,Si-survivin组和SiRNANC组细胞在无131碘的作用时,第3 d Si-survivin组细胞增殖率下降,与SiRNA-NC组比较差别有统计学意义(t=6.56,P<0.01).经过100μCi/mL131碘孵育后,Si-survivin组和SiRNA-NC组细胞在1~7天增殖率均有一定程度下降,Si-survivin组较SiRNA-NC组细胞增殖率下降更为明显,差别有统计学意义(P<0.05),见图3.

图3 CCK-8检测0、100μCi/mL131碘作用于SiRNA-NC组和Si-survivin组细胞后在1~7 d细胞增殖率的改变Fig.3 The rate of proliferation of cells in SiRNA-NC group and Si-survivin group detected by CCK-8 after adding 0 and 100μCi/mL131I
体外克隆形成实验试验显示,在无131碘的作用时,Si-survivin组细胞克隆形成率(61.33±4.72)%较SiRNA-NC组(96.14±2.91)%下降,差别有统计学意义(t=10.87,P<0.01).经过100μCi/mL131碘孵育后,两组细胞克隆形成率均有降低,Si-survivin组细胞克隆形成率为(18±2.64)%,较SiRNA-NC组(34.33±3.05)%有明显下降,差别有统计学意义(t=7.01,P<0.01),见图4.

图4 SiRNA-NC组和Si-survivin组经0、100μCi/mL131碘作用于后细胞克隆形成率Fig.4 The rate of colon formation of cells in SiRNA-NC group and Si-survivin group after adding 0 and 100μCi/mL131I

图5 AnnexinV FITC/PI双染流式细胞仪检测0、100μCi/mL131碘作用于SiRNA-NC组和Si-survivin组后细胞凋亡情况(A和B为未加131碘作用的SiRNA-NC和Si-survivin组,C和D为加100μCi/mL131碘作用的SiRNA-NC和Si-survivin组)Fig.5 The apoptosis of cells in in SiRNA-NC group and Si-survivin group after adding 0 and 100μCi/mL131Idetected by AnnexinV FITC/PI
AnnexinV-FITC/PI双染流式细胞仪检测细胞凋亡的结果显示,在无131碘的作用时,Si-survivin组和SiRNA-NC组细胞凋亡率差别无统计学意义(t=1.64,P>0.05),经过100μCi/mL131碘孵育后,Sisurvivin组和SiRNA-NC组的细胞凋亡率均下降,但Si-survivin组的细胞凋亡率(28.27±4.87)%较SiRNA-NC组(10.54±3.87)%下降更为明显,两者差异有统计学意义(t=4.93,P<0.01).
3 讨论
Survivin是新近发现的凋亡抑制蛋白(IAPs)家族中分子量最小但抗凋亡能力最强的成员,主要作用是调控细胞凋亡和细胞分裂.Survivin基因几乎在所有的人类肿瘤细胞中表达,但在正常的末端分化组织中却很少能检测到,因此作为一个肿瘤特异性标记物,其研究逐渐成为肿瘤治疗相关领域的热点.研究[8]表明Survivin能抑制肿瘤细胞凋亡的发生,参与细胞周期的调控,诱导肿瘤血管的生成以及向周围组织浸润,并能增强肿瘤细胞对化疗和放疗的耐受性.Survivin蛋白的高表达与肿瘤细胞对放射抗性密切相关.Rödel等[9]研究显示,运用小干扰RNA降低结直肠癌细胞放射抵抗株SW480和HCT-15中Survivin的表达后,SW480和HCT-15细胞株对放射的敏感性增加,凋亡率增高,该研究的结果亦显示,Survivin的表达水平与直肠癌的患者进行放化疗的预后呈负相关.因此,survivin基因可以作为具有潜在价值的放射性治疗的新靶点,沉默该基因可能影响肿瘤对放射治疗的敏感性.
RNAi是一种通过细胞内导入双链RNA而导致靶基因表达抑制的进化保守的转录后基因沉默现象.RNAi在细胞内能通过多种途径(如RNA降解、转录抑制、翻译抑制及染色体重组等)引起特异基因的失活.随着对siRNA研究的不断深入,越来越多的研究显示siRNA在基因治疗领域有着潜在优势,与其他几种基因封闭技术相比,siRNA具有更强大、更持久的抑制基因表达的能力,并且具有体积小、序列特异性高和无免疫原性等优点,目前siRNA已经已成为一种新的放、化疗增敏途径[10].本项目组的研究显示,通过siRNA survivin基因后,CNE-2-hNIS细胞中的survivin的mRNA及蛋白表达明显降低,达到了抑制CNE-2-hNIS细胞中survivin基因表达的效果.
本组前期的实验表明将hNIS转染鼻咽癌细胞株后能引起细胞摄取131碘的增加,能一定程度抑制鼻咽癌细胞的增殖,诱导其凋亡.为了进一步增强131碘对鼻咽癌细胞的杀伤作用,本组将鼻咽癌细胞中的凋亡基因survivin进行抑制,在131碘的作用下,survivin抑制组的鼻咽癌细胞较未抑制组的增殖率及克隆形成率降低,凋亡率明显增高,达到增强131碘对鼻咽癌细胞的治疗作用.
本研究中通过RNA干扰的方法阻断CNE-2-hNIS细胞中Survivin的表达,体外实验结果显示,转染小干扰RNA可以有效阻断Survivin在CNE-2-hNIS细胞中的表达.survivin基因表达下调能够增强CNE-2-hNIS对131碘的敏感性,为鼻咽癌放射性碘的治疗提供了新的思路和方法.
[1] RIESCO-EIZAGUIRRE G,SANTISTEBAN P.A perspective view of sodium iodide symporter research and its clinical implications[J].Eur J Endocrinol,2006,155(4):495-512.
[2] WILLHAUCK M J,SHARIF SAMANI B R,GILDEHAUSF J,et al.Application of 188rhenium as an alternative radionuclide for treatment of prostate cancer after tumor-specific sodium iodide symporter gene expression[J].J Clin Endocrinol Metab,2007,92(11):4451-4458.
[3] 钟 兴,弓 健,郭 斌,等.hNIS转染介导鼻咽癌移植瘤放射性核素显像和治疗实验[J].中华核医学与分子影像杂志,2012,32(6):452-456.
[4] 钟 兴,弓 健,曾祥凤,等.转基因介导碘对鼻咽癌细胞增殖和凋亡的影响[J].暨南大学学报:自然科学与医学版,2010,31(4):387-392.
[5] XIANG Y,YAO H,WANG S,et al.Prognostic value of Survivin and Livin in nasopharyngeal carcinoma[J].Laryngoscope,2006,116(1):126-130.
[6] ALTIERID C.Survivin,cancer networks and pathway-directed drug discovery[J].Nat Rev Cancer,2008,8(1):61-70.
[7] ASANUMA K,MORIAIR,YAJIMA T,et al.Survivin as a radioresistance factor in pancreatic cancer[J].Jpn J Cancer Res,2000,91(11):1204-1209.
[8] ALTIERID C.Survivin,cancer networks and pathway-directed drug discovery[J].Nat Rev Cancer,2008,8(1):61-70.
[9] RÖDEL F,HOFFMANN J,DISTEL L,et al.Survivin as a radioresistance factor,and prognostic and therapeutic target for radiotherapy in rectal cancer[J].Cancer Res,2005,65(11):4881-4887.
[10]RAO D D,WANG Z,SENZER N,et al.RNA interference and personalized cancer therapy[J].Discov Med,2013,15(81):101-110.
[责任编辑:陈咏梅]
Survivin special siRNA enhanced radiosensitivity of nasopharyngeal carcinoma cells transferred human sodium/iodide sym porter gene to131I
ZHONG Xing1, GONG Jian2, GUO Bin2, XU Hao2
(1.Ultrasound Department of Medical Imaging Center;2.Department of Nuclear Medicine,the First Affiliated Hospital,Jinan University,Guangzhou 510632,China)
Aim:To explore the effects of siRNA-mediated survivin on the enhancement radiosensitivity of Nasopharyngeal Carcinoma cell transferred Human Sodium/Iodide Symporter Gene(CNE-2-hNIS)to131I.Methods:The survivin siRNA was successfully constructed and was transiently transfected into NPC cell line CNE-2-hNIS by liposome-mediated.The expression of survivin was detected by RT-qPCR and western blot.The proliferation and apoptosis of CNE-2-hNIS after treatment with131I in vitro were detected by CCK-8 cell proliferation,colony formation assay and Annexin V-FITC/PI double-labeled flow cytometry.Results:Significant down-regulation of the survivin protein expression was found after transfection of the survivin-siRNA in CNE-2-hNIS cells.With131I treatment,the rate of proliferation in survivin-siRNA group was gradually lesser,whereas the rate of cell apoptosis was gradually increased than those of SiRNA-NC group.Conclusion:The survivin special siRNA silenced survivin gene of CNE-2-hNIS and enhanced the radiosensitivity of CNE-2-hNIS to131I.
R736.1
A
1000-9965(2015)03-0246-05
10.11778/j.jdxb.2015.03.010
2015-01-13
广东省医学科研基金项目(A2012342);广东省科技计划基金项目(2011B061200028)
钟 兴(1974-),副主任医师,博士研究生,研究方向:分子影像学Mobile:13725197597;E-mail:tzhxing@jnu.edu.cn
