靶向survivin基因的shRNA慢病毒载体的构建及其对膀胱癌EJ细胞凋亡的影响
2015-02-24付生军王志平马宝良卢建中
陶 燕, 付生军, 洪 梅, 王志平, 马宝良, 卢建中
(兰州大学第二医院泌尿外科研究所,甘肃省泌尿系统疾病研究重点实验室,甘肃省泌尿系临床医学中心,甘肃兰州730030)
靶向survivin基因的shRNA慢病毒载体的构建及其对膀胱癌EJ细胞凋亡的影响
陶 燕, 付生军, 洪 梅, 王志平, 马宝良, 卢建中
(兰州大学第二医院泌尿外科研究所,甘肃省泌尿系统疾病研究重点实验室,甘肃省泌尿系临床医学中心,甘肃兰州730030)
目的:构建survivin基因特异性shRNA慢病毒干扰载体,转染膀胱癌EJ细胞,研究survivin基因在膀胱癌细胞株中的表达抑制情况,观察survivin shRNA慢病毒载体对EJ细胞凋亡的影响.方法:以survivin基因为靶标设计shRNA干扰序列,克隆至pSIH1-H1-copGFP慢病毒载体.干扰载体鉴定正确后转染膀胱癌细胞株EJ细胞,荧光显微镜下观察GFP表达情况,实时荧光定量PCR检测survivin基因mRNA含量变化,Western blotting法检测survivin蛋白表达,Annexin V-FITC/PI双染法检测EJ细胞凋亡情况.结果:PCR扩增鉴定、DNA测序证实survivin慢病毒干扰载体构建成功;EJ细胞经干扰载体处理后,EJ细胞survivin基因mRNA水平下调了73.33%,蛋白表达受到显著抑制,EJ细胞凋亡率达到24.39%.结论:成功构建了靶向survivin基因的shRNA重组慢病毒干扰载体,可以显著降低转染细胞survivin基因的表达水平,并有效提高膀胱癌细胞凋亡率.
载体构建; survivin; 短发卡状RNA(shRNA); 膀胱癌; 细胞凋亡
膀胱癌是泌尿系统最常见的恶性肿瘤,占中国泌尿系肿瘤发病率首位,2012年全国肿瘤登记地区膀胱癌的发病率为6.61/10万,列恶性肿瘤发病率的第9位,而在西方国家的泌尿系肿瘤中发病率居第2位,仅次于前列腺癌.因此探讨相关癌基因与膀胱癌的发生、发展的相关性对提高膀胱癌疗效具有重要意义.
生存素(survivin)是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族成员之一,具有抑制细胞凋亡和调节细胞周期的双重功能[1-2].survivin主要表达于胚胎和发育的胎儿组织中,高表达于大多数恶性肿瘤组织,而在终末分化成熟的正常成人组织中无表达或低表达[1,3-4],其表达与多种恶性肿瘤的侵袭转移和预后密切相关[5],使其有望成为肿瘤治疗的靶点.本研究利用分子克隆技术,采用慢病毒质粒载体在膀胱癌细胞系E J细胞内表达针对survivin基因的短发卡状RNA(short hairpin RNA,shRNA),以阻断细胞中survivin基因的表达,探讨survivin基因沉默后对EJ细胞凋亡产生的影响,为寻找新的肿瘤基因治疗途径提供实验依据.
1 材料与方法
1.1 材料
pSIH1-H1-copGFP shRNA慢病毒质粒载体、pSIH-lentivector-shLuciferase对照质粒为美国匹兹堡大学馈赠;survivin特异性DNA片段由上海英骏公司合成;100 bp DNA Ladder、BamHI、EcoRI限制性内切酶、T4DNA连接酶购自大连Takara公司;无内毒素质粒DNA小量抽提试剂盒购自上海生工公司;RPM I1640培养液和标准胎牛血清均为Hyclone公司产品;总RNA提取试剂Trizol、转染试剂Lipofectamine2000购自美国Invitrogen公司;两步法荧光定量PCR试剂盒GoTaq®2-Step RT-qPCR System购自Promega公司;胶回收试剂盒、RIPA细胞裂解液、BCA蛋白定量试剂盒购自碧云天公司;EJ细胞株、DH5α菌种为本研究所保存;β-actin单克隆抗体、survivin多克隆抗体为中杉公司产品;IRDye 800CW羊抗兔IgG(H+L)和IRDye 680RD羊抗鼠IgG(H+L)为美国Odyssey公司产品;Annexin V-FITC/PI凋亡检测试剂盒为美国BD公司产品.
1.2 方法
(1)survivin shRNA质粒载体构建 根据GENBANK中survivin的cDNA序列(NM-00168)参考Invitrogen公司shRNA设计原则和在线设计分析(http:∥www.ambion.com)设计1对shRNA干扰序列:正义链5′-GATCC GGACCACCGCATCTCTACATTCAAGAGAGTAGAGATGCGGTGGTCCTTTTT G-3′,反义链3′-G CCTGGTGGCGTAGAGATGTAAGTTCTCTACATCTCTACGCCACCAG GAAAA ACTTAA-5′.序列经同源性分析后,提交上海英骏公司合成.按质粒说明书方法将合成的DNA正义链及反义链变性、退火,形成的双链DNA与提前酶切的pSIH1-H1-copGFP shRNA线性质粒连接,连接产物转化DH5α感受态菌种,LB平板(AMP+)筛选阳性克隆,摇菌抽提的质粒用载体特异引物PCR扩增及琼脂糖电泳鉴定,并提交上海生工公司进行DNA序列测定.将测序验证正确的重组质粒命名为pSIH-lentivector-shSurvivin(shSur).无内毒素质粒DNA小量抽提试剂盒提取重组质粒,并于NanoDrop2000超微量分光光度计上测定质粒DNA浓度,进行后续细胞实验.

图1 pSIH1-H1-copGFP shRNA慢病毒质粒载体Fig.1 PSIH-H1-copGFP shRNA lencivector plasmid
(2)细胞培养及转染 EJ细胞常规培养于含体积分数为10%胎牛血清的RPMI1640完全培养液(pH=7.2,青霉素与链霉素质量浓度均为100μg/mL)中,在37℃、体积分数为5%CO2培养箱中培养.取对数生长期EJ细胞,按1.0×105/孔的数量转种于6孔培养板,待生长稳定并达到60%~80%的细胞贴壁融合时,用无血清RPMI 1640培养液配制shRNA,按照Lipofectamine2000说明书进行转染操作,转染4 h后弃去转染液换成含有体积分数为10%的胎牛血清培养液.本实验将干扰荧光素酶Luciferase的质粒载体pSIH-lentivector-shLuciferase(shLuc)作为阴性对照质粒.实验设置shSur转染组、shLuc转染组(阴性对照)、未转染对照组(control组).转染48 h后在数码倒置荧光显微镜下观察GFP表达状况,并拍照.
(3)实时荧光定量PCR检测survivin mRNA含量 shRNA质粒转染EJ细胞48 h后,提取各组细胞总RNA,并定量,各组取等量RNA反转录后进行实时荧光定量PCR检测.反转录引物为随机引物,反应条件为:25℃退火5 min,42℃延伸1 h,70℃灭活15 min.survivin荧光定量PCR引物正义链:5′-AGAACTGGCCCTTCTTGGAGG-3′,反义链:5′-CTTTTTATGTTCCTCTATGGGGT-3′.内参照物为GAPDH,PCR引物正义链:5′-ACCACAGTCCATGCCAGCAC-3′,反义链:5′-TCCACCACCCTGTTGCAGTA-3′.荧光定量PCR反应条件:95℃酶激活2 min;95℃变性15 s,60℃延伸1min,循环40次;60~95℃做熔解曲线.EJ survivin mRNA表达抑制率以质粒pSIH-lentivector-shLuciferase处理细胞的mRNA表达水平为对照,采用2-△△Ct法进行计算.
(4)Western blotting检测survivin蛋白表达水平 shRNA质粒转染EJ细胞72 h后,RIPA细胞裂解液抽提各组细胞总蛋白,BCA法定量,进行SDSPAGE电泳,分离胶的体积分数为12%,电压120 V,电泳90 min.电泳完毕后,半干电转印仪转膜,13 mA电转20 min后,PVDF膜加Odyssey封闭液4℃封闭过夜;加1∶1 000 PBS(浓度0.01 mol/L,pH=7.4)稀释的survivin抗体、β-actin抗体37℃孵育1 h;PBS+体积分数0.1%Tween-20洗涤3次,加1∶5 000稀释的荧光二抗37℃孵育40 min;PBS+体积分数0.1%Tween-20洗涤3次,PBS洗1次,Odyssey双色红外激光成像系统扫描检测分析.
(5)流式细胞仪检测细胞凋亡 EJ细胞转染shRNA质粒后72 h,胰酶消化,收集各组细胞,PBS洗涤并1 000 r/min,离心6 min共3次,收集细胞沉淀,PBS调整细胞数为(2.0~10.0)×105/mL,使用AnnexinV-FITC/PI双染色法凋亡检测试剂盒按操作说明进行凋亡染色,流式细胞仪检测细胞凋亡,细胞计数均大于1.0×104个.
1.3 统计学分析
用SPSS 18.0软件进行统计学分析,各组比较采用t检验,P<0.05为有统计学差异.
2 结果
2.1 重组质粒的PCR扩增鉴定及序列测定
(1)PCR扩增鉴定 重组质粒提取DNA后,PCR扩增,经琼脂糖凝胶电泳分析得到1条预期大小(166 bp)的特异性条带(图2),质粒pSIH-lentivector-shSurvivin符合设计要求.

图2 重组质粒PCR扩增鉴定Fig.2 The PCR products of the recombinant plasmid
(2)测序鉴定 将目的片段与pSIH1-H1-copGFP shRNA慢载体表达载体连接的阳性克隆测序,测得DNA序列证实含有目的片段序列(图3),表示质粒构建成功.
2.2 细胞转染
pSIH-lentivector慢病毒质粒载体结构中带有copGFP标记,因此成功转染质粒后依据细胞中GFP蛋白的荧光含量来确定重组质粒转染情况(图4).在未处理的EJ细胞未见绿色荧光出现,而在阴性对照质粒pSIH-lentivector-shLuciferase和重组质粒pSIH-lentivector-shSurvivin转染组细胞内均见大量的荧光,说明质粒pSIH-lentivector-shLuciferase和pSIH-lentivector-shSurvivin成功转染EJ细胞.
2.3 转染后E J细胞中survivin的表达

图3 重组质粒测序图Fig.3 The sequence analysis results of the recombinant plasmid
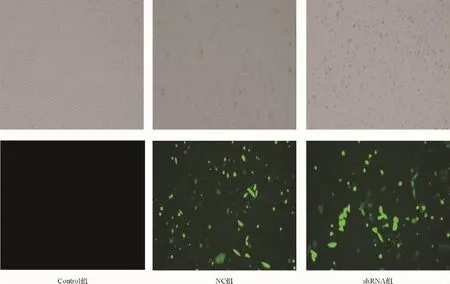
图4 转染的细胞荧光照片(×10)Fig.4 EJ cell transfected with the recombinant plasmid by lipofectamine 2000 in fluorescent microscope(×10)
(1)RT-PCR检测转染后72 h EJ细胞中survivin的表达 实时荧光定量PCR仪分析结果显示,与未转染组和阴性质粒对照组相比较,pSIH-lentivector-shSurvivin重组质粒转染的EJ细胞的survivin mRNA水平明显下调.survivin mRNA水平受到明显抑制,抑制率达73.33%.阴性对照质粒pSIH-lentivectorshLuciferase转染的EJ细胞相比于未转染组survivin mRNA水平无明显变化(图5).
(2)Western blotting检测转染后72 h EJ细胞中survivin蛋白的表达 转染72 h后,与未转染重组质粒的EJ细胞相比,pSIH-lentivector-shSurvivin重组质粒转染的E J细胞,survivin蛋白总量明显下调.未转染对照组和阴性对照质粒pSIH-lentivectorshLuciferase转染组的E J细胞survivin的总蛋白水平无明显差别.各组间β-actin和survivin蛋白表达水平(图6).

A:扩增曲线;B:熔解曲线;C:各处理组survivin基因的mRNA表达水平变化图5 实时荧光定量PCR仪分析图A.Amplification curve;B.Melt curve;C.The compare of mRNA expression of survivin.Fig.5 The mRNA expression levels of survivin detected by RT-PCR

图6 Western blotting检测survivin蛋白的表达Fig.6 Protein expression levels of survivin detected by Western blotting
2.4 流式细胞仪检测细胞凋亡
流式细胞仪检测结果显示,转染72 h后pSIH-lentivector-shSurvivin重组质粒转染的E J细胞的凋亡率为24.39%,而未转染对照组和阴性对照质粒pSIH-lentivector-shLuciferase转染的EJ细胞的凋亡率分别为4.12%、6.09%.说明重组质粒转染细胞后凋亡率明显上升(图7).
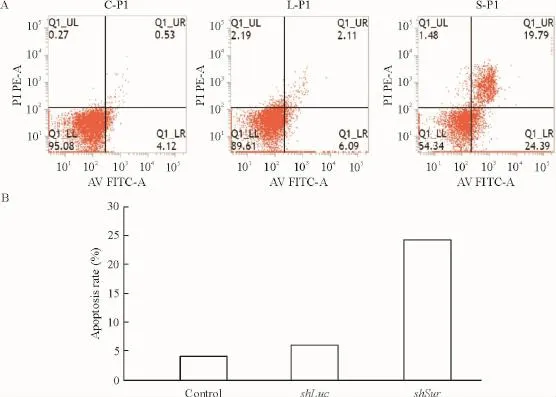
图7 重组质粒对细胞凋亡的影响.A:未转染质粒细胞对照组、阴性对照质粒组(shLuc组)、survivin重组质粒处理组(shSur)的流式细胞仪检测结果;B:不同处理组细胞凋亡率的比较.Fig.7 The effects of pasmid on apoptosis of EJ cells by Annexin V-F1PC/PI double staining assay.A:The original figs of control cell,control plasmid and recombinant plasmid on apoptosis of EJ cells.B:The compare of apoptosis rate of three groups.
3 讨论
近年来的研究均证实,生存素(survivin)在人类多数肿瘤中高表达,而在分化成熟的组织或细胞中并不表达.生存素不仅与肿瘤发生发展、侵袭转移有关[2-3,5],还与肿瘤放化疗敏感性及预后密切相关[6-8],因此阻断生存素基因的表达,以抑制肿瘤细胞增殖从而促进肿瘤细胞凋亡,成为肿瘤诊断和治疗的一个理想靶点.
survivin主要通过直接或间接与凋亡终末效应器半胱氨酸蛋白酶Caspase 3、Caspase 7结合并抑制二者活性,进而抑制细胞凋亡,导致细胞异常增殖和恶性转化[9-10],还能干扰p53的功能,主要是通过调节mdm2和其蛋白表达来进行干扰的[11].同时survivin还参与形成细胞周期过客蛋白复合体,是细胞周期调节过程中的重要因子[12-13].有研究表明特异性沉默survivin表达的肿瘤细胞,其裸鼠成瘤率明显降低、血管发生率也显著降低[14].也有研究资料显示survivin过度表达可能是预测、诊断、提示膀胱癌预后不良及产生耐药性的主要因素之一[8,15-16].
肿瘤的发生并非单个分子事件,而是1个多步骤过程,一般需要多个基因的改变,其中肿瘤抑制基因p53的突变是常见现象.多数人膀胱癌组织survivin的异常高表达的同时也伴随着野生型p53基因的突变.本实验选用的膀胱癌EJ细胞株是p53无义突变细胞株,细胞内survivin是高表达的.另外并非所有针对靶基因的19个特异的序列都能起到沉默基因的作用,在本实验设计中构建了针对survivin基因的重组慢病毒表达载体pSIH-lentivector-sh-Survivin.慢病毒载体转移基因片段容量大、不易诱发宿主免疫反应、安全性较好、不仅能感染分裂细胞,最大特点是可稳定整合于靶细胞的基因组,治疗基因表达时间长[17-18].将构建的的携带survivin shRNA的慢病毒表达载体成功转入EJ细胞后,有效抑制细胞中survivin基因mRNA水平,同时降低survivin蛋白的表达水平.流式细胞仪凋亡检测结果显示pSIH-lentivector-shSurvivin转染后的EJ细胞凋亡指数明显强于阴性对照质粒转染的EJ细胞,表明shRNA已发挥了沉默survivin基因的作用,促进了膀胱癌细胞的凋亡.作为1个与细胞凋亡有多重联系的肿瘤相关基因,survivin亚细胞定位表达在不同肿瘤细胞系甚至同一肿瘤细胞系的临床意义及预后也存在不同或相反的结论,分析可能与肿瘤的组织类型等有关,而Skagias等[19]揭示survivin在膀胱癌细胞中的核表达与肿瘤的分级、临床分期及复发相关,是预测无癌生存率的重要指标.本研究构建的带有GFP标记的慢病毒质粒载体为研究survivin在细胞中的定位等提供依据.
综上所述:RNAi特异性阻断了survivin的抗凋亡作用.近年来,基因治疗是肿瘤治疗研究的热点之一,而慢病毒表达载体已成为当前基因治疗中基因转移载体研究的热点,本研究中慢病毒质粒载体pSIH-lentivector-shSurvivin的成功构建,以及重组载体对膀胱癌细胞凋亡的影响,为深入研究survivin基因抗凋亡的分子机制,探讨其在膀胱癌发生、发展中的作用及为膀胱癌的基因治疗都提供一个实验依据.同时也为慢病毒表达载体携带shRNA介导的膀胱癌基因沉默治疗提供了实验依据,下一步将进行慢病毒载体包装和包装载体作用机理的研究,包括survivin作用机制、定位与调控、临床意义等.
[1] ATHANASOULA K,GOGAS H,POLONIFI K,et al.Survivin beyond physiology:orchestration of multistep carcinogenesis and therapeutic potentials[J].Cancer Lett,2014,347(2):175-182.
[2] ZHANG L,LIANG H,CAOW,etal.Downregulation of survivin by siRNA inhibits invasion and promotes apoptosis in neuroblastoma SH-SY5Y cells[J].Braz J Med Biol Res,2014,47(7):548-553.
[3] KIM SA,HONGR.Significance of intracellular localization of survivin in cervical squamous cell lesions:Correlation with disease progression[J].Oncol Lett,2014,7(5):1589-1593.
[4] AMBROSINI G,ADIDA C,ALTIERID C.A novel antiapoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[5] GAO F,ZHANG Y,YANG F,et al.Survivin promotes the invasion of human colon carcinoma cells by regulating the expression of MMP7[J].Mol Med Rep,2014,9(3):825-830.
[6] SUN H B,ZHENG H Y,YAN X.Survivin silencing enhances radiosensitivity in oral squamous cell carcinoma cell[J].Eur Rev Med Pharmacol Sci,2014,18(18):2678-2686.
[7] OR Y Y,CHOW A K,NG L,et al.Survivin depletion inhibits tumor growth and enhances chemosensitivity in hepatocellular carcinoma[J].Mol Med Rep,2014,10(4):2025-2030.
[8] MOWLA S J,EMADIB M,ZIAEE SA,et al.Evaluating expression and potential diagnostic and prognostic values of survivin in bladder tumors:a preliminary report[J].Urol J,2005,2(3):141-147.
[9] ZANGEMEISTER-WITTKE U,SIMON H U.An IAP in action:the multiple roles of survivin in differentiation,immunity and malignancy[J].Cell Cycle,2004,3(9):1121-1123.
[10]BLANC-BRUDE O P,MESRIM,WALL N R,et al.Therapeutic targeting of the survivin pathway in cancer:initiation of mitochondrial apoptosis and suppression of tumor-associated angiogenesis[J].Clin Cancer Res,2003,9(7):2683-2692.
[11]SAH N K,KHAN Z,KHAN G J,et al.Structural,functional and therapeutic biology of survivin[J].Cancer Lett,2006,244(2):164-171.
[12]YANG D,WELM A,and BISHOP JM.Cell division and cell survival in the absence of survivin[J].Proc Natl Acad Sci U SA,2004,101(42):15100-15105.
[13]BEARDMORE V A,AHONEN L J,GORBSKY G J,et al.Survivin dynamics increases at centromeres during G2/M phase transition and is regulated by microtubuleattachment and Aurora B kinase activity[J].JCell Sci,2004,117(Pt18):4033-4042.
[14]LIQ X,ZHAO J,LIU JY,et al.Survivin stable knockdown by siRNA inhibits tumor cell growth and angiogenesis in breast and cervical cancers[J].Cancer Biol Ther,2006,5(7):860-866.
[15]SHARIAT SF,ASHFAQ R,KARAKIEWICZP I,et al.Survivin expression is associated with bladder cancer presence,stage,progression,and mortality[J].Cancer,2007,109(6):1106-1113.
[16]SRIVASTAVA A K,SINGH P K,SRIVASTAVA K,et al.Diagnostic role of survivin in urinary bladder cancer[J].Asian Pac JCancer Prev,2013,14(1):81-85.
[17]ROTHE M,MODLICH U,SCHAMBACH A.Biosafety challenges for use of lentiviral vectors in gene therapy[J].Curr Gene Ther,2013,13(6):453-468.
[18]DHAMNE H,CHANDE A G,MUKHOPADHYAYA R.Lentiviral vector platform for improved erythropoietin expression concomitant with shRNA mediated host cell elastase down regulation[J].Plasmid,2014,71:1-7.
[19]SKAGIAS L,POLITI E,KARAMERIS A,et al.Survivin expression as a strong indicator of recurrence in urothelial bladder cancer.Predictive value of nuclear versus cytoplasmic staining[J].Anticancer Res,2009,29(10):4163-4167.
[责任编辑:朱颖嫄]
Construction and identification of survivin shRNA lentivirus vector and its effects on apoptosis of bladder cancer EJ cells
TAO Yan, FU Shengjun, HONG Mei, WANG Zhiping, MA Baoliang, LU Jianzhong
(Institute of Urology,the Second Hospital of Lanzhou University,Key Laboratory of Urological Diseases in Gansu Province,Gansu Nephro-Urological Clinical Center,Lanzhou 730030,China)
Aim:To construct an effective survivin gene shRNA lentiviral vector,and evaluate its effects on apoptosis of bladder cancer cell line EJ.Methods:The shRNA template of survivin was cloned into pSIH1-H1-copGFP shRNA vectors.The recombinant plasmid was identificated by agarose gel electrophoresis and sequencing analysis;then it was transfected into the EJ cells.The mRNA and protein levels were measured using real-time quantitative PCR and Western blotting assay respectively,and the apoptosis of EJ cells was measured by Annexin V-FITC/PI double staining assay.Results:The survivin gene shRNA lentivirus vector plasmid was successfully constructed.Agarose gel electrophoresis and sequencing analysis confirmed the correct of plasmid construction.After shRNA plasmid transfection,the mRNA levels of survivin was significantly suppressed(suppression rate 73.33%,P<0.05),and the pro-tein expression was decreased significantly.The apoptosis rate in the shRNA treated group was dramatically increased when compared to the control group.Conclusion:The survivin shRNA lentiviral vector significantly suppressed survivin expression and induced apoptosis of bladder cancer EJ cells.
vector construction; survivin; short hairpin RNA(shRNA); bladder cancer; cell apoptosis
R737.14
A
1000-9965(2015)03-0239-07
10.11778/j.jdxb.2015.03.009
2014-10-20
甘肃省科技计划项目(1308RJYA056);甘肃省泌尿系疾病临床医学中心开放课题基金项目(mnlczxkf-28);兰州大学中央高校基本科研业务费项目(lzujbky-2014-165)
陶 燕(1985-),女,研究方向:泌尿系肿瘤的分子生物学研究
卢建中(1972-),男,硕士,助理研究员,Tel:0931-8942498;E-mail:lujzh@lzu.edu.cn
