小白菊内酯对RAW 264.7炎症细胞因子表达的抑制
2015-02-24汤颖聪李启艳
汤颖聪, 杨 睿, 李 红, 李启艳
(1.云南省第一人民医院昆明理工大学附属医院牙周种植科,云南昆明 650032;2.暨南大学理工学院材料科学与工程系,广东广州 510632)
小白菊内酯对RAW 264.7炎症细胞因子表达的抑制
汤颖聪1, 杨 睿1, 李 红2, 李启艳1
(1.云南省第一人民医院昆明理工大学附属医院牙周种植科,云南昆明 650032;2.暨南大学理工学院材料科学与工程系,广东广州 510632)
目的:研究小白菊内酯对细菌脂多糖诱导炎症反应的抑制作用.方法:选用小鼠巨噬细胞RAW264.7,采用实时定量多聚酶链式反应及酶联免疫吸附法,检测不同浓度小白菊内酯(0.1、1、10、50μmol/L)和细菌脂多糖(10μmol/L)作用后,细胞因子的mRNA(IL-6、TNF-α、Ptgs2、IL-1β、IL-10、MMP13与CXCL1)及蛋白(IL-6、TNF-α、IL-1β与IL-10)表达水平的改变.实验同时设立4个对照组,包括DMSO组、脂多糖组、DMSO+脂多糖组及阳性药Bay 11-7082+脂多糖组.结果:浓度分别为10和50μmol/L小白菊内酯稳定有效地抑制脂多糖诱导小鼠巨噬细胞产生细胞因子.在mRNA水平上,IL-6、TNF-α、Ptgs2、IL-1β、IL-10与MMP13的mRNA表达水平明显下降,差异有显著性,CXCL1 mRNA表达水平改变无统计学差异;在蛋白水平上,IL-6、TNF-α、IL-1β与IL-10的表达亦显著性下降,有统计学差异.结论:小白菊内酯有效抑制了细菌脂多糖诱导的小鼠巨噬细胞中炎症细胞因子的表达.
小白菊内酯; 牙周炎; 脂多糖; 细胞因子; 抗炎
牙周病是人类两大口腔常见疾病之一,发病率高并严重危害人类的口腔健康,是成人牙齿丧失的首要原因[1].从本质上看,牙周病是一类以牙周结缔组织和骨组织破坏为特征的慢性炎症性疾病.细菌来源的脂多糖(lipopolysaccharide,LPS)激活宿主的免疫炎症反应,引起白细胞介素6(interleukin 6,IL-6),肿瘤坏死因子α(tumor necrosis factorα,TNF-α),白细胞介素1-β(interleukin 1-β,IL-1β),前列腺素E2(prostaglandin E2,PGE2),核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)以及基质金属蛋白酶(matrix metalloproteinases,MMPs)等多种细胞因子的表达,从而激活破骨细胞,促进其增殖和分化,最终导致不可逆转的骨破坏.因此,有效控制LPS激发的宿主免疫炎症反应是牙周再生治疗的前提条件[2].小白菊内酯(Parthenolide,PTL)是倍半萜烯内酯的主要成分,由天然植物野生甘菊中提取,用于治疗偏头痛、炎症和类风湿性关节炎等[3].近年有对其抗肿瘤方面的探讨颇多,并发现PTL可以增强化疗药物和放疗对肿瘤细胞的杀伤性[4-10].但目前的研究也证实,PTL具备强大的抗炎作用[8-10].本研究选用与免疫炎症反应密切相关的小鼠巨噬细胞RAW264.7,探讨PTL的抗炎作用及机制,为PTL在炎症性疾病治疗应用提供实验依据.
1 材料与方法
1.1 材料
(1)实验材料 小鼠巨噬细胞RAW264.7购自中国科学院昆明细胞库,编号KCB 200603YJ.
(2)主要试剂与仪器高糖DMEM培养基购自美国Hyclone公司,胎牛血清、胰蛋白酶和青霉素-链霉素溶液购自以色列Bioind公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自安徽Biosharp公司,小白菊内酯购自美国Selleck公司,NF-κB抑制剂Bay 11-7082购自美国Sigma公司,LPS(源自Aggregatibacter actinomycetemcomitans,Aa)由文学军教授(Virginia Commonwealth University,美国)惠赠.分析纯氯仿、异丙醇和无水乙醇购自北京化工厂,DEPC水购自上海生工生物公司,RNA逆转录试剂盒购自Takara公司,荧光定量PCR试剂盒购自北京康为世纪公司,ELISA试剂盒购自美国R&D Systems.RNA测定仪为美国Thermo Fisher Scientific公司产品;PCR仪为美国Bio Rad公司产品.
1.2 方法
(1)RAW264.7细胞培养 于含体积分数为10%胎牛血清、青霉素与链霉素质量浓度均为50 μg/mL的高糖DMEM培养液中,37℃、体积分数为5%CO2无菌培养箱中培养,对数期细胞用于实验.
(2)实时定量多聚酶链式反应(quantitative reverse transcription real-time polymerase chain reaction,qRT-PCR)检测细胞因子IL-6、TNF-α、Ptgs2、IL-1β、IL-10、MMP13和CXCL1的表达水平.
取对数期RAW264.7细胞,细胞按每孔3.0× 105接种于12孔板,过夜饥饿细胞,实验因素处理前更换为全培养液.对照组包括:DMSO组、Aa LPS组、DMSO+Aa LPS及阳性对照Bay 11-7082+Aa LPS组;实验组包括:PTL 0.1μmol/L+Aa LPS组、PTL 1μmol/L+Aa LPS组、PTL 10μmol/L+Aa LPS组及PTL 50μmol/L+Aa LPS组.DMSO、Bay 11-7082及PTL加入1 h后,Aa LPS加入,继续培养8 h后收集细胞.所提取总RNA的浓度及质量通过Nano Drop1000测定和检测,在Dyad Disciple PCR仪上进行,10μL反应体系包括200 ng总RNA,5倍PrimeScript缓冲液2μL,PrimeScript RT酶混合液Ⅰ0.5μL,浓度为50μmol/L Oligo dT Primer 0.5μL,浓度为100μmol/L Random 6 mers 0.5μL,无RNA酶水补足体积至10μL;反应条件为37℃15 min,85℃5 s.荧光定量PCR在C1000 Thermal Cycler仪器上进行,10μL反应体系包括模板cDNA 25ng,2倍UltraSYBR Mixture 5μL,浓度10μmol/L正向及反向引物各0.2μL,无RNA酶水补足体积至10 μL;反应条件为预变性95℃10 min,变性、退火和延伸为40个循环:95℃15 s,60℃1min.引物设计及合成由Takara大连宝生物公司完成(表1).以GAPDH为内参,各目标基因的定量表达水平采用-ΔΔCT法,以对照组DMSO+Aa LPS组的表达水平为参照进行计算.
(3)酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测细胞培养上清中细胞因子IL-6、TNF-α、IL-1β和IL-10的表达.
实验分组及过程同上,Aa LPS处理细胞24 h后,分别收集培养上清及细胞,培养上清中的IL-6、TNF-α、IL-1β和IL-10利用ELISA试剂盒检测,

表1 实时定量多聚酶链式反应的引物序列Table 1 Primers for quantitative reverse transcription real-time polymerase chain reaction
细胞裂解液中的蛋白浓度用DC Protein Assay试剂盒.各细胞因子的表达水平均采用相应样本的蛋白浓度进行了标准化.
1.3 统计学处理
数据的处理及做图采用软件Prism(version 4;GraphPad Software Inc.,San Diego,CA,美国)进行.多组间的比较采用单因素方差分析(one-way ANOVA),P<0.05表示有统计学差异.
2 结果
2.1 PTL对细胞因子mRNA表达的抑制作用
不同浓度PTL作用于RAW264.7细胞1 h以后,加入Aa LPS刺激8 h,各细胞因子的mRNA表达水平(图1).结果表明,随着PTL浓度的逐渐增加,大部分炎症细胞因子mRNA的表达水平逐渐降低.PTL浓度为10μmol/L时,对细胞因子mRNA表达水平的抑制作用稳定有效,实验组IL-6、TNF-α、Ptgs2、IL-1β、IL-10及MMP13 mRNA的表达水平与对照组DMSO+Aa LPS组比较,差异均有高度显著性.同时,阳性对照Bay 11-7082组中IL-6、TNF-α、Ptgs2、IL-1β、IL-10及MMP13 mRNA的表达水平也显著性降低.而CXCL1 mRNA的表达水平虽然在各PTL实验组有所降低,但与对照组DMSO+Aa LPS组比较差异没有显著性.
2.2 PTL对细胞因子蛋白水平表达的抑制作用
不同浓度PTL作用于RAW264.7细胞1 h以后,加入Aa LPS刺激24 h,细胞培养上清中细胞因子的蛋白表达水平(图2).与mRNA表达水平相对应,随着PTL浓度的逐渐增加,IL-6、TNF-α、IL-1β和IL-10在培养上清中的浓度逐渐下降.PTL浓度在10μmol/L和50μmol/L时,已完全抑制了各细胞因子的蛋白表达,差异呈高度显著性.
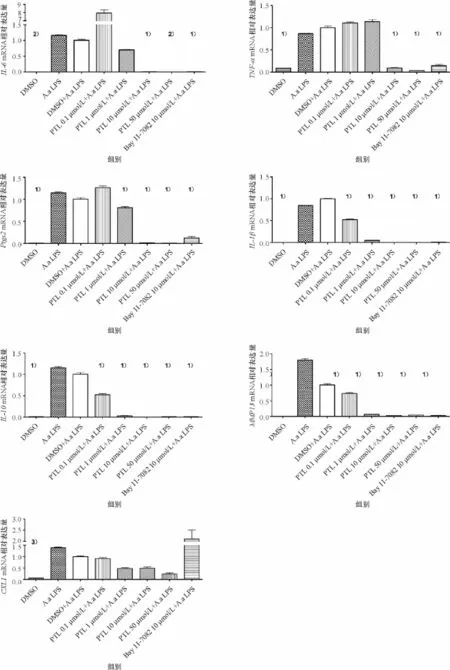
图1 PTL及LPS作用后,细胞因子mRNA的表达水平Fig.1 mRNA expression levels of cytokines after PTL and LPS treatment in RAW264.7

图2 PTL及LPS作用后,细胞因子的蛋白表达水平Fig.2 Protein expression levels of cytokines after PTL and LPS treatment in RAW264.7
3 讨论
在牙周炎的发生发展过程中,宿主的免疫反应在早期是保护性的,但随着大量炎症介质产生,最终引起牙周组织的破坏[11].来源于革兰氏阴性菌细胞壁外膜的LPS,具有很高的毒性和抗原性.LPS主要通过toll样受体4(toll-like receptor 4,TLR4),与白细胞分化抗原14(cluster of differentiation 14 molecule,CD14)和髓样分化蛋白2(myeloid differentiation protein 2,MD2)共同形成大分子复合体,激活髓样分化因子88(myeloid differentiation primary response gene 88,MyD88),主要通过κ基因结合核因子(nuclear factor-κ-gene binding,NF-κb)信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路,影响下游各种炎症介质:细胞因子、蛋白酶和前列腺素等的产生[12].以IL-1β、TNF-α及IL-6为主的细胞因子,与靶细胞上的特异性受体结合,激活细胞内信号级联反应,改变靶细胞基因表达,影响蛋白质合成,改变细胞行为,可传递、播散、放大免疫反应从而在免疫炎症反应和对抗感染方面具有重要作用,同时由于其强烈的生物学活性导致组织损伤.作为蛋白酶之一的MMPs则通过裂解细胞外基质分子,导致组织破坏.前列腺素是花生四烯酸被环氧化酶代谢后的产物之一,目前认为前列腺素主要介导产生MMPs和破骨性骨吸收.因此,通过阻断LPS诱导宿主产生过度免疫炎症反应信号通路上的相关分子,能有效抑制宿主过度炎症反应造成的组织破坏.伴放线聚集杆菌(Aggregatibacter actinomycetemcomitans,Aa)是目前证据充分的3种牙周致病菌之一,多年来在牙周炎的细菌病因学研究中,讨论得最多且研究较为深入[11],因此,本研究选用Aa来源的LPS作为免疫炎症反应的诱发因子,建立细胞炎症模型,同时选用NFKB抑制剂Bay 11-7082作为阳性对照,以验证药物的有效性.
关于PTL抗炎作用的研究,朱芳晓等[13]的动物实验发现,PTL显著性下调兔膝骨关节炎血清IL-1β及TNF-α的浓度,并且下降的幅度与PTL的浓度呈正相关.而在大鼠肾小球系膜细胞中,PTL抑制了高糖诱导的肾小球系膜细胞NF-κB的活化以及单核细胞趋化蛋白的表达[14].PTL还下调实验性小鼠溃疡性结肠炎动物模型中结肠组织髓过氧化物酶的活性及磷酸化NF-κB p65蛋白的表达,抑制IkB蛋白降解,最终降低TNF-α和IL-1β的产生[15].本研究中,PTL有效抑制Aa LPS诱导的小鼠巨噬细胞IL-6、TNF-α、Ptgs2、IL-1β、IL-10及MMP13等众多炎症细胞因子mRNA的表达,同时相应的IL-6、TNF-α、IL-1β和IL-10蛋白水平的表达降低.结果表明,巨噬细胞是PTL的作用靶点,PTL具有强大的抗炎效应,且浓度为10μmol/L的PTL作用稳定有效,是适宜的工作浓度,为将来PTL用于牙周疾病的治疗提供实验依据.
[1] SAVAGE A,EATON K A,MOLESD R,et al.A systematic review of definitions of periodontitis and methods that have been used to identify this disease[J].J Clin Periodontol,2009,36(6):458-467.
[2] KIRKWOOD K L,CIRELLI JA,ROGERS JE,et al.Novel host response therapeutic approaches to treat periodontal diseases[J].Periodontol2000,2007,43(1):294 -315.
[3] MATHEMA V B,KOH Y S,THAKURI B C,et al.Parthenolide,a sesquiterpene lactone,expresses multiple anti-cancer and anti-inflammatory activities[J].Inflammation,2012,35(2):560-565.
[4] NAM N H.Naturally occurring NF-kappaB inhibitors[J].Mini Rev Med Chem,2006,6(8):945-951.
[5] 曹方方,刘 璇,张继红,等.小白菊内酯通过阻断Akt,NF-κB信号通路诱导SK-N-SH细胞凋亡[J].中国现代医学杂志,2011,21(24):2963-2965.
[6] 易 雪,刘 芳,邹 萍,等.倍半萜烯内酯诱导WEHI-3细胞凋亡的实验[J].肿瘤防治研究,2011,38(12):1389-1392.
[7] GHANTOUSA,SINJAB A,HERCEG Z,et al.Parthenolide:from plant shoots to cancer roots[J].Drug Discov Today,2013,18(17/18):894-905.
[8] KREUGER M R,GROOTJANS S,BIAVATTIM W,et al.Sesquiterpene lactones as drugs with multiple targets in cancer treatment:focus on parthenolide[J].Anticancer Drugs,2012,23(9):883-896.
[9] PARADA T J,MITURA A,BRZANAW,et al.Parthenolide in-hibits proliferation of fibroblast-like synoviocytes in vitro[J].Inflammation,2008,31(4):281-285.
[10]LI-WEBER M,GIAISI M,TREIBER M K,et al.The anti-inflammatory sesquiterpene lactone parthenolide suppresses IL-4 gene expression in peripheral blood T cells[J].Eur J Immunol,2002,32(12):3587-3597.
[11]孟焕新.牙周病学[M].第4版.北京:人民卫生出版社,2012:58-60.
[12]NEWMAN M G,TAKEI H H,KLOKKEVOLD P R.Carranza’s Clinical Periodontology[M].11th ed.St.Louis,Missouri:ELSEVIER SAUNDERS,2012:232-293.
[13]朱芳晓,周润华,石宇红,等.小白菊内酯对兔膝骨关节炎血清IL-1β及TNF-α的影响[J].中国中西医结合杂志,2013,33(10):1382-1384.
[14]许兆忠,贾倩倩,李红瑜,等.小白菊内酯对高糖诱导的大鼠肾小球系膜细胞增殖及核因子-κB、单核细胞趋化蛋白-1表达的影响[J].南方医科大学学报,2013,33(10):1471-1473.
[15]ZHAO Z J,XIANG JY,LIU L,et al.Parthenolide,an inhibitor of the nuclear factor-κB pathway,ameliorates dextran sulfate sodium-induced colitis in mice[J].Int Immunopharmacol,2012,12(1):169-174.
[责任编辑:朱颖嫄]
Inhibitory effects of parthenolide on cytokine expression in RAW 264.7 cells
TANG Yingcong1, YANG Rui1, LI Hong2, LI Qiyan1
(1.Department of Periodontology and Implant Dentistry,the Affiliated Hospital of Kunming University of Science and Technology/the First People’s Hospital of Yunnan Province,Kunming 650032,China;2.Department of Materials Science and Technology,College of Science and Technology,Jinan University,Guangzhou 510632,China)
Aim:To study the inhibitory effects of parthenolide on LPS induced cytokine expression in RAW264.7 cells.Methods:Quantitative reverse transcription real-time polymerase chain reaction and enzyme linked immunosorbent assay were used to determine some cytokines’expression at mRNA levels(IL-6,TNF-α,Ptgs2,IL-1β,IL-10,MMP13 and CXCL1)and at protein levels(IL-6,TNF-α,IL-1β and IL-10)after treatment of parthenolide(0.1,1,10,50μmol/L)and Lipopolysaccharide(LPS,10μmol/L)in RAW264.7 cells.Four control groups were included in the study.They were DMSO group,LPS group,DMSO+LPS group,and Bay 11-7082+LPS group.Results:The mRNA expression levels of IL-6,TNF-α,Ptgs2,IL-1β,IL-10 and MMP13 were significantly decreased by 10 or50μmol/L parthenolide after RAW264.7 cells were treated with 10μmol/L LPS for 8 hours.However,no significant change of CXCL1 in mRNA expression level was observed.The protein levels of IL-6,TNF-α,IL-1βand IL-10 were also found to be inhibited by 10 or 50μmol/L parthenolide after RAW264.7 cells were treated with 10μmol/L LPS for 24 hours.Conclusion:Cytokines’expression induced by LPS in RAW264.7 cells was arrested by parthenolide.
parthenolide; periodontitis; lipopolysaccharide; cytokine; anti-inflammation
R93
A
1000-9965(2015)03-0233-06
10.11778/j.jdxb.2015.03.008
2014-10-09
国家自然科学基金项目(31070852,81160134);云南省中青年学术和技术带头人后备人才培养项目(2012HB027);云南省医学学科带头人培养项目(D-201232)
汤颖聪(1966-),女,研究方向:牙周疾病的治疗
李启艳(1971-),女,主任医师,博士,硕士导师,Mobile:15368088803;E-mail:ynliqiyan@aliyun.com
