CuO/TiO2的制备及其光催化性能研究
2015-02-24武小满余佳佳
武小满, 余佳佳
(许昌学院 化学化工学院, 河南 许昌 461000)
CuO/TiO2的制备及其光催化性能研究
武小满, 余佳佳
(许昌学院 化学化工学院, 河南 许昌 461000)
摘要:以钛酸丁酯和无水乙醇为反应物,采用溶胶-凝胶法制备CuO负载TiO2.以亚甲基蓝为模型反应物,实验结果表明,Cu/Ti元素质量比为30%,焙烧温度为500 ℃,产品光催化降解亚甲基蓝的反应性能最好.日光灯照射10 h后,亚甲基蓝的降解率可达58.4%.XRD表征结果显示,二氧化钛晶相为锐钛矿和金红石混晶结构,在Cu/TiO2中Cu以CuO晶体形式存在.
关键词:溶胶-凝胶法;CuO/TiO2;亚甲基蓝;光催化
二氧化钛(TiO2)由于具有较大的禁带宽度,优良的光电转化和光催化性能,较高的化学稳定性和光稳定性,且二氧化钛晶粒具有较高的吸附活性和催化活性,因此在光电转换、光催化等领域有着广泛的应用前景[1].目前,国外对二氧化钛材料的研究已比较深入,并实现了工业化生产[2].二氧化钛的化学制备方法主要有气相法和液相法两种[3].
由于单纯的纳米CuO材料和TiO2材料的光催化性能均相对较低,所以通常利用纳米复合材料的特殊光、电、声、热、磁、敏感应答、信息储存于传输、能量储存于释放等性能及效应来实现某种功能[4].由于Cu-TiO2界面处形成的肖特基势垒有助于加快光生载流子的输运,提高光生电子-空穴对的分离效率[5],所以将CuO与TiO2材料复合,在很大程度上弥补了TiO2等禁带宽度较大的半导体催化剂很难在可见光波长范围内催化降解的缺陷,从而制备出性能更优、用途更广、功能更强的复合催化材料[6].
本研究使用氧化铜对纳米二氧化钛进行改性以提高其光催化活性,主要原因有:(1)铜的掺杂能增加二氧化钛表面的氧空位,使表面吸附氧增多,提高量子效率;(2)CuO的费米能级比TiO2低,使光生电子从CuO向TiO2迁移,从而抑制光生电子—空穴的复合;(3)铜掺杂后TiO2的表面羟基数量增加,有利于光催化反应[7].
溶胶凝胶法同其他几种方法相比具有较明显的优点:(1)反应在溶液中较易进行,所需温度较低,节省能源;(2)溶胶-凝胶法可以实现分子水平上的均匀掺杂[8].本文通过溶胶-凝胶法制备不同铜含量的二氧化钛,研究其对亚甲基蓝的光催化活性.此外,对不同条件下制得的CuO/TiO2进行XRD表征,探讨其结构与性能的关系.
1二氧化钛光催化原理[9]
二氧化钛属于一种n型半导体材料,它的禁带宽度为3.2 eV(锐钛矿),当它受到波长小于或等于387.5 nm的光(紫外光)照射时,价带的电子就会获得光子的能量而越前至导带,形成光生电子(e-);而价带中则相应地形成光生空穴(h+).二氧化钛表面的光生电子e-易被水中溶解氧等氧化性物质所捕获,而空穴h+则可氧化吸附于二氧化钛表面的有机物或先把吸附在二氧化钛表面的OH-和H2O分子氧化成·OH自由基,该自由基是水中存在的氧化剂中最强的,能氧化水中绝大部分有机物及无机污染物,将其矿化为无机小分子、二氧化碳和水等无害物质.反应过程如下:
TiO2+hv→h++e-h++e-→热能
h++OH-→-OH h++H2O→-OH+H+
e-+O2→O2-O2+H+→HO2-
2H2O→O2+H2O2H2O2+O2→-OH+H++O2
OH-+dye→…→CO2+H2O H++dye→…→CO2+H2O
2实验部分
2.1试剂与仪器
钛酸丁酯,无水乙醇,亚甲基蓝,硝酸铜,硝酸均为分析纯.
85-2A数显恒温磁力搅拌器(金坛市杰瑞尔电器有限公司),电热恒温鼓干燥箱(上海精宏实验设备有限公司),电子天平(北京赛多利斯仪器系统有限公司),KQ3200型超声波清洗仪(昆山市超声仪器有限公司),TDZ4-WS低速台式离心机(湖南湘仪实验室仪器开发有限公司),T22S可见分光光度计(上海菁华科技有限公司),箱式电阻炉(上海实研电炉有限公司),X射线衍射仪(德国Germany Bruker公司).
2.2催化剂的制备
采用溶胶-凝胶法,以钛酸丁酯为钛前驱体,硝酸铜为铜源,通过配比不同含量硝酸铜进行铜改性二氧化钛光催化剂的制备.
2.2.1溶液配制
室温下,先量取30 mL无水乙醇和5 mL钛酸丁酯,加入到100 mL烧杯中,磁力搅拌30 min后,得到透明的淡黄色溶液A;再用3 mL蒸馏水,20 mL无水乙醇,0.7 mL硝酸配置成混合溶液,准确称取一定量的硝酸铜溶于其中,超声5 min,得到溶液B.mCu:mTi分别为10%、20%、30%、35%、40%.
2.2.2溶胶过程
将B溶液通过滴定管缓慢滴加到搅拌的溶液A中,滴加完毕后,继续搅拌30 min,使溶液混合均匀,通过激光笔观察是否形成溶胶.
2.2.3凝胶过程
混合后的溶液,在室温下静置16 h,形成凝胶;若室温较低,可在静置后,于40 ℃恒温水浴槽中保持30 min,则形成凝胶.形成的凝胶于80 ℃下干燥7 h,就得到干燥产品.
2.2.4焙烧过程
将干燥后的产品,置于马弗炉中,以3 ℃/min升温到500 ℃,保持温度2 h,自然降温后,研磨备用.
2.3光催化性能试验
采用自制的电光源化学反应器,以亚甲基蓝为降解模型反应物,光源采用500 W的日光灯,评价CuO/TiO2的光催化活性.操作方法如下:
(1)配制10 mg/L的亚甲基蓝溶液;
(2)以100 mL烧杯做反应器,光源垂直照射反应器,光源距反应溶液的距离约为10 cm;
(3)向烧杯中加入50 mL亚甲基蓝溶液和50 mg的催化剂,避光搅拌30 min后,在日光灯照射下反应一定时间,同时进行电磁搅拌,所有反应均在室温下进行.光催化反应结束后,离心,吸取上层清液,测出溶液的吸光度,进而得到在亚甲基蓝最大吸收波长(665 nm)处的吸光度A.光催化活性用降解率η来表征,其值为

式中:A0为光照前亚甲基蓝的初始吸光度;At为光照t时间后亚甲基蓝的吸光度.
2.4催化剂表征
采用D8-Advance型X射线粉末衍射仪分析样品的晶相结构;
利用谢勒公式D=0.89λ/(Bcosθ),计算样品的平均晶粒粒径.
3结果与讨论
3.1催化剂活性的影响因素
3.1.1不同比例对催化剂活性的影响

图1 不同mCu :mTi对亚甲基蓝降解率的影响
图1为500 ℃,煅烧2 h条件下,不同mCu:mTi催化剂对亚甲基蓝降解率的影响曲线.可以看出,当mCu:mTi低于30%时,随着mCu:mTi的升高,催化活性有所增加,但均略低于单纯TiO2的催化活性;当mCu:mTi为30%时,催化活性达到最高,且催化活性显著高于单纯TiO2;当mCu:mTi再继续增加时,催化剂活性则呈现出下降趋势,故最佳mCu:mTi为30%.
3.1.2不同煅烧温度对催化剂活性的影响
表1为mCu:mTi为30%,不同煅烧温度下煅烧2 h时催化剂对亚甲基蓝的降解率.可以看出,煅烧温度低于500 ℃时,随着煅烧温度的升高,催化活性增加;在500 ℃时催化活性达到最大值;高于500 ℃后,催化活性开始降低.故最佳焙烧温度为500 ℃.
3.1.3不同煅烧时间对催化剂活性的影响
表2为500 ℃,mCu:mTi为30%,不同煅烧时间时催化剂对亚甲基蓝的降解率.可以看出,500 ℃时,焙烧时间为2 h时光催化活性最大,小于或大于2 h,催化活性都会降低,故最佳焙烧时间为2 h.可能原因见XRD分析.

表1 不同煅烧温度下Cu/TiO2催化亚甲基蓝的活性

表2 不同焙烧时间下催化亚甲基蓝的活性
3.2催化剂的XRD表征分析
3.2.1500 ℃焙烧2 h下单纯TiO2的XRD图

图2 单纯TiO2与mCu :mTi =30%的XRD图注:a) TiO2;b) mCu :mTi =30%.
图2(a)为500 ℃下焙烧2 h时,单纯TiO2的XRD图对照XRD标准数据库,2θ=25.3°、37.9°、48.1°、53.9°、55.3°、62.7°、69.0°、70.2°、75.4°、83.2°处的衍射峰,可分别对应TiO2的(101),(103),(200),(105),(211),(213),(116),(220),(107),(303)等晶面,这都与锐钛矿相TiO2的PDF卡相吻合.此外,2θ= 27.5°、36.0°、41.2°处的衍射峰,可对应TiO2的(110),(101),(111)晶面,与金红石相TiO2的PDF卡号对应.图2(b)为500 ℃焙烧2 h下mCu:mTi为30%的XRD图,对照XRD标准数据库,除了锐钛矿相TiO2的衍射峰外,在2θ=35.6°、38.8°处的衍射峰可分别对应单斜相CuO的(002),(111)晶面.
对比图2(a)、(b)可看出,单纯TiO2中,500 ℃焙烧2 h后,金红石相的衍射峰比较强,说明TiO2为混晶结构,且金红石相的含量较高;而在负载CuO后,锐钛矿相的衍射峰变弱,宽化,金红石相衍射峰也相应弱化,相应出现明显的CuO衍射峰.负载的CuO活性相作为Schottky 能垒可阻止电子与空穴的重新复合[10].
由图1可知,mCu:mTi为30%时催化剂对亚甲基蓝的降解率明显优于单纯TiO2对亚甲基蓝的降解率.从XRD角度分析可能是:(1)CuO衍射峰的出现,增加了催化剂对亚甲基蓝的降解率;(2)单纯TiO2的金红石相衍射特征峰比较强,影响了其降解率.
3.2.2500 ℃焙烧2 h条件下不同mCu:mTi催化剂的XRD图

图3 不同mCu :mTi催化剂的XRD图注:a) 10%; b) 20%; c) 30%; d) 35%; e) 40%.
图3为500 ℃焙烧2 h条件下不同mCu:mTi催化剂的XRD图,其衍射特征峰主要对应为锐钛矿相.不同之处在于:图3(b)(d),2θ=27.5°、36.2°、41.3°处的衍射特征峰,可对应金红石相TiO2的(110),(101);图3(a)只观察到金红石相在2θ=27.5°处的衍射特征峰,其他峰由于太弱未能观察到;图3(c)在2θ=35.6°、38.8°处的衍射特征峰可对应单斜相CuO的(002),(111)晶面;图3(e)则只观察到金红石相在2θ=36.2°处的衍射特征峰,其他峰由于太弱未观察到.
由图3分析可知,随着mCu:mTi的增加,金红石相的衍射特征峰先是逐渐增强.在mCu:mTi达到30%时,金红石相衍射特征峰开始弱化,并在mCu:mTi为30%时出现了单斜相CuO的衍射特征峰;在mCu:mTi大于30%以后,金红石相衍射特征峰进一步逐渐弱化,单斜相CuO的衍射特征峰也同时弱化消失.因此可以看出,单斜相CuO的衍射特征峰明显加强了催化剂对亚甲基蓝的催化活性,金红石相衍射特征峰将会削弱催化剂的活性.
3.2.3mCu:mTi为30%,焙烧2 h条件下,不同焙烧温度时的XRD图
图4为mCu:mTi为30%,焙烧2 h条件下,不同焙烧温度时的XRD图.分析可知,焙烧温度在500 ℃以下时只观察到锐钛矿相衍射特征峰,金红石相衍射特征峰未出现,可能是因为煅烧温度相对较低,还未达到金红石相的转变温度.在500 ℃焙烧时,开始出现少量金红石相TiO2和单斜相CuO的衍射特征峰,对应催化活性显著增强,说明适量的混晶比和CuO晶粒能促进光催化活性的提高.焙烧温度再升高至600 ℃,金红石相TiO2衍射特征峰相当明显,而锐钛矿相衍射特征峰弱化,即过量金红石相TiO2降低了催化剂的催化活性.
3.2.4500 ℃下,mCu:mTi为30%时,不同焙烧时间时的XRD图
图(5)为500 ℃,mCu:mTi为30%时,不同焙烧时间时的XRD图.分析可知,在500 ℃下只煅烧1 h,由于煅烧时间较短,催化活性也相对较低,形成的为锐钛矿相衍射特征峰,未出现金红石相衍射特征峰;焙烧2 h时才开始出现单斜相CuO的衍射特征峰,同时具有较明显的金红石相衍射特征峰;焙烧3 h后金红石相衍射特征峰增强,对应的催化活性降低.
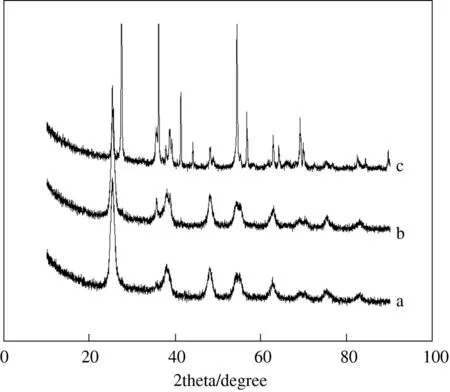
图4 不同煅烧温度Cu/TiO2的XRD图注:a) 450 ℃; b) 500 ℃; c) 600 ℃.

图5 500 ℃ mCu : mTi =30%不同焙烧时间下的XRD图注:a) 1 h;b) 2 h;c) 3 h.
3.3粒径大小分析
由衍射图结合谢乐公式
d=κλ/βcosθ,
其中:d为晶粒粒径,nm;κ=0.89;衍射线波长λ=0.154 06 nm;β是衍射峰的半高宽,单位为弧度;θ为衍射角;以2θ= 48.1°为准,计算得不同样品中TiO2的平均晶粒尺寸.
对于CuO/TiO2复合材料粒径的计算,通常均采用锐钛矿相下的2θ=48.1°处的衍射特征峰来计算半峰高.原因在于:在2θ=25.3°处的衍射峰会有金红石相形成的衍射峰干扰其峰宽,影响计算的准确性,而48.1°处的衍射峰一般为独立峰,几无干扰.
3.3.1500 ℃下焙烧2 h时不同mCu:mTi时催化剂粒径大小数据图
图6为500 ℃下焙烧2 h时,不同mCu:mTi时催化剂粒径大小数据图.分析可知,随着Cu/Ti元素质量比的逐渐提高,TiO2的晶粒粒径逐渐减小,在mCu:mTi大于30%时,TiO2的晶粒粒径不再有明显变化.而当mCu:mTi= 30%时,由于具有较大的比表面积,催化活性也较高.当Cu/Ti元素质量比小于30%时,TiO2的晶粒粒径比单纯TiO2的粒径小,可能是由于前者体系中金红石相较多所致(见图3(a)、3(b)).
3.2.2mCu:mTi为30%时焙烧2 h下不同焙烧温度时催化剂粒径大小数据图
图7为mCu:mTi为30%时焙烧2 h下不同焙烧温度时催化剂粒径大小数据图.分析可知,焙烧温度低于500 ℃时,金红石相衍射峰未出现,复合材料的粒径大小基本保持不变.500 ℃焙烧温度以下的催化剂,虽然晶粒较小,但是其结晶度较差,影响了其催化活性.随着焙烧温度的升高,复合材料的粒径呈现逐渐升高的趋势,在500 ℃时的催化粒径小于600 ℃ 时的粒径,此时,催化剂的比表面积较大,催化剂的催化活性也较高.

图6 不同mCu : mTi的催化剂平均晶粒粒径

图7 不同焙烧温度时的催化剂平均晶粒粒径
3.3.3500 ℃mCu:mTi为30%时不同焙烧时间下的催化剂粒径
表5为500 ℃mCu:mTi为30%时不同焙烧时间下的催化剂粒径.分析可知,随着焙烧时间的增加,复合材料的粒径逐渐呈现增大趋势.煅烧时间较短时,催化剂的结晶度较差,致使催化活性降低.随着煅烧时间的增加,复合材料的粒径逐渐增大,因此,焙烧2 h时,催化剂比表面积较高,催化活性较好.

表5 不同焙烧时间时催化剂平均晶粒粒径
3.4光照时间对催化活性的影响
称取mCu:mTi=30%,在500 ℃下焙烧2 h制备的催化剂0.050 0 g,降解于50 mL 10 mg/L的亚甲基蓝溶液中.每隔1 h取样,取10 mL溶液,离心分离15 min,在亚甲基蓝最大吸收波长(665 nm)处测定其吸光度,通过计算降解率来确定最佳光照时间.
图8为500 ℃焙烧2 h且mCu:mTi为30%时催化剂对亚甲基蓝降解率随光照时间变化的数据图.分析可知,随着光照时间的增加,对亚甲基蓝的降解率呈现逐渐增加的趋势,且在7 h后的增长趋势变慢.因此,就实现的高效性而言,催化时间保持在7 h左右较好,此时降解率可达58.4%.
4结论

图8 mCu : mTi =30%时对亚甲基 蓝降解率随光照时间变化
采用溶胶-凝胶法制备了CuO/TiO2光催化剂,最佳制备条件为:当mCu:mTi为30%,在500 ℃下煅烧2 h,此条件下制得的CuO/TiO2较之单纯TiO2的催化活性大大提高,在日光灯下光照7 h,亚甲基蓝降解率可达58.4%.XRD表征结果显示,二氧化钛晶相为锐钛矿和金红石混晶结构,在Cu/TiO2中Cu以CuO晶体形式存在.适量的混晶比和CuO晶粒能促进光催化活性的提高.
5展望
复合材料CuO/TiO2光催化剂的催化活性高于单纯TiO2,它的生产应用有可能给社会带来极大的经济效益.目前对二氧化钛光催化剂的理论研究较为成熟,但实际应用较少.如何将理论用于实际,并选择适当的二氧化钛复合材料,以达到较高的光催化活性,仍是一个重要的研究方向.
参考文献:
[1]文鑫,曹萌.TiO2纳米管的制备方法研究[J].科学技术与工程,2009,9(13):3720-3725.
[2]魏绍东.纳米二氧化钛的发展及现状[J].中国涂料,2005,20(2):39-40.
[3]马军委,张海波,董振波,等.纳米二氧化钛制备方法的研究进展[J].无机盐工业,2006,38(10):25-26.
[4]康传红,郭桐,井立强,等.多孔SiO2与TiO2复合纳米材料的制备及光催化性能[J].无机材料学报,2009,24(2):230-232.
[5]赵鹏君,吴荣,侯娟,等.一步水热合成铜纳米颗粒负载二氧化钛复合纳米管及其可见光催化活性[J].化学工业与工程,2012,28 (8):1971-1977.
[6]赵春,钟顺和. Cu/ZnO-TiO2复合半导体光催化材料的制备与表征[J].硅酸盐学报,2004,20(9):1132-1136.
[7]杨华明,史蓉蓉,张科,等.纳米二氧化钛光催化剂改性研究进展[J].化工新型材料,2005,33(6):57-59.
[8]李晨,徐博.溶胶-凝胶法的基本原理发展及应用现状[J].化学工业与工程,2009,26(3): 273-277.
[9]张文彬,谢利群,白元峰.纳米TiO2光催化机理及改性研究进展[J].华工科技,2005,13(6):52-57.
[10]沈毅,张青龙,吴国友,等.纳米二氧化钛光催化材料研究新进展[J].矿业研究与开发,2005,26(4):39-42.
A Study on the Preparation of CuO/TiO2by Sol-gel Method and
Its Photocatalytic Performance
WU Xiao-man, YU Jia-jia
(SchoolofChemistryandChemicalEngineering,XuchangUniversity,Xuchang461000,China)
Abstract:CuO loaded with TiO2was prepared by sol-gel method using tetrabutyl titanate and anhydrous ethanol as reactant. With methylene blue as the model of reactants, the experimental results shows that the Cu/Ti element quality ratio is 30% and calcination temperature is 500 ℃, the photocatalytic activity of Cu/TiO2is best. When irradiation time under fluorescent is 10 h, the degradation rate of methylene blue could reach 58.4%. XRD characterization results show that TiO2displays mixed crystal with anatase and rutile phase, and Cu element exists in the form of CuO crystal in Cu/TiO2.
Key words:sol-gel method; Cu/TiO2; methylene blue; photocatalytic
责任编辑:卫世乾
中图分类号:O643
文献标识码:A
文章编号:1671-9824(2015)02-0087-06
作者简介:武小满(1977—),女,河南焦作人,副教授,博士,研究方向:纳米催化剂的制备和光催化.
收稿日期:2014-06-23
