组蛋白去乙酰化酶1、7在肾癌组织中的表达及临床意义探讨
2015-02-24刘婷婷,左文东,宋立友等
组蛋白去乙酰化酶1、7在肾癌组织中的表达及临床意义探讨
刘婷婷1,左文东2,宋立友3, 晋学飞4
(1.吉林省军队离退休干部疗养中心,吉林 长春130000;2.吉林省前卫医院;
3.吉林省肿瘤医院;4.吉林大学中日联医院)
肾癌是泌尿外科常见的恶性肿瘤之一,又叫肾细胞癌或肾腺癌,是一种起源于肾小管上皮细胞的肾实质性肿瘤。目前,对于肾癌的发病机制,国内外仍无统一意见,但都认同肾癌的发生是多因素共同参与形成的[1]。组蛋白去乙酰化酶(HDAC)是一种蛋白酶,在人体内主要控制染色体的结构修饰和调节并控制基因的表达。在细胞核中,组蛋白的乙酰化和去乙酰化的速率大致相同,处于动态平衡,其速率就是由组蛋白乙酰化转移酶(HAT)和组蛋白去乙酰化酶(HDAC)共同调控的。HDAC-1在细胞周期中,主要起到控制细胞周期和转录因子的分化与增殖;HDAC-7近年来在多种肿瘤中都发现了其有过表达的情况,王君等人认为HDAC-7可以作为诊断肾癌的肿瘤标记物之一,并且可以检测其预后情况[2]。本次研究着重探讨HDAC-1和HDAC-7在肾癌组织中的表达情况及其临床意义,现将研究结果报道如下。
1材料与方法
1.1 一般资料
随机选取2013年1月至7月期间,我院泌尿外科收治的、经术后病理检查确诊为肾癌的患者67例。其中男性44例,女性23例,年龄范围48-72岁,平均年龄(57.3±9.6)岁。透明细胞癌51例,颗粒细胞癌9例,混合细胞癌5例,未分化细胞癌2例。根据临床TNM分期,Ⅰ期12例,Ⅱ期15例,Ⅲ期29例,Ⅳ期11例。根据病理分级标准:Ⅰ级为分化良好,Ⅱ级为中等分化,Ⅲ级为分化不良,其中Ⅰ级24例,Ⅱ级28例,Ⅲ级15例。
1.2 研究方法
术中寻找目标瘤体,沿瘤体边缘选取无坏死的肿瘤组织,取2-4 mm作为病例标本[3],在癌旁取正常组织2-4 mm作为正常标本,用液氮保存,送检。如不能及时送检,将标本保存在-80℃的冰柜内。
标本用10%的甲醛固定,脱水、包埋,做厚度为3 μm的切片3-5张。采用免疫组织化学法(S-P法)对标本切片进行染色,切片脱蜡、水化后,用3%的过氧化氢溶液对过氧化物酶进行阻断,持续15 min。HDAC-1选取鼠抗人HDAC-1单抗,HDAC-7选取兔抗人HDAC-7单抗,阴性对照选用浓度为1%的PBS缓冲液作为一抗,利用苏木精复染后,用DAB试剂盒显色后用显微镜观察标本切片。所有试剂盒均购自上海研晶生物科技有限公司,所有操作均按照相应说明书严格进行操作。
阳性表达判定方法:细胞染色标准:在细胞浆内出现浅黄色、棕黄色或黄褐色颗粒为染色细胞。在400倍光学显微镜下,每张切片随机选取4个视野,每个视野对1000个细胞进行染色计数,观察每个标本的所有切片,计算平均染色细胞数,作为该例标本的染色数量。阴性(-):染色细胞数量<25%;弱阳性(+):染色细胞数量在25%-75%;强阳性(++):染色细胞数量>75%。所有标本标本均由两位病理专家独立审阅并给出结果,当两位专家意见不一致时,请第三位专家独立给予判定。阳性率=(表达阳性标本数+表达强阳性标本数)/该组总标本数×100%。
1.3 统计学方法
采用SPSS 20.0软件对所有实验所得数据进行处理,对计数资料用卡方检验,对计量资料用t检验,组间比较采用秩和检验,取α=0.05作为检验水准。
2结果
2.1 HDAC-1和HDAC-7在肾癌组织和癌旁正常组织中的表达情况
绝大部分肾癌组织中观察到了HDAC-1和HDAC-7的表达情况。HDAC-1染色颗粒主要出现在细胞浆内,HDAC-7染色颗粒主要出现在肾小管上皮细胞细胞核中,还有部分出现在肾小球上皮细胞细胞核中。HDAC-1在肾癌组织中的阳性表达率为80.60%,其中弱阳性21例,强阳性33例,而正常组织中只有7例表达弱阳性,其余均为阴性表达,HDAC-1在肾癌组织中的阳性表达率显著高于正常组织(P<0.05)。HDAC-7在肾癌组织中阳性表达率为61.19%,其中弱阳性29例,强阳性12例,在正常组织中仅有8例表达弱阳性,其余均表达阴性,HDAC-7在肾癌组织中的阳性表达率显著高于正常组织(P<0.05)。
2.2 不同临床分期HDAC-1和HDAC-7的表达情况
13例阴性表达的HDAC-1主要集中在临床分期为Ⅰ期和Ⅱ期的标本中,分别有7例和6例,而Ⅲ期和Ⅳ期标本中HDAC-1全部为阳性表达,随着临床分期的提高,HDAC-1的阳性表达率也随之升高,组间比较具有显著差异(P<0.05)。Ⅰ期和Ⅱ期的标本中,HDAC-7多为阳性表达,在Ⅲ期和Ⅳ期标本中,HDAC-7多为阴性表达,随着临床分期的提升,HDAC-7的阳性表达率也随之下降,组间具有统计学差异(P<0.05),见表1。
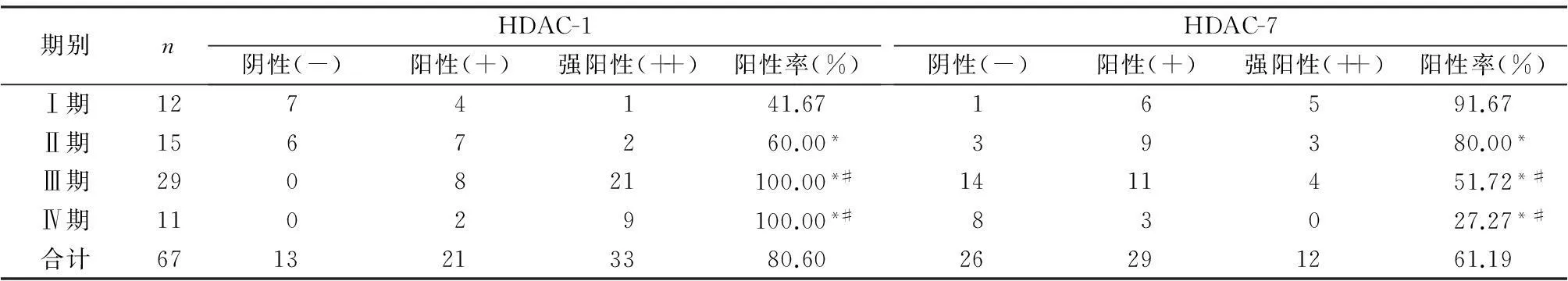
表1 不同临床分期HDAC-1和HDAC-7的表达情况(n)
注:与Ⅰ期比较,*P<0.05;与Ⅱ期比较,#P<0.05
2.3 不同病理分级HDAC-1和HDAC-7的表达情况
病理分级为Ⅰ级的标本中,仅有约1/2的标本HDAC-1表达阳性,而病理分级为Ⅱ级和Ⅲ级的标本中,绝大部分标本HDAC-1呈阳性表达,随着病理分级的提高,HDAC-1的阳性表达率也随之提高,组间具有统计学差异(P<0.05)。病理分级为Ⅰ级的标本中,绝大多数标本HDAC-7呈阳性表达,随着病理分级的提高,HDAC-1的阳性表达率随之降低,组间具有统计学差异(P<0.05),见表2。
注:与Ⅰ级比较,*P<0.05;与Ⅱ级比较,#P<0.05
3讨论
组蛋白去乙酰化酶(HDAC)是一种类蛋白酶,其主要功能是在细胞染色体修饰过程中和基因表达时发挥调节作用,同时对组蛋白的去乙酰化过程起到调控作用,使之与组蛋白的乙酰化速率接近,从而达到一个动态平衡[4,5]。根据与酵母菌的同源性,HDAC可以分为三型,HDAC-1属于Ⅰ型,HDAC-7属于Ⅱ型。近年来,HDAC-1在多种肿瘤中(如结肠癌、乳腺癌、前列腺癌等)被发现有高表达的情况,Yu J等人在研究中发现,HDAC-1有促进肿瘤细胞增殖的能力,并且与肿瘤细胞对周围组织的浸润和向远处转移有密切关系[6]。作为第一个在哺乳类动物细胞中发现的HDAC,HDAC-1被认为具有调节基因转录的动能。魏曙光等人在研究中发现,HDAC-1几乎参与了整个细胞周期,并且,HDAC-1可以通过对线粒体转位的控制,来促进癌基因的活化和表达[7]。而Takashi等人在对肿瘤细胞中HDAC-1进行干涉的实验中发现,缺少HDAC-1的肿瘤细胞,有丝分裂过程会被抑制,取而代之的是Caspase-3的激活,这种改变可以直接导致肿瘤细胞进入凋亡程序,故提出了HDAC-1抑制剂来治疗肿瘤的新观点[8]。HDAC-7在体内的作用是与肌细胞结合因子-2(MEF-2)结合,对MMP-10(基质金属蛋白酶-10)的表达起到抑制作用,MMP-10可以讲解细胞外基质,这种作用在血管内皮细胞尤为明显[9]。HDAC-7通过上述作用将内皮细胞和平滑肌细胞紧密的连接。Glaser在研究中发现,若HDAC-7的表达发生障碍,则内皮细胞和平滑肌细胞之间的粘附作用会大大降低[10]。本次研究着重探讨HDAC-1和HDAC-7在肾癌组织中的表达情况,为肾癌的治疗提供新思路。
从本次研究的结果中可以看出,肾癌组织中HDAC-1和HDAC-7的阳性表达率均显著高于正常组织(P<0.05),正常组织中未发现HDAC-1和HDAC-7有强阳性表达,仅有7例和8例的阳性表达。而在对不同临床分期和病理分级的肿瘤标本的检查中发现,随着临床分级和病理分期的提高,HDAC-1的阳性表达率逐渐升高,而HDAC-7的阳性表达率逐渐下降。可以认为HDAC-1在肿瘤发生发展过程中起到了一定作用,正是由于HDAC-1的高表达,才使得抑癌基因被抑制,而原癌基因被激活,随着肿瘤的生长,HDAC-1的表达越来越强烈,可能是肿瘤产生了某种刺激HDAC-1表达的因子,两者互成因果。本次研究只对HDAC-1的表达做了定性研究,至于其定量检测可不可以作为肾癌诊断和评估预后的标志,还有待进一步研究。本次研究结果还发现,随着临床分期和病理分级的提高,HDAC-7的阳性表达率随之降低。这说明HDAC-7的阳性表达率与肿瘤的自然病程和恶性程度均相关。肿瘤细胞生长十分迅速,而当其向远处发生转移时,需要有血管的支持,而HDAC-7的阳性表达率逐渐降低,可能肿瘤血管向外发生转移时的一种特殊变化,也可以认为有其它的促癌因素抑制了HDAC-7的表达。
综上,HDAC-1和HDAC-7在肾癌组织中的表达阳性率显著高于正常肾组织;临床分期和病理分级越高,HDAC-1表达阳性率越高,HDAC-7表达阳性率越低。HDAC-1和HDAC-7可能是促进肾癌形成的一种因子。
参考文献:
[1]Anja Lachenmayer,Sara Toffanin,Laia Cabellos,et al.Combination therapy for hepatocellular carcinoma:Additive preclinical efficacy of the HDAC inhibitor panobinostat with sorafenib[J].Journal of Hepatology,2012,56(6):1552.
[2]王君.HDAC7在肾癌组织中的表达及其临床意义[D].安徽医科大学,2012.
[3]Kurundkar Deepali,Srivastava Ritesh K,Chaudhary Sandeep C,et al.Vorinostat,an HDAC inhibitor attenuates epidermoid squamous cell carcinoma growth by dampening mTOR signaling pathway in a human xenograft murine model.[J].Toxicology and Applied Pharmacology,2012,266(2):1025.
[4]王勇.组蛋白乙酰基转移酶MYST1与肾细胞癌关系的研究[D].吉林大学,2013.
[5]A.Iglesias-Linares,R.M.Yaez-Vico,M.A.González-Moles.Potential role of HDAC inhibitors in cancer therapy:Insights into oral squamous cell carcinoma[J].Oral Oncology,2010,46(5):2469.
[6]Yu J,Mi J,Wang Y,et al.Regulation of radiosensitivity by HDAC inhibitor trichostatin A in the human cervical carcinoma cell line Hela.[J].European Journal of Gynecological Oncology,2012,33(3):36.
[7]魏曙光,窦中岭,孙国贤,等.Caveolin-1和HDAC1蛋白在肾细胞癌中的表达及意义[J].现代泌尿生殖肿瘤杂志,2013,01:32.
[8]Takashi Yoshioka,Shingo Yogosawa,Takeshi Yamada,et al.Combination of a novel HDAC inhibitor OBP-801/YM753 and a PI3K inhibitor LY294002 synergistically induces apoptosis in human endometrial carcinoma cells due to increase of Bim with accumulation of ROS[J].Gynecologic Oncology,2013,13:468.
[9]马永良.DNMT1和HDAC1在肾透明细胞癌中的表达及其相关性研究[D].河北医科大学,2012.
[10]Glaser Keith B,Staver Michael J,Waring Jeffrey F,et al.Gene expression profiling of multiple histone deacetylase (HDAC) inhibitors:defining a common gene set produced by HDAC inhibition in T24 and MDA carcinoma cell lines[J].Molecular Cancer Therapeutics,2003,2(2):164.
收稿日期:(2013-12-14)
文章编号:1007-4287(2015)01-0115-03
