miRNA-10a表达与炎症性肠病患者炎性反应的关系及诊断意义研究
2015-02-24王丽强,林思彤,邵琦等
miRNA-10a表达与炎症性肠病患者炎性反应的关系及诊断意义研究
王丽强1,林思彤2,邵琦3,玄延花4*
(1.延边大学病理与病理生理学2012级研究生,吉林 延吉133000;2.吉林大学中日联谊医院 内分泌科,吉林 长春130033;
3.浙江省宁波市中医院 超声科,浙江 宁波315000;4.延边大学 病理与病理生理学教研室,吉林 延吉133000)
炎症性肠病(inflammatory bowel disease)包括溃疡性结肠炎和克罗恩病,是一组肠道慢性非特异性炎性反应性疾病,发病原因不明,可能是易感人群在肠黏膜环境改变、屏障缺陷及持续感染等多种因素作用下导致的异常肠道免疫反应[1]。miRNA是一类长约20-25个核苷酸、具有调控功能的内源性非编码RNA,有研究指出[2],自身免疫性疾病中均发现miRNA出现异常表达。动物实验显示[3],肠炎小鼠肠上皮细胞中出现miRNA-10a异常表达,且对IL-12/23的表达进行靶向抑制。目前,关于miRNA-10a在炎症性肠病发病过程中的作用研究较少,本研究对miRNA-10a表达与炎症性肠病患者炎性反应的关系进行分析,探讨其在炎症性肠病患者发病及临床诊断中的意义。
1资料与方法
1.1一般资料收集2012年3月至2013年4月在我院消化内科行结肠镜检查的活动性炎症性肠病患者40例,所有患者均符合2007年中华医学会消化病学分会炎症性肠病协作组诊断共识[4],其中,溃疡性结肠炎18例,男性12例,女性6例,平均年龄38.7±9.2岁;克罗恩病22例,男性12例,女性10例,平均年龄34.1±7.6岁。选取同期行结肠镜检无异常的健康者15例,其中,男性9例,女性6例,平均年龄41.6±9.4岁。排除检查前1个月使用过免疫抑制剂及生物制剂、糖皮质激素、过水杨酸制剂者,合并有其他自身免疫性疾病者、感染性疾病者,以及患有肿瘤者。本研究通过医院伦理委员会批准,所有患者均进行知情同意。
1.2 方法
1.2.1标本收集 对所有行结肠镜检患者和健康者采集结肠粘膜标本,抽取5 ml静脉血,离心后取血清备检,同时,收集外周血单个核细胞标本。
1.2.2主要试剂和引物miRcute miRNA提取分离试剂盒,cDNA第1链合成试剂盒及荧光定量检测试剂盒、miRNA-10a和内对照引物均购自北京天根生化科技,Perfect Real time染料法实时荧光定量试剂盒和反转录试剂盒均购自美国Invitrogen 公司;人淋巴细胞分离液购自加拿大Cedarlane公司,根据GenBank确定IL-12/IL-23 p40引物序列,并由北京奥科鼎盛生物科技公司合成,上游:3’-GTCTCGGATTCTGGAGTGACGA-5’,下游:3’-ATTTCCTGGTCTTTCTTGGGTT-5’,扩增长度179 bp。
1.2.3荧光定量PCR将肠黏膜内镜标本放置在液氮研钵中进行充分研磨用于提取RNA,血清和外周血单个核细胞具体提取RNA步骤参照试剂盒说明书进行,并对提取的纯度、浓度和完整性进行检测。(1)miRNA-10a含量的测定:将肠黏膜标本、血清和外周血单个核细胞提取的RNA进行反转录,miRNA反转录过程遵照cDNA第1链合成试剂盒操作步骤进行,由两步完成,37℃进行60 min,荧光定量过程参照荧光定量检测试剂盒说明进行,将cDNA 1 μl置于10 μl反应体系中进行扩增反应,94℃进行2 min,94℃进行20 s,60℃进行34 s,共进行循环42次。(2)IL-12/IL-23 p40的测定:将肠黏膜标本提取的RNA一部分用于miRNA-10a含量测定外,另一部分用于IL-12/IL-23 p40表达的测定,mRNA反转录过程按照反转录试剂盒说明进行,37℃进行15 min,85℃进行5 s,荧光定量过程参照荧光定量检测试剂盒说明进行,将cDNA 2 μl置于20 μl反应体系中进行扩增反应,95℃进行30 s,95℃进行5 s,60℃进行30 s,共进行循环40次,利用2-△△Ct法进行相关数据处理,具体操作参照文献[5]。
1.3 统计学处理
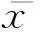
2结果
2.1 不同组患者结肠黏膜、血清和外周血单个核细胞中miRNA-10a表达情况
三组患者结肠黏膜、血清和外周血单个核细胞中miRNA-10a表达均不相同,差异具有统计学意义(P<0.05),溃疡性结肠炎组和克罗恩病组患者不同组织中miRNA-10a相对表达量均低于对照组,差异均具有统计学意义(P<0.05),而溃疡性结肠炎组和克罗恩病组患者之间差异均无统计学意义(P>0.05),详见表1。
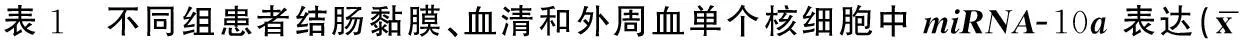
±s)
注:与对照组相比,#P<0.05
2.2 不同组患者结肠黏膜中IL-12/IL-23 p40表达情况
不同组患者结肠黏膜中IL-12/IL-23 p40表达差异具有统计学意义(P<0.05),溃疡性结肠炎组和克罗恩病组患者结肠黏膜中相对表达量均高于对照组,差异具有统计学意义(P<0.05),溃疡性结肠炎组和克罗恩病组患者之间差异无统计学意义(P>0.05),详见表2。
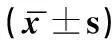
表2 不同组患者结肠黏膜中IL-12/IL-23 p40表达
注:与对照组相比,#P<0.05
2.3 结肠黏膜中miRNA-10a和IL-12/IL-23 p40表达相关性分析
结肠黏膜中miRNA-10a和IL-12/IL-23 p40表达呈负相关(r=-0.963,P<0.001)。
3讨论
炎症性肠病是一种病因复杂的肠道炎性疾病,发病机制尚不十分清楚,一般认为是易感基因、环境因素及免疫异常相互作用的结果,这种相互作用可以通过基因的异常表达来进行反应,一般认为miRNA可以调控部分基因的表达,越来越多的疾病发病机制研究将miRNA对蛋白表达的调控作用作为研究突破口[6],已有研究将miRNA作为炎症性肠病患者活动指标进行探讨,对患者肠黏膜中miRNA表达情况进行分析,探讨在炎症性肠病发病中的作用。
本研究利用荧光定量PCR技术对炎症性肠病患者miRNA-10a在肠黏膜、血清和外周血单个核细胞中表达情况,本研究显示,miRNA-10a在三种组织中表达均不相同(P<0.05),溃疡性结肠炎组和克罗恩病组患者不同组织中miRNA-10a相对表达量均低于对照组(P<0.05),说明在不同组织中miRNA-10a表达不同,患者不同组织中miRNA-10a表达均低于正常人,而不同炎症疾病类型对miRNA-10a表达没有影响,同时,炎症性肠病患者外周血单核细胞中也出现了miRNA-10a表达降低,提示炎症性肠病患者全身免疫系统可能出现了miRNA-10a表达缺失,在一定程度上加重并放大了异常炎性反应调节,从而加剧了患者疾病进展[7]。IL-12/IL-23 p40是miRNA-10a的靶基因,对于固有免疫和获得性免疫具有重要的调控作用,与炎症性肠病发病密切,可对患者淋巴细胞进行诱导产生大量的炎性介质,从而参与患者肠黏膜的炎症损伤过程[8],本研究显示,不同组患者结肠黏膜中IL-12/IL-23 p40表达差异具有统计学意义(P<0.05),溃疡性结肠炎组和克罗恩病组患者结肠黏膜中相对表达量均高于对照组(P<0.05),结肠黏膜中miRNA-10a和IL-12/IL-23 p40表达呈负相关(r=-0.963,P<0.001),进一步说明IL-12/IL-23 p40表达与miRNA-10a密切相关,炎症性肠病患者miRNA-10a表达下调而导致IL-12/IL-23 p40表达上调,进一步使IL-12、IL-23、p70和NOD2等效应因子大量表达,强化了细胞免疫应答,从而加剧了患者肠黏膜炎性反应损伤[9]。
综上所述,炎症性肠病患者结肠粘膜、血清和外周血单个核细胞中miRNA-10a均出现了表达下降,而患者结肠黏膜中IL-12/IL-23 p40出现表达升高,且不受炎症性肠病种类影响,miRNA-10a与IL-12/IL-23 p40表达呈负相关,miRNA-10a表达下调与炎症性肠病疾病过程紧密相关, miRNA-10a可能是炎症性肠病治疗新靶点,对患者补充miRNA-10a可能对控制病情进展起到积极作用。
参考文献:
[1]Becker F,Yi P,Al-Kofahi M,et al.Lymphatic dysregulation in intestinal inflammation:new insights into inflammatory bowel disease pathomechanisms[J].Lymphology,2014,47(1):3-27.
[2]Yang Y,Zhang K,Zhou R.Meta-analysis of pre-miRNA polymorphisms association with susceptibility to autoimmune diseases[J].Immunol Invest,2014,43(1):13.
[3]Xue X,Feng T,Yao S,et al.Microbiota downregulates dendritic cell expression of miR-10a,which targets IL-12/IL-23p40[J].J Immunol,2011,187(11):5879.
[4]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见[J].现代消化及介入诊疗,2008,13(2):139.
[5]Bustin SA,Benes V,Garson JA,et al.The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J].Clin Chem,2009,55(4):611.
[6]De Iudicibus S,Lucafò M,Martelossi S,et al.MicroRNAs as tools to predict glucocorticoid response in inflammatory bowel diseases[J].World J Gastroenterol,2013,19(44):7947.
[7]Hussein K,Dralle W,Theophile K,et al.Megakaryocytic expression of miRNA 10a,17-5p,20a and 126 in Philadelphia chromosome-negative myeloproliferative neoplasm[J].Ann Hematol,2009,88(4):325.
[8]Niederreiter L,Adolph TE,Kaser A.Anti-IL-12/23 in Crohn's disease:bench and bedside[J].Curr Drug Targets,2013,14(12):1379.
[9]Guan Q,Ma Y,Hillman CL,et al.Development of recombinant vaccines against IL-12/IL-23 p40 and in vivo evaluation of their effects in the downregulation of intestinal inflammation in murine colitis[J].Vaccine,2009,27(50):7096.
收稿日期:(2013-12-21)
文章编号:1007-4287(2015)01-0064-03
通讯作者*
