槲皮素对人肝癌SMMC-7721细胞生长抑制及诱导凋亡作用
2015-02-24史桂兰,黄琳,卿海燕等
槲皮素对人肝癌SMMC-7721细胞生长抑制及诱导凋亡作用
史桂兰,黄琳,卿海燕,陈琦
(解放军208医院 肿瘤科, 吉林 长春130062)
肝癌是消化系统常见的恶性肿瘤之一,多数肝癌发现时已为晚期,进展快,预后差[1],从天然植物中寻找高效低毒的抗肝癌药物的一直是研究热点[2]。槲皮素(1,3,4,5,7-五羟基黄酮,Quercetin)是存在于多种植物的果实和花中的天然黄酮类物质,槲皮素具有抗炎、抗过敏、抗氧化、抗病毒、调节免疫、降血脂、抗氧化,抗癌等多种生物学活性,研究表明槲皮素体外可以抑制结肠癌、胃癌、卵巢癌、乳腺癌等多种肿瘤细胞的增殖,并诱导肿瘤细胞凋亡[3-8]。本研究体外观察槲皮素对人肝癌SMMC-7721细胞的增殖抑制和诱导凋亡作用,为其进一步应用于临床治疗肝癌提供理论依据。
1料和方法
1.1 细胞培养
人肝癌SMMC-7721细胞由吉林大学基础医学院病理教研室馈赠,10%胎牛血清(Fetal bovine serum,FBS)高糖DMEM 培养基培养,添加青霉素(100 U/ml)和链霉素(100 μg/ml),于37 ℃,5% CO2培养箱中培养。
1.2 药品和试剂
高糖DMEM培养基(美国Sigma公司),胎牛血清(杭州四季清公司), 3-(4,5-二甲基噻唑-2).2,5.二苯基四氮唑溴盐(MTT,美国Sigma公司),Giemsa染色试剂盒购自北京鼎国生物技术公司,吖啶橙(AO)染色试剂盒购自南京凯基生物公司,AnnexinV-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物公司。槲皮素购自美国Sigma公司,用前溶于二甲基亚砜(DMSO) 配制成1 mol/L溶液,加药前用含10% DMSO 的双蒸灭菌水配制成所需的实验浓度。
1.3 MTT法检测槲皮素对肝癌SMMC-7721细胞生长的影响
参考文献96孔板每孔接种SMMC-7721细胞1×104个,[9]MTT法测定100、80、40、20、10、0 μmol/L槲皮素作用24、 48和72 h对人肝癌SMMC-7721细胞的生长抑制作用,并计算IC50值。
1.4 Giemsa染色观察细胞形态
预先放置无菌盖玻片的6孔板每孔接种5×105个SMMC-7721细胞,培养过夜加入槲皮素,48 h后取出盖玻片,用磷酸盐缓冲液(PBS)冲洗两遍,4%对聚甲醛固定,按照说明书的方法染色,水洗,干燥,镜检。
1.5 AO染色检测细胞凋亡
收集槲皮素作用48 h的SMMC-7721细胞,调整细胞浓度为1×107/ml,移液器吸取95 μl细胞悬液于5 ml离心管内,加入5 μl AO储存液混匀,AO终浓度为0.1 mg/ml,吸取10 μl 细胞悬液滴于显微载玻片上,盖玻片封片,避免封入气泡,荧光显微镜下观察细胞形态,摄片。
1.6 AnnexinV-FITC/PI双染流式细胞仪检测细胞凋亡
参照文献[10]方法,严格按照说明书操作,采用流式细胞仪测定槲皮素作用48 h的SMMC-7721细胞的凋亡率。
1.7 统计学分析
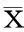
2结果
2.1 槲皮素对肝癌SMMC-7721细胞生长的抑制作用
对照组SMMC-7721细胞生长活跃,SMMC-7721细胞在 10,20,40,60,80,100 μmol/L檞皮素作用24、48和72 h后,生长均不同程度减慢,抑制率逐渐升高,并呈明显的浓度和时间依赖性(表1),槲皮素作用SMMC-7721细胞48 h的IC50为48.8 μmol/L。
2.2 肝癌SMMC-7721细胞的形态改变
对照组细胞形态规则,大小较一致,贴壁生长;槲皮素IC50组部分SMMC-7721细胞脱落悬浮于培养液中,贴壁细胞密度低,形态不规则,收缩变圆。
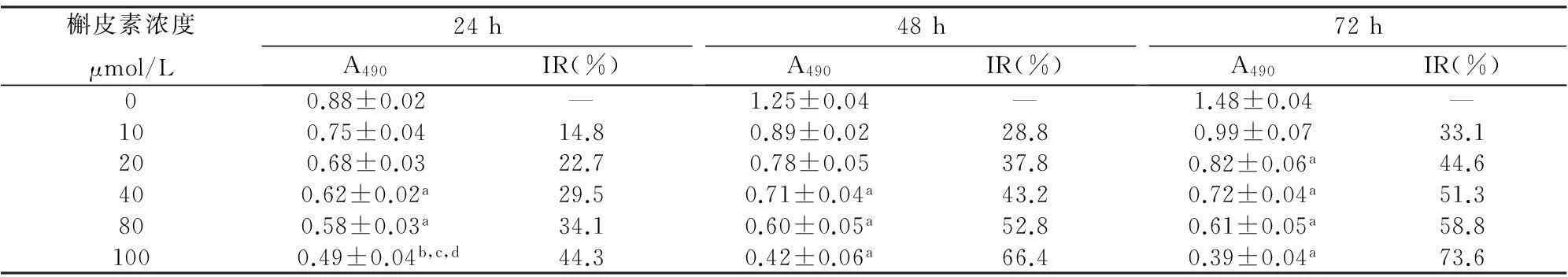
表1 槲皮素对人SMMC-7721细胞生长抑制作用
注:与同时间0 μmol/L组比较,a:P<0.05,b:P<0.01;c:24 h与72 h组间比较,P<0.05,d:24 h与48 h组间比较,P<0.05.
Giemsa染色可见对照组细胞完整,核仁明显,可见多核细胞;槲皮素IC50组细胞皱缩,细胞核固缩或核碎裂为数个小颗粒,表现为典型的凋亡细胞的形态学改变,见图1。
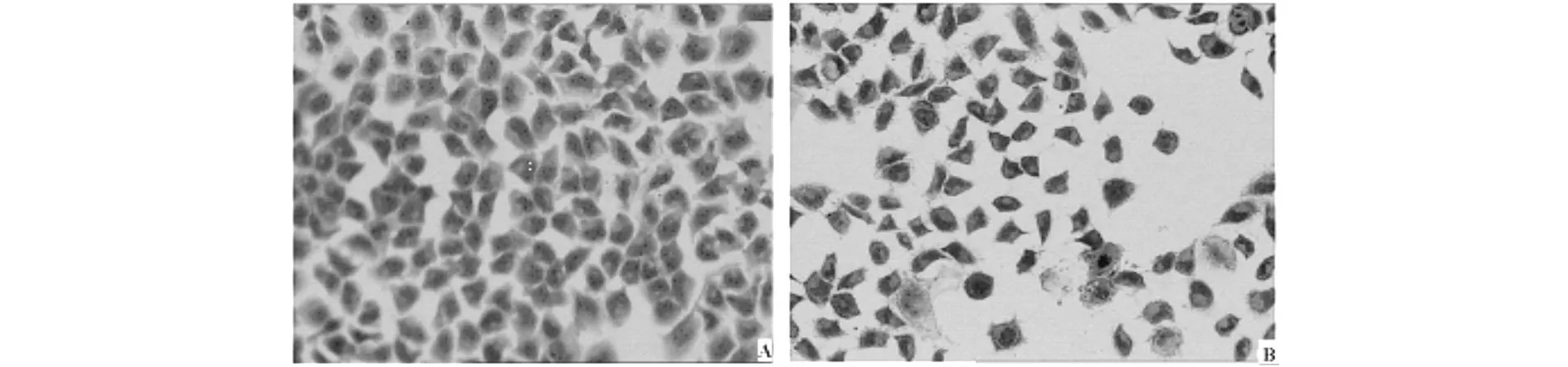
图1 48.8 μmol/L槲皮素作用48 h SMMC-7721细胞的Giemsa染色结果 (×200)
AO染色镜下观察,对照组SMMC-7721细胞表面为正常细胞的染色特征,细胞核呈均染绿色荧光;槲皮素IC50组部分细胞出现胞质浓缩,体积缩小,核固缩,表现为新月状、念珠状,见图2。
图2 48.8 μmol/L槲皮素作用48 h SMMC-7721细胞的AO染色结果 (×200)
2.3 槲皮素诱导SMMC-7721细胞凋亡
各组SMMC-7721细胞经Annexin V-FITC/PI双染流式细胞仪检测结果表明,槲皮素IC50组早期凋亡率为(49.8± 5.8)%,与阴性对照组(0.9±0.1)%比较差异有统计学意义(P<0.05);晚期凋亡率为(14.3±1.8)% ,与阴性对照组(1.2±0.6)%比较差异有统计学意义(P<0.05)。研究结果表明槲皮素体外可诱导SMMC-7721细胞凋亡,见图3。
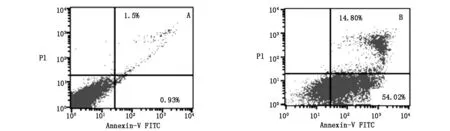
图3 48.8 μmol/L槲皮素作用48 h SMMC-7721细胞凋亡检测结果
3讨论
大量研究表明,肿瘤的发生发展与细胞凋亡有关[11],目前临床应用的多种化疗药物主要是通过诱导其凋亡而发挥作用的,从天然植物中寻找高效低毒的抗肿瘤药物是当前的研究热点之一。本研究首先采用MTT 法检测了槲皮素对肝癌SMMC-7721细胞的增殖抑制作用,结果发现槲皮素体外明显抑制肝癌SMMC-7721细胞的生长,槲皮素对其增殖抑制作用随作用时间的延长和浓度的增加而增强,具有明显时间和剂量。
细胞凋亡是细胞的一种死亡方式,细胞凋亡与肿瘤的发生、发展密切相关[12,13],通过诱导肿瘤细胞凋亡治疗癌症具有重要意义,许多抗癌药物通过诱导肿瘤细胞凋亡发挥抗癌作用[14]。槲皮素体外是否诱导对人肝癌SMMC-7721细胞凋亡?本研究采用Giemsa染色、AO 荧光染色和流式细胞术Annexin-V 和PI 双标染色,多种技术检测肝癌SMM-7721 细胞凋亡情况。
凋亡细胞具有典型的形态学特征,这些特征可以作为鉴定细胞是否凋亡的标准。凋亡细胞的典型形态特征为:细胞皱缩变圆、体积变小、胞质浓缩,染色质浓缩,核碎裂,形成凋亡小体等[15]。本研究发现槲皮素作用SMMC-7721细胞48 h后,胞膜皱缩、收缩变圆,Giemsa染色可见细胞核固缩,甚或核碎裂为数个小颗粒,表现为凋亡的形态学特征。AO荧光染色结果同Giemsa 染色结果一致,对照组细胞核为均匀绿色荧光,槲皮素组细胞出现胞质浓缩,荧光增强,表现为致密浓缩的绿色荧光,细胞核固缩,呈新月状或念珠状,研究结果从形态学上初步证实了槲皮素可诱导SMMC-7721 细胞凋亡。
同时本研究采用Annexin V-FITC/PI 双荧光染色流式细胞仪定量检测凋亡率,结果显示,随着槲皮素浓度的增加,SMMC-7721细胞早期和晚期凋亡率与对照组比较差异有统计学意义,表明槲皮素可能通过诱导SMMC-7721细胞凋亡抑制其生长。另外晚期凋亡率增加表明坏死也可能参槲皮素对SMMC-7721细胞生长的抑制作用,其具体机制还有待于进一步深入研究。
综上所述,本研究观察了槲皮素体外对人肝癌细胞SMMC-7721的增殖抑制作用,并从形态学方面观察到槲皮素可以诱导肝癌SMMC-7721出现典型的凋亡特征,流式细胞仪定量检测凋亡率结果与形态学观察结果一致,确证槲皮素对肝癌SMM-7721细胞的增殖抑制作用是通过诱导其凋亡实现的。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55:74.
[2]Asia-Pacific Working Party on Prevention of Hepatocellular Carcinoma.Prevention of hepatocellular carcinoma in the Asia-Pacific region:consensus statements[J].J Gastroenterol Hepatol,2010,25:657.
[3]Cnox EJ,Bae SC,Yu R,et al.Dietary vitamin E and quercetin modulate inflammatory responses of collagen-induced arthritis in mice[J].J Med Food,2009,12(4):770.
[4]Cook NC,Samman S.Flavonoids-hemistry,metabolism,cardioprotective effects,and dietary sources[J].Nutr Biochem,2005,7(3):66.
[5]Woo K,Myung H,Eul S,et al.Quercetin decreases the expression of ErbB2 and ErbB3 proteins in HT-29 human colon cancer cells[J].J Nutr Biochem,2005,16(6) :155.
[6]Yang J,Wang L,Chen Z,et al.Antioxidant intervention of smoking-induced lung tumor in mice by vitamin E and quercetin[J].Bio Med Central Cancer,2008,8(4):383.
[7]Chen J,Kim J,Park JK,et al.The antioxidant,rather than prooxidant,activities of queretin on normal cells:quercetin protects mouse thmocytes from glucose oxidase-mediated apoptosis[J].Exp Cell Res,2003,291(10):386.
[8]叶丽红,赵冬耕,俞晶华,等.抗癌扶正方对HAC移植性肝癌的抑制作用及形态影响[J].中医药信息,2010,27(1):52.
[9]黄河宁,李安章,翁露娜,等.茶多酚锰合成、表征及络合和诱导肿瘤细胞凋亡的研究[J].高等学校化学学报,2007,28(6):1072.
[10]Tang XD,Zhou KY,Hou G,et al.Mitochondrial mechanism of apoptosis induced by resveratrol in nasoparyngeal carcinoma cells CNE-2Z[J].Chin J Pharmacol Toxicol,2004,18:171.
[11]Zwick E,Bange J,ULLrich A,et al.Receptor tyrosine kinase as targets for anticancerdrugs[J].Trends Mol Med,2002,8(1):17.
[12]Mrozek A,Petrowsky H,Sturm I,el a1.Conbined p53/Bax mutation results in extremely poor prognosis in gastric carcinoma with low microsatellite instability[J].Cell Death Differ,2003,10(4):461.
[13]金伟,马力.染料木黄酮对顺铂诱导肝癌SMMC-7721细胞凋亡的增敏作用[J].第四军医大学学报,2005,26(8):761.
[14]Abrahamsen J F,Bakken AM,Bruserud O,et al Flow cytometri measurement of apoptosis and necrosis in cryopreserved PBPC concentrates from patientswith malignant diseases[J].Bone Marrow Transplant,2002,29(2):165.
[15]刘伍梅,汪铭书,程安春.细胞凋亡检测技术的研究进展[J].中国兽医科技,2004,34(11):45.
收稿日期:(2014-01-22)
文章编号:1007-4287(2015)01-0017-03
