4种脂肪酶检测系统的性能评价
2015-02-24安崇文李海霞
安崇文,李海霞
(北京大学第一医院 检验科,北京100034)
4种脂肪酶检测系统的性能评价
安崇文,李海霞*
(北京大学第一医院 检验科,北京100034)
(ChinJLabDiagn,2015,19:0001)
近年来,国外研究资料表明在急性胰腺炎(Acute Pancreatitis,AP)的诊断上血脂肪酶(Lipase,LPS)是一个比血淀粉酶(Amylase,AMY)更为敏感和特异的指标[1-3]。美国胃肠病学会在对AP诊断的实践指南规定中,已将血LPS列入其中,并指出血LPS浓度应超过正常参考上限3倍[4]。然而目前我国尚未将血LPS纳入AP的诊断标准中[5],但国内早已有大量文献报道[6,7],血LPS在诊断AP上敏感性为90%,特异性为93%,ROC曲线下面积(AUC)为0.956,均优于AMY。随着对LPS临床应用的广泛普及,已有越来越多的试剂厂家研发出LPS检测试剂,国内市场销售的LPS试剂盒众多,产品质量是否符合实验室要求有待验证,为此本研究选取了目前我国临床实验室在全自动生化仪上测定LPS的4种酶比色法检测系统进行评价,证实其是否能满足预期实验室需求。
1材料与方法
1.1 仪器试剂与样本准备
1.1.1检测系统4种检测系统分别用A、B、C、D表示,均为非配套系统,应用日立HITACHI 7600-110全自动生化分析仪,检测系统试剂、校准液如表1。

表1 检测系统来源详情
1.1.2比对标本选取2013年3月12日至16日期间北京大学第一医院住院患者样本40份,其LPS浓度覆盖整个可报告范围,应无黄疸、溶血、乳糜等干扰物。
1.1.3辅助试剂生理盐水(0.9%氯化钠注射液,批号1107014W)购自北京双鹤药业公司;血红蛋白(Hemoglobin,Hb)干扰物(批号:TR064)、胆红素(Bilirubin,Bil)干扰物(批号:AM552)、三酰甘油(Triglyceride,TG)干扰物批号:DJ604)由日立和光纯药工业株式会社提供。
1.2评价方法参考美国临床实验室标准化组织(Clinical and Laboratory Standards Institude,CLSI)评价方案对试剂的性能进行评价。
1.2.1精密度评估即不精密度实验,参考EP5-A2文件[8],选取低、高LPS浓度的混合血浆两份(约25 U/L、240 U/L),无黄疸、溶血、乳糜等干扰物,-20℃冰箱冻存。每天测定2批,2批间隔>2 h,每批重复测定2次,连续测定20 d,计算批内、批间变异系数(coefficient of variation,CV)及95%可信区间。
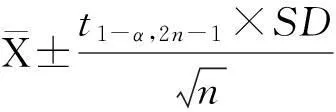
1.2.3回收试验选择LPS低值血浆1份(约27U/L),D、A、C系统的校准液(35U/L、77.1U/L、102U/L)各1份,将其制备成基础样本、低回收样本、中回收样本、高回收样本;同时测定3次,取均值,计算低、中、高样本的回收率,以回收率(100±10)%为评判标准。
参考文献1.2.4抗干扰性评估[12-14]和EP7-A2文件[15]提供的方案并进行部分调整后,收集低、高LPS浓度混合血浆两份,应无黄疸、溶血、乳糜等干扰物;加入干扰物质的最高浓度参考临床病理样本可能出现的最高含量以及试剂说明书的说明,分别在上述血浆中加入Hb、Bil、TG干扰物,配制成Hb终浓度为5、10、15 g/L,Bil终浓度为300、400、500、600 μmol/L,TG终浓度为8、10、15、20 mmol/L的样本,对照样本加入等体积生理盐水,同时测定2次,取均值,以偏倚<±10%做为可接受标准。
1.2.5分析测量范围(AMR)评估即线性实验,参考EP6-A文件[16],选取浓度为0U/L的校准液做为低值样本,选取高LPS血浆做为高浓度样本,将L和H样本按:8L,7L+1H,6L+2H,5L+3H,4L+4H,3L+5H,2L+6H,1L+7H,8H进行一系列稀释混匀后测定,应用空白样本隔开待测样本,以防携带污染,测定4次,求其均值,对数据进行多项式回归统计分析,判断非线性系数b2和b3与0比较差异是否具有统计学意义。若b2和b3或b2和b3无统计学意义,则认为存在线性关系,此范围即为AMR。
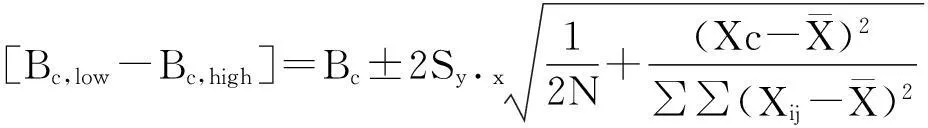
1.2.7统计学分析采用MicrosoftExcel2003,SPSS13.0软件,Medcalc11.6.1软件。回归分析采用Passing-Bablok回归,回归线性检测采用Cusum方法,P<0.05表示差异具有统计学意义;相关分析采用Pearson相关,P<0.05表示差异具有统计学意义;偏差分析应用Bland-Altman差异分析法。
2结果
2.1 精密度评估
表2显示4种LPS检测系统的批内、批间变异,基于生物学变异设定的总允许误差(TEa:<37.88%)[18-20],批内CV均≤TEa的1/4(9.47%),批间CV均≤TEa的1/3(12.63%)。
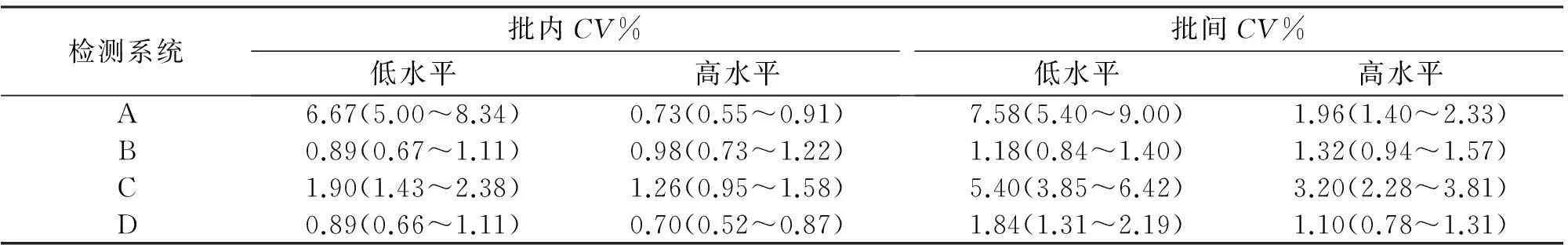
表2 4种系统的批内、批间精密度
注:括号内的数字表示95%可信区间
2.2 正确度评估
表3显示4种系统测定美国CAP室间质评物的结果,基于生物学变异设定的总允许误差(TEa:<37.88%)、允许偏倚(<11.31%)[18-20],仅A、C系统较为理想,其95%验证区间包含了指定均值(CAP Roche Hitachi system mean),且符合生物学变异设定的总允许误差和允许偏倚,此实验数据可证实其真实度。
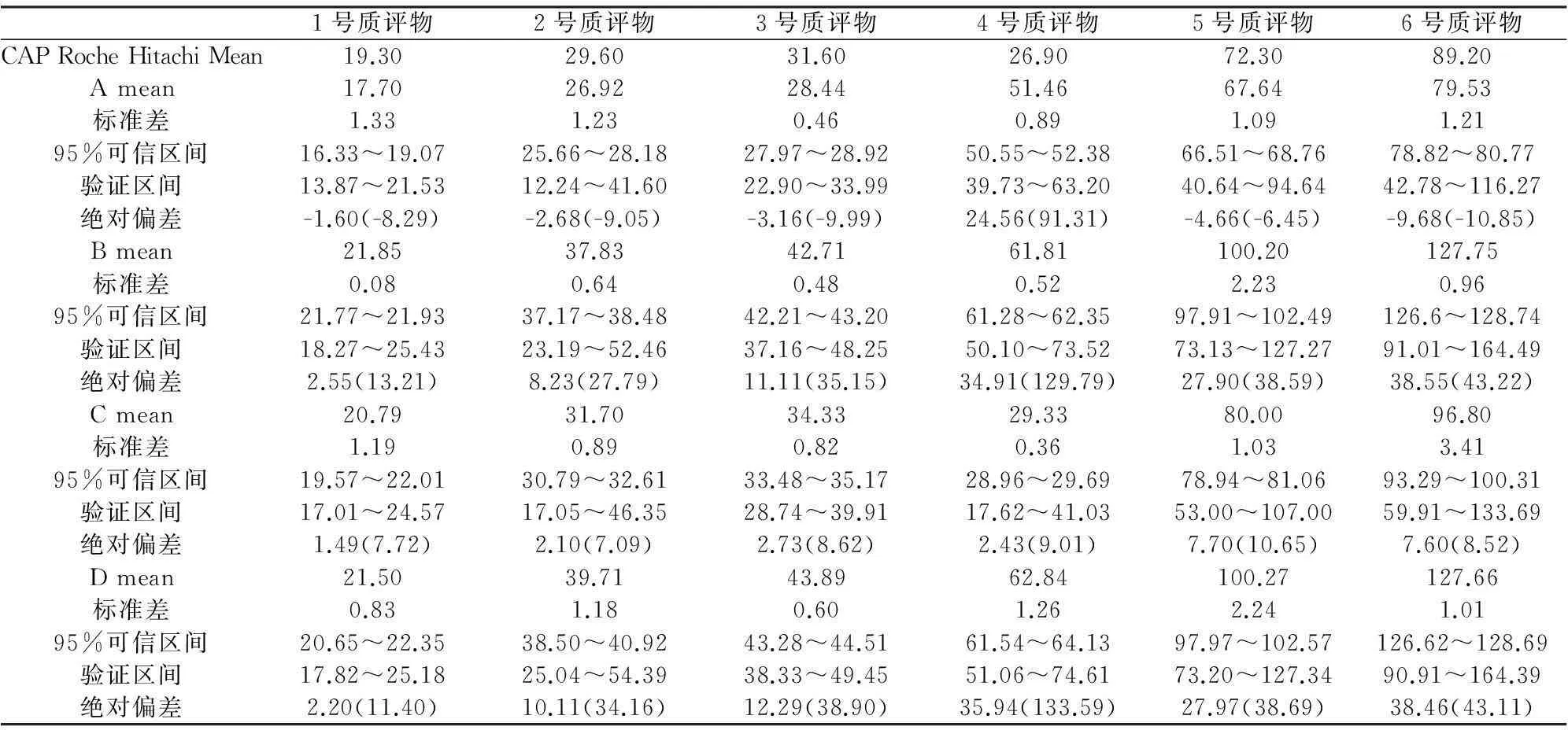
表3 4种系统测定CAP室间质评物结果(U/L)
注:括号内的数字表示相对偏差(%)
2.3 回收试验结果
表4显示4种系统的回收率结果,除B系统高回收标本,其它均未超出(100±10)%。
2.4 抗干扰性评估
图1显示Hb≥5 g/L时,对B、C系统低水平有超出10%的正干扰,在15 g/L时,对D系统低水平有超出10%的正干扰;Bil≤600 μmol/L时对4种系统均无明显干扰现象;TG≥8 mmol/L时,对A、C系统均有超出10%的负干扰。
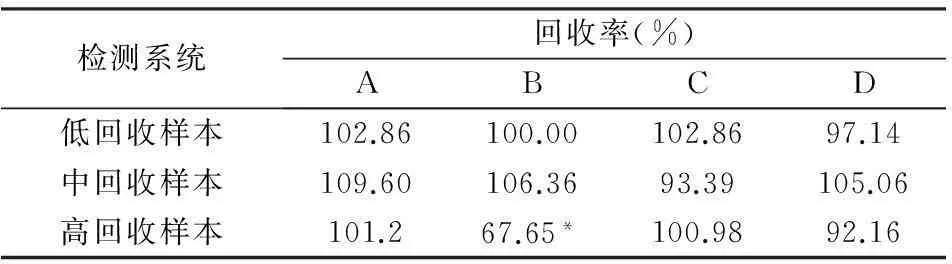
表4 4种系统回收率的结果
注:右上带*数据为超出(100±10)%
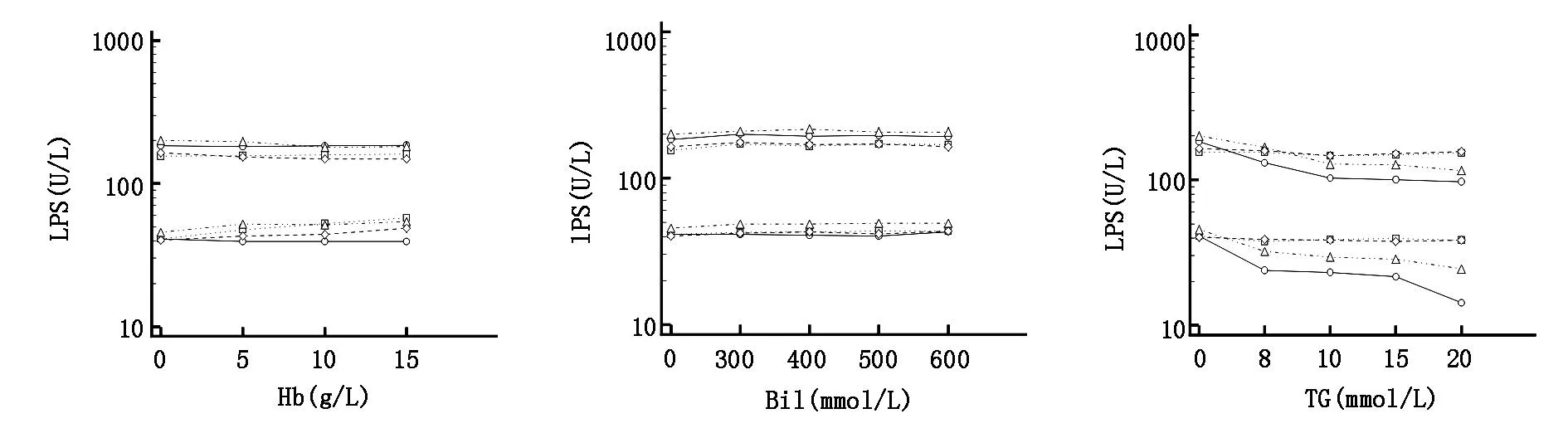
注:○代表A系统,□代表B系统,△代表C系统,◇代表D系统
2.5 AMR验证
对数据进行二元一次、二元二次和二元三次多项式回归分析,A系统的多项式回归方程分别为YA=-68.333+68.786X、YA=-71.250+70.973X-0.312X2(P=0.604)、YA=-56.667+52.628X+5.764X2-0.579X3(PX2=0.203、PX3=0.186);B系统的多项式回归方程分别为YB=-61.667+62.4X、YB=-68.690+66.231X-0.383X2(P=0.099)、YB=-57.802+55.804X+2.092X2-0.165X3(PX2=0.096、PX3=0.058);C系统的多项式回归方程分别为YC=-63.056+67.567X、YC=-79.881+76.744X-0.918X2(P=0.061)、YC=-57.603+55.411X+4.145X2-0.338X3(PX2=0.099、PX3=0.055);D系统的多项式回归方程分别为YD=-63.286+63.5X、YD=-64.714+64.452X-0.119X2(P=0.606)、YD=-58.714+57.619X+1.881X2-0.167X3(PX2=0.284、PX3=0.257);对非线性系数b2和b3进行t检验,概率P均 >0.05,b2和b3与0比较差异无统计学意义,4种系统的最佳拟合方程为二元一次多项式(图2),则认为4种系统存在线性关系,评价的浓度分别为0.5~341、0~494、0~529、0~379 μmol/L。
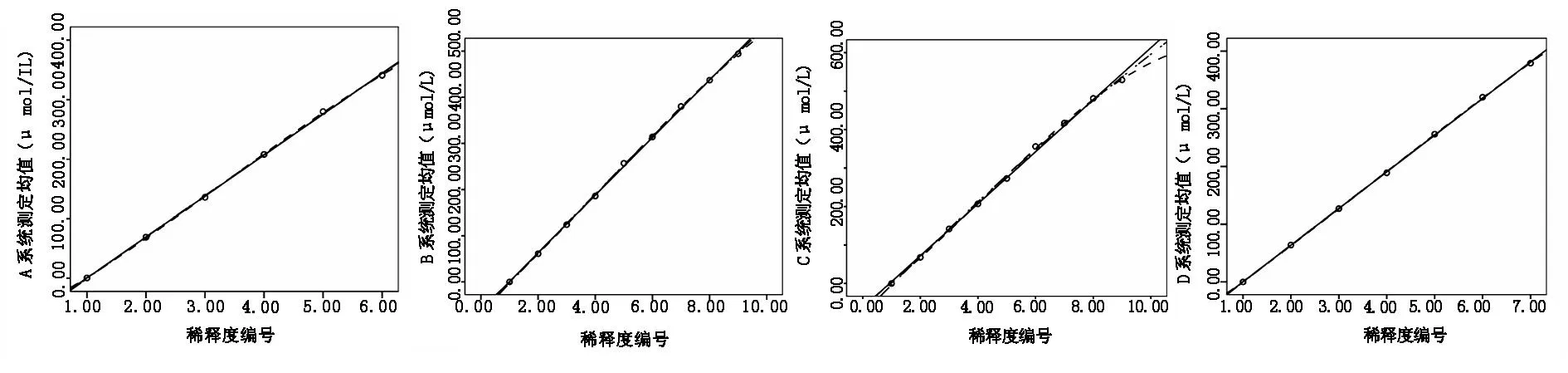
注:○表示观测值,—表示一次多项式,—- - -表示二次多项式,- - -表示三次多项式(4个小图分别代表A、B、C、D的线性分析)
2.6 比对结果
综合以上性能,选取检测性能较为理想的C系统为参考对象。实验中超出AMR数据不计入相关统计,A、B、D与C系统的相关性较好,r分别为0.998、0.997、0.985,均>0.975 (n =80,P<0.01);与C系统比较的回归方程分别为YA=-4.32+ 0.957X、YB=5.894+ 0.778X、YD=2.781+0.796X,斜率(b)95%可信区间分别为0.9197~1.0025、0.7434~0.8020、0.7764~0.8125,截距(a)95%可信区间分别为-6.4033~0.1941、4.0040~7.6996、1.5007~4.5862,线性回归的Cusum检验P >0.05;偏差分析显示A、B、D系统平均绝对偏差分别为-9.7、-21.7、-21.1U/L,平均相对偏差分别为-10.12%、-11.96%、-13.51%。表5显示A、B、D系统在医学决定水平时的预期偏差,B、D系统在Xc=180U/L时,允许偏差不在预期偏差的可信区间内且小于可信区间下限,证实B、D系统在Xc=180U/L时与C系统的性能不相当,结果可比性差,不可接受。
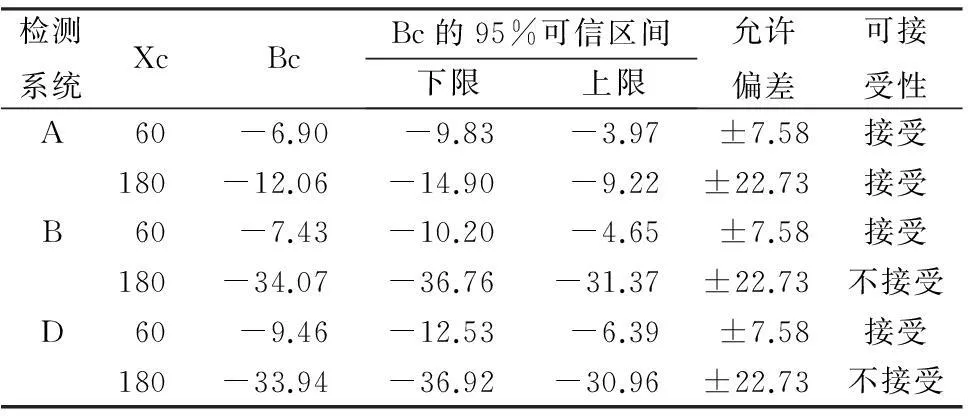
表5 在医学决定水平处预期偏差可接受性评估表(U/L)
3讨论
酶比色法测定LPS的主要原理是:在碱性环境中,脂肪酶在共脂肪酶和胆汁酸的存在下水解人工合成的底物—1,2-邻-二月桂基-消旋-甘油-3-戊二酸-(6-甲基试卤灵)酯(简称:6-甲基试卤灵酯),生成1,2-邻-二月桂基-消旋-甘油和一个不稳定的中间体戊二酸-(6-甲基试卤灵酯),该中间体在碱性条件下,自发降解,生成戊二酸和甲基试卤灵。甲基试卤灵是一个红色显色团,在波长570 nm处有吸收峰,显色的强度直接与样本中的LPS活性呈正比[21]。
本研究评价的4种LPS酶比色法检测系统的精密度均符合生物学变异设定的质量规范。正确度实验显示:仅A、C系统较为满意,结果均在可接受范围内,95%验证区间包含了其指定均值,分析原因可能与CAP赋予的靶值有一定关系,因为CAP室间质评结果的靶值统计是采用所有参与实验者的方法学分组计算中位数的方法,B、D系统的准确性欠佳,与靶值偏差大。4种系统对胆红素均有较强的抗干扰能力,其中A系统对Hb的抗干扰能力较强;B、D系统TG≤20 mmol/L时无明显干扰,抗干扰能力较强。AMR实验结果显示:B、C较A、D系统线性宽。相关分析以选择上述性能较为理想的C系统为参考对象,A、B、D与C系统的相关性较好,r均>0.975 (n=80,P<0.01);偏差分析显示A系统绝对偏差为-9.7 U/L、相对偏差为-10.12%,相对较小。整体来看4种系统之间存在一定偏差,可能由于各系统中校准品溯源不统一,校准品赋值不明确且存在差异,造成产品差异较大。
综上所述,4种检测系统的性能之间存在差异。因此在临床应用中,实验室应选用分析性能优越的检测系统,通过参加室间质评或其它渠道验证其正确度。
[1]Chase CW,Barker DE,Russell WL,et al.Serum amylase and lipase in the evaluation of acute abdominal pain[J].Am Surg,1996,62(12):1028.
[2]Smith RC,Southwell-Keely J,Chesher D.Should serum pancreatic lipase rep;ace serum amylase as a biomarker of acute pancreatitis[J].ANZ J Surg,2005,75(6):399.
[3]Volz KA,McGillicuddy DC,Horowitz GL,et al.Eliminating amylase testing from the evaluation of pancreatitis in the emergency department[J].West J Emerg Med,2010,11(4):344.
[4]Banks PA,Freeman ML.Practice Parameters Committee of the American College of Gastroenterology.Practice guidelines in acute pancreatitis[J].Am J Gastroenterol,2006,101(10):2379.
[5]中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].中华内科杂志,2004,43(3):236.
[6]胡荣盛,俞晓春,杨国昌.血清脂肪酶测定色团底物法德方法学和临床评价[J].临床检验杂志,2003,21(3):162.
[7]杭永伦,黄远帅.血清脂肪酶测定对急性胰腺炎的诊断价值[J].检验医学,2012,27(6):491.
[8]Clinical and Laboratory Standards Institude.Evaluation of Precision Performance of Quantitative Measurement Methods;Approved Guideline-Second Edition,approved guideline[S].EP5-A2,CLSI,2004.
[9]王惠民,王清涛.临床实验室管理学[M].第1版,北京:高等教育出版社,2012:68-71.
[10]徐建华,庄俊华,郑松柏,等.常规方法检测血清总胆红素的正确度评价[J].临床检验杂志,2012,30(12):946.
[11]Clinical and Laboratory Standards Institute.User demonstration of performance for precision and accuracy;approved guideline-second edition[S].EP15-A2.Wayne:CLSI,2004.
[12]程黎明,朱晓华,朱耀武,等.液相免疫胶体金技术用于检测血浆半胱氨酸蛋白酶抑制剂C的方法学评价[J].检验医学,2010,25(3):214.
[13]李海霞,王学晶,徐国宾,等.两种不同检测系统测定半胱氨酸蛋白酶抑制剂C的方法学评价[J].中华检验医学杂志,2007,30(11):1284.
[14]国秀芝,邱玲,刘荔,等.三种应用于自动生化分析仪的半胱氨酸蛋白酶抑制剂C 试剂的分析性能验证[J].中华检验医学杂志,2011,34(6):561.
[15]Clinical and Laboratory Standards Institude.Interference testing in clinical chemistry,Approved Guideline-Second Edition.[S].EP7-A2,CLSI,2005.
[16] Clinical and Laboratory Standards Institude.Evaluation of the linearity of quantitative measurement procedures;A Statistical Approach;Approved Guideline[S].EP6-A,CLSI,2003.
[17]Clinical and Laboratory Standards Institude.Method comparison and bias estimation using patient samples,Approved Guideline-Second Edition[S].EP9-A2,CLSI,2010.
[18]Fraser Callum G,Cummings Steven T,Wilkinson Stephen P,et al.Biological variability of 26 clinical chemistry analytes in elderly people..Clin Chem 1989;35:783-786.
[19]Huguet J,Fffuentes-Arderiu X.Biological variation in the catalytic concentration of pancreatic alfa-amylase and triacylglycerol lipase in serum[J].Scand J Clin Lab Invest,1991,51:735-738.
[20]Juan-Pereira L.Variabilitat biologica intraindividual de les magnitudes bioquimiques[D].Aplicacions cliniques..Doctoral Thesis,Barcelona University 1989.
[21]郑毅,叶海梅,吴朝娟,等.脂肪酶活力测定研究进展[J].工业微生物,2005,35(4):36.
摘要:目的评估4种脂肪酶(Lipase,LPS)检测系统的分析性能。方法方法学评价研究。应用美国临床和实验室标准化协会(CLSI)EP5-A2、EP15-A2、EP7-A2、EP6-A、EP9-A2方法验证4种脂肪酶检测系统的精密度、正确度、抗干扰性、分析测量范围(AMR)、相关及偏差。采用美国病理学家协会(CAP)发放的室间质评物(C-A和C-B)验证不同系统检测LPS正确度。回归分析采用Passing-Bablok检验,回归线性检测采用Cusum方法,相关分析采用Pearson检验,偏差分析应用Bland-Altman曲线。结果LPS在25-240 U/L时,4种检测系统的批内CV均
关键词:脂肪酶;酶比色法;全自动生化分析仪
Performance evaluation of four lipase detection systemsANChong-wen,LIHai-xia.(DepartmentofClinicalLaboratory,PekingUniversityFirstHospital,Beijing100034,China)
Abstract:ObjectiveTo evaluate the performance for four Lipase(LPS)analysis system.MethodsThis study belongs to the methodological evaluation study,Analysed four Lipase systems and their correlation and deviation compared with A system.Precision,accuracy,anti-interference,analytical measuring range (AMR) were evaluated,according to the CLSI EP5-A2,EP15-A2,EP7-A2,EP6-A,EP9-A2 guidelines.To assess the accuracy,we used the EQA samples(C-A and C-B)from CAP.Regression using Passing-Bablok,linear regression was detected by Cusum method,analysis of correlation using pearson,analysis of deviation using Bland-Altman.ResultsFor four lipase detection systems,the within-run CVs were all <1/4TEa(9.47%)and the between-run CVs were all <1/3TEa(12.63%)when the concentration of LPS was 25-240 U/L.The accuracy verification testing CAP EQA material showed that A and C system results met the desirable,the 95% verification interval that contains the specified mean value,and in accordance with the total allowable error derived from biological variation set (TEa:<37.88%);Recovery test shows that except for the high recovery of specimens from B system,other systems were not exceed±10%.Anti-interference analysis showed that had over 10% positive interference on the low level of B、C system while Hb≥5 g/L and on the low level of D system when Hb was 15 g/L;There was no significant interference for the four systems when Bil≤600 μmol/L.It had over 10% negative interference of A、C system while TG ≥8 mmol/L;The upper limits of AMR for A,B,C and D system were 341,494,529 and 379 U/L respectively.Correlation analysis to select the C system the performance of ideal as the reference object,the A,B,D system correlation well with C system and the pearson correlation coefficient(r)>0.975 (P< 0.01);Compared with C system,the Bland-Altman results showed that the average absolute deviation were -9.7、-21.7、-21.1 U/L and the average relative devation were -10.12%、-11.96%、-13.51% respectively for the A,B,D system.By calculating expected deviation of medical decision level (Xc) showed that A,B,D systems were in line with 1/3 total allowable error (12.63%) of the biological variation set when Xc=60 U/L,the allowable deviation of B,D systems were not in the confidence interval (CI) and also less than the lower limit of the confidence interval from expected deviation when Xc=180 U/L,and performance of B,D system by verified was not quite compared with the C system when the Xc=180 U/L,comparability of the results was difference and unacceptable.ConclusionThere are differences between the performance of the four lipase detection system.
Key words:Lipase;Enzyme colorimetry;Automatic biochemical analyzer
收稿日期:(2014-04-25)
文献标识码:A
中图分类号:R446.11+2
文章编号:1007-4287(2015)01-0001-06
通讯作者*
基金项目:国家科技支撑计划基金资助项目(2012BAH24F00)
