吲哚-3-原醇对人肺癌细胞株A549的促凋亡和增殖抑制作用
2015-02-23尹宜发
付 娟,尹宜发,姚 霞,杨 欣
吲哚-3-原醇对人肺癌细胞株A549的促凋亡和增殖抑制作用
付 娟,尹宜发,姚 霞,杨 欣*
目的 探讨吲哚-3-原醇(Indol-3-carbinol,I3C)对肺腺癌细胞株A549细胞增殖和凋亡的影响及其作用机制。方法 将对数生长期的A549细胞分别用不同浓度的I3C处理(0、25、50、100 μg/mL)。细胞培养72 h后,采用MTT观察I3C对A549细胞的增殖抑制作用;Annexin V-PI/FITC检测细胞凋亡;Western blotting检测细胞中PI3K、p-AKT、Bax、Bcl-2、Cleavage-PARP、Clevage-Caspase3蛋白的变化。结果 I3C可以呈浓度依赖性地诱导A549细胞的增殖抑制和凋亡,上调Bax和Cleavage-PARP、Cleavage-Caspase3表达,下调PI3K、p-AKT和Bcl-2,对AKT表达无明显影响。结论 I3C可通过抑制PI3K/AKT信号通路而诱导A549细胞增殖抑制和凋亡。
吲哚-3-原醇;A549;增殖;凋亡;PI3K/AKT
0 引言
肺癌是常见的恶性肿瘤之一,其发病率和死亡率极高,目前高居男性死亡率的第1位,严重影响人类健康[1]。目前肺癌的治疗方式包括早期手术切除、放疗和化疗等,但目前治疗手段效果有限,而且不良反应大[2]。近年来从自然界天然植物中提取有效成分抗肿瘤成为肿瘤研究的热点[3-5]。吲哚-3-原醇(Indol-3-carbinol,I3C)是葡萄糖蔓芹苷的前体,大量存在于十字花科类食用蔬菜如西兰花等[6]。研究发现,I3C可以抑制肿瘤细胞增殖和诱导癌细胞凋亡、清除氧自由基和抗脂质过氧化等作用[6-8],常用来治疗消化道、肝脏和前列腺等处的肿瘤[3-5]。肺癌的发生是细胞凋亡与细胞增殖平衡失调的结果[9]。本研究以人肺腺癌细胞株A549为靶细胞,探讨I3C对肺腺癌细胞株A549的作用及其机制。
1 材料与方法
1.1 材料 人肺腺癌细胞株A549,购于ATCC,I3C(Sigma,USA)经HPLC鉴定纯度超过99%;CCK-8试剂盒购自武汉谷歌;Annexin V-FITC凋亡试剂盒(Abcam,USA),RPMI 1640 培养基,美国Gibgo公司;小牛血清,杭州四季青公司;12孔培养板,美国Falcon公司;β-actin抗体(Abmart,China),Bcl-2抗体(Santa Cruz,CA),Bax抗体(Santa Cruz,CA),Cleavage-PARP(Santa Cruz,CA),Cleavage-Caspase3(Santa Cruz,CA),PI3K(CST,USA),AKT抗体(CST,USA),p-AKT抗体(CST,USA)。蛋白裂解液RIPA(碧云天),蛋白酶抑制剂cocktail及Western blot凝胶制备试剂盒购自武汉谷歌生物公司,BCA蛋白定量试剂盒(碧云天),酶标仪(Thermo Fisher)。
1.2 细胞培养 A549细胞置于含有10%胎牛血清的RPMI 1640培养液中,加入青霉素(100 U/mL)和链霉素(100 U/mL),在37 ℃、5% CO2饱和湿度培养箱中培养。
1.3 仪器 CO2细胞培养箱,美国Forma scientific公司;倒置显微镜、激光共聚焦显微镜,日本Olympus公司;酶标仪(Thermo Fisher)。PVDF膜(Roche),ECL试剂盒(Bi-pech),胶片及化学发光仪(Kodak)。
1.4 细胞增殖的MTT法检测 取对数生长期A549细胞,接种于12孔板内,调整密度为1×104/mL,每孔100 μL,加入A549(0、25、50、100 μg/mL),计量参考文献[10],每组均设3个复孔。12孔板置于37 ℃、5% CO2培养箱培养72 h后,加入5 mg/mL的MTT溶液20 μL/孔,继续培养4 h,然后加入三联裂解液[10% SDS+5%异丁醇+1% HCL(10 mol/L),100 μL/孔],37 ℃放置过夜后,用酶标仪于波长570 nm处读取吸光度(OD)值,根据OD值计算细胞增殖抑制率:细胞增殖抑制率(%)=[对照孔OD值-实验孔OD值]/[对照孔OD值-空白孔OD值]×100%。
1.5 Annexin-V双染法检测细胞凋亡 取对数生长期的细胞接种于6孔板中,调整密度为1×105/mL。细胞培养72 h后,收集各组所有悬浮细胞,调整细胞密度为1×104/mL,每孔100 μL,加入A549(0、25、50、100 μg/mL),取1 mL细胞悬液,1 000 r/min离心5 min,去培养基,37 ℃水浴1 h,放入冰浴加入0.5 mg/L碘化丙啶(PI)及Annexin V,流式细胞仪检测。采用CELIQUEST软件分析细胞凋亡率。
1.6 Western blotting检测各项指标表达 将各浓度组收集的细胞用预冷的PBS清洗后,按照蛋白裂解液RIPA操作说明提取蛋白,BCA法进行蛋白定量,将各组蛋白浓度调成一致,沸水煮5 min,待用。取各组细胞总蛋白样品80 μg,以样品中的β-actin为内参,经SDS-PAGE凝胶电泳,转膜,然后用含5%脱脂奶粉的PBS封闭2 h,分别加入适量含2%脱脂奶粉的PBS稀释PI3K抗体(1∶400),AKT抗体(1∶1 000),p-AKT(1∶500),Bax(1∶500),Bcl-2(1∶500),Cleavage-PARP (1∶1 000),Cleavage-Caspase3(1∶500)和β-actin(1∶3 000)抗体,4 ℃孵育过夜。PBS洗膜3次,10 min/次,根据一抗的来源,再分别加入适量含2%脱脂奶粉的PBS稀释的HRP标记羊抗兔IgG(1∶500)、HRP标记羊抗鼠IgG(1∶5 000)室温下作用2 h,PBS洗膜3次,10 min/次,ECL化学发光显色、压片、显影、定影、胶片扫描保存。用Ge-l Pro Analyzer(Ver.3.0)软件测定蛋白条带灰度值,PI3K、AKT、p-AKT、Bax、Bcl-2和Cleavage-Caspase3条带灰度值与β-actin内参条带灰度值的比值,分别将上述蛋白表达量化。
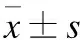
2 结果
2.1 I3C对A549细胞增殖的影响 MTT检测实验结果显示,A549呈剂量依赖性抑制HeLa细胞增殖,在100 μmol达到最大抑制率(P<0.05)。见图1。
2.2 I3C对A549细胞凋亡的影响 流式检测实验结果显示,I3C可以呈浓度依赖性促进A549细胞凋亡。见图2。
2.3 I3C对A549细胞、PI3K和AKT的影响 Western blotting显示,I3C呈剂量依赖性降低PI3K和p-AKT的表达,但对AKT表达无明显影响,显示I3C可以抑制A549细胞PI3K/AKT信号通路的激活。见图3。
2.4 I3C对A549细胞BCL-2、Bax和Clevage-Caspase3表达的影响 Western blotting显示,I3C可以呈剂量依赖性促进BCL-2的降解和上调Bax和Cleavage-PARP、Clevage-Caspase3的表达(P<0.05或P<0.01)。见图4。
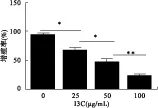
图1 MTT检测I3C对A549细胞增殖的影响
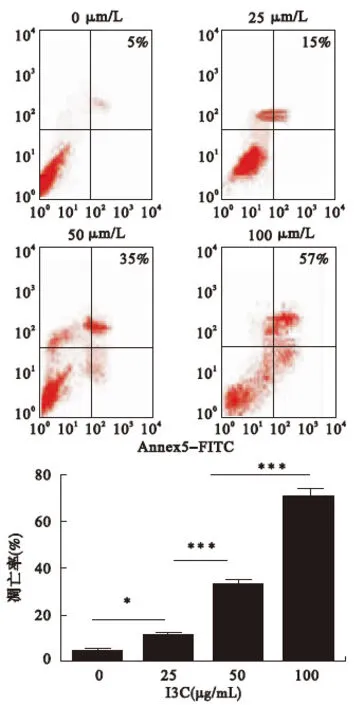
图2 流式检测I3C对A549细胞凋亡的影响(n=6)
3 讨论
肺癌发生于支气管粘膜上皮,亦称支气管癌。近50年来肺癌的发病率明显增高,在男性癌症患者中,肺癌已居首位,女性发病率也迅速增高,占女性常见恶性肿瘤的第2位或第3位[1-5]。肺癌细胞具有较强的生长增殖、基质黏附和抗凋亡等能力,这些都是影响肺癌预后的主要因素,目前肺癌的治疗方式包括手术切除、药物化疗、射线放疗等,效果有限,且不良反应大,因此,寻找能抑制肺癌细胞增殖和促进肺癌细胞凋亡的药物,成为各国研究关注的难点和热点[6-7]。

图3 Western blotting检测I3C对各组细胞PI3K、p-AKT和AKT的表达
注:组间比较,*P<0.05

图4 Western blotting检测I3C对A549细胞BCL-2、Bax和Clevage-Caspase3表达的影响
注:组间比较,*P<0.05,**P<0.01
I3C是十字花科蔬菜的主要成分之一,作为一种天然抗氧化剂和自由基清除剂,研究发现,I3C对肝癌、鼻咽癌、宫颈癌等多种肿瘤细胞都具有良好的抑制作用[3-5]。大量研究表明,I3C可通过多种途径发挥有效的抗肿瘤作用,主要包括阻滞细胞周期、调控与细胞增殖分化密切相关的细胞信号转导因子等,以抑制肿瘤细胞增殖,并诱导其发生凋亡[6-8]。研究发现,I3C可以通过PI3K/AKT信号通路的激活而抑制如肝癌、乳腺癌等肿瘤细胞增殖和促进肿瘤细胞凋亡[11-14]。PI3K/AKT信号通路是经典的信号通路,参与多种细胞信号的介导,这些信号涉及细胞周期分化、转录、翻译、糖代谢、细胞增殖和凋亡受阻[11-14]。研究发现,PI3K/AKT信号通路激活可促进肺癌细胞增殖和凋亡受阻[15]。
本实验发现,I3C可以剂量依赖性地诱导A549细胞增殖抑制和凋亡,上调Bax、Cleavage-PARP和Cleavage-Caspase3的表达,下调PI3K、p-AKT和Bcl-2的表达,但对AKT表达无明显影响。这提示I3C可通过抑制PI3K/AKT信号通路而诱导肺癌细胞系增殖抑制和凋亡。 综上所述,I3C可通过抑制PI3K/Akt信号通路而诱导A549细胞增殖抑制和凋亡。但是I3C是直接作用于PI3K信号分子还是通过调节其上游激酶和/或信号分子而间接发挥作用仍不清楚,除PI3K/AKT信号通路外,是否还有其他信号通路涉及PI3K诱导A549细胞增殖抑制和凋亡,尚需进一步的研究。
[1]Rousseau-Bussac G,Crequit P,Alifano M,et al.Management of malignant pericardial effusion in lung cancer[J].Rev Mal Respir,2014,31(8):746-753.
[2]Wink KC,Roelofs E,Solberg T,et al.Particle therapy for non-small cell lung tumors: where do we stand? A systematic review of the literature[J].Front Oncol,2014,29(4):292-296.
[3]Zhou DH,Wang X,Feng Q.EGCG enhances the efficacy of cisplatin by downregulating hsa-miR-98-5p in NSCLC A549 cells[J].Nutr Cancer,2014,66(4):636-644.
[4]Wang Z.Selection of chemotherapy for non-small cell lung cancer is facilitated by new therapeutic strategies[J].Int J Clin Exp Med,2014,7(11):3833-3842.
[5]Aghanoori MR,Mirzaei B,Tavallaei M.MiRNA molecular profiles in human medical conditions: connecting lung cancer and lungdevelopment phenomena[J].Asian Pac J Cancer Prev,2014,15(22):9557-9565.
[6]Acharya A,Das I,Singh S,et al.Chemopreventive properties of indole-3-carbinol,diindolylmethane and other constituents of cardamom against carcinogenesis[J].Recent Pat Food Nutr Agric,2010,2(2):166-177.
[7]Maruthanila VL,Poornima J,Mirunalini S.Attenuation of carcinogenesis and the mechanism underlying by the influence of indole-3-carbinol and its metabolite 3,3′-diindolylmethane: a therapeutic marvel[J].Adv Pharmacol Sci,2014,(7):832161.
[8]Sarkar FH,Li Y.Harnessing the fruits of nature for the development of multi-targeted cancer therapeutics[J].Cancer Treat Rev,2009,35(7):597-607.
[9]Shen C,Wang X,Tian L,et al.Microsatellite alteration in multiple primary lung cancer[J].J Thorac Dis,2014,6(10):1499-1505.
[10]Choi HS,Cho MC,Lee HG,et al.Indole-3-carbinol induces apoptosis throughp53and activation of caspase-8 pathway in lung cancerA549 cells[J].Food Chem Toxicol,2010,48(3):883-890.
[11]Mao CG,Tao ZZ,Chen Z,et al.Indole-3-carbinol inhibits nasopharyngeal carcinoma cell growth in vivo andin vitro through inhibition of the PI3K/Akt pathway[J].Exp Ther Med,2014,8(1):207-212.
[12]Ahmad A,Biersack B,Li Y,et al.Targeted regulation of PI3K/Akt/mTOR/NF-Κb signaling by indole compounds and their derivatives: mechanistic details and biological implications for cancer therapy[J].Anticancer Agents Med Chem,2013,13(7):1002-1013.
[13]Zhu J,Li Y,Guan C,et al.Anti-proliferative and pro-apoptotic effects of 3,3′-diindolylmethane in human cervical cancer cells[J].Oncol Rep,2012,28(3):1063-1068.
[14]Wang YQ,Chen C,Chen Z,et al.Indole-3-carbinol inhibits cell proliferation and induces apoptosis in Hep-2 laryngeal cancer cells[J].Oncol Rep,2013,30(1):227-233.
[15]Zhang C,Lan T,Hou J,et al.NOX4 promotes non-small cell lung cancer cell proliferation and metastasis through positive feedback regulation of PI3K/Akt signaling[J].Oncotarget,2014,5(12):4392-4405.
Effect of indole-3-carbinol on proliferation and apoptosis of A549 cells
FU Juan,YIN Yi-fa,YAO Xia,YANG Xin*
(The Second People′s Hospital and Yichang Second People′s Hospital of China Three Gorges University,Hubei 443000,China)
Objective To investigate the effect and mechanisms of the indole-3-carbinol on the apoptosis and proliferation of human lung adenocarcinoma cells line A549.Methods The A549 cells at logarithmic growth phase were divided into control group and I3C groups.The cells were normally treated with different concentrations of I3C (0,25,50,100 μg/mL).MTT and Annexin V-PI/FITC were used to examine the proliferation and apoptotic changes of the A549 cell after incubation for 72 h,respectively.The changes of PI3K,p-AKT,AKT,Bax,Bcl-2,Cleavage-PARP and Cleavage-Caspase3 protein were detected by Western blotting.Results The results showed that I3C treatment can decrease the proliferation of A549 and the expression of PI3K,p-AKT and Bcl-2 and increase the apoptosis rate of A549,the expression of Cleavage -PARP,Cleavage-Caspase3 and Bax.Moreover,I3C had no influence on the expression of AKT.Conclusion I3C can induce the apoptosis and growth inhibition of human lung adenocarcinoma cells line A549 and the mechanism is involved in PI3K/AKT signaling.
Indole-3-carbinol; A549 cells; Proliferation; Apoptosis; PI3K/AKT
2014-12-02
三峡大学第二人民医院暨宜昌市第二人民医院,湖北 宜昌443000
国家自然科学基金(81100264)
10.14053/j.cnki.ppcr.201507002
*通信作者
