非酒精性脂肪肝患者血清TNF-α、IL-6水平变化及其与胰岛素抵抗的相关性
2015-02-23金世禄屈冬冬
金世禄, 屈冬冬
(1. 山东省滨州市人民医院 消化内科, 山东 滨州, 256610;
2. 滨州医学院 临床学院, 山东 烟台, 264003)
非酒精性脂肪肝患者血清TNF-α、IL-6水平变化及其与胰岛素抵抗的相关性
金世禄1, 屈冬冬2
(1. 山东省滨州市人民医院 消化内科, 山东 滨州, 256610;
2. 滨州医学院 临床学院, 山东 烟台, 264003)
摘要:目的探讨非酒精性脂肪肝(NAFL)患者血清肿瘤坏死因子-α(TNF-α)及白细胞介素-6(IL-6)的水平变化及其与胰岛素抵抗的相关性。方法选取39例NAFL患者为NAFL组,另选取同期健康体检者30例为对照组。比较2组空腹血糖(FBG)、胰岛素抵抗指数(HOMA-IR)、IL-6及TNF-α水平变化,分析HOMA-IR与血清IL-6和TNF-α水平的关系。结果NAFL组的FBG、HOMA-IR、IL-6及TNF-α水平高于对照组,差异有统计学意义(P<0.05, P<0.01)。Pearson相关性分析结果显示,HOMA-IR与IL-6、TNF-α具有显著正相关(r=0.649, 0.724, P<0.01)。结论NAFL患者血清IL-6和TNF-α水平显著升高,且与胰岛素抵抗关系密切。
关键词:非酒精性脂肪肝; 肿瘤坏死因子-α; 白细胞介素-6; 胰岛素抵抗; 空腹血糖
非酒精性脂肪肝(NAFL)是一种临床综合征,主要病理特征为肝细胞脂肪沉积和变性,但无过量饮酒史,其主要病变在肝小叶[1]。有学者[2]研究得出,胰岛素抵抗是NAFL发生和发展的基础。炎症细胞因子,如肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)等,具有调节胰岛素抵抗的作用[3]。有研究显示, NAFL患者体内的IL-6及TNF-α水平较高,但IL-6及TNF-α与疾病和胰岛素抵抗之间的关系仍需进一步研究讨论[4]。因此,本研究主要通过分析NAFL患者胰岛素抵抗与IL-6和TNF-α水平变化之间的关系,探讨血清IL-6及TNF-α在NAFL发生、发展中的作用,为临床有效治疗NAFL提供依据。
1资料与方法
1.1 一般资料
选取2012年10月—2014年8月山东省滨州市人民医院消化科治疗的NAFL患者39例为NAFL组,均符合中华医学会2003年的诊断标准[6]:B超显示肝肾回声有差异,肝脏回声大于肾脏回声;肝脏内部的静脉结构模糊不清;肝脏呈现轻度或重度肿大;肝脏前后回声有差异。其中男21例,女18例;年龄37~65岁,平均(50.50±3.8)岁;患者均为初诊,入组前未接受任何治疗。排除标准: ① 病毒性肝炎和自身免疫性肝炎患者; ② 服用避孕药的女性; ③ 患有严重糖尿病并发症和感染; ④ 有遗传性疾病。另选取同期体检的健康人30例为对照组,其中男17例,女13例;年龄38~64岁,平均(51.3±4.0)岁。2组性别、年龄等一般资料无显著差异(P>0.05)。
1.2 方法
1.2.1标本采集:入选患者空腹过夜,于次日上午9:30左右抽取8 mL肘静脉血,将其中4 mL立即行血清分离术,保存于-20 ℃冰箱,用于IL-6及TNF-α水平检测;剩余4 mL行肝炎病毒标志物、肝肾功能及空腹血糖(FBG)、空腹胰岛素(FINS)等检测。
1.2.2实验室检测:采用日本罗氏全自动检测仪检测FBG。采用放射免疫分析法测量患者血清IL-6及TNF-α水平,试剂盒购自北京生物技术研究所。FINS采用放射免疫法,试剂盒购自上海放射免疫分析技术研究有限公司。胰岛素批间CV<7.6%,批内CV<4.2%。采用稳态模型评价法(HOMA)评价胰岛素的抵抗程度,胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。
2结果
2.1 2组FBG、HOMA-IR、IL-6及TNF-α比较
如表1 所示,NAFL组患者的FBG、HOMA-IR、IL-6及TNF-α水平高于对照组,差异有统计学意义(P<0.05或P<0.01)。
表1 2组FBG、HOMA-IR、IL-6及TNF-α比较
与对照组比较,*P<0.05, **P<0.01。
2.2 HOMA-IR与IL-6、TNF-α相关性分析
Pearson相关性分析结果显示, IL-6、TNF-α与HOMA-IR具有显著正相关(r=0.649, 0.724,P<0.01)。见图1、2。
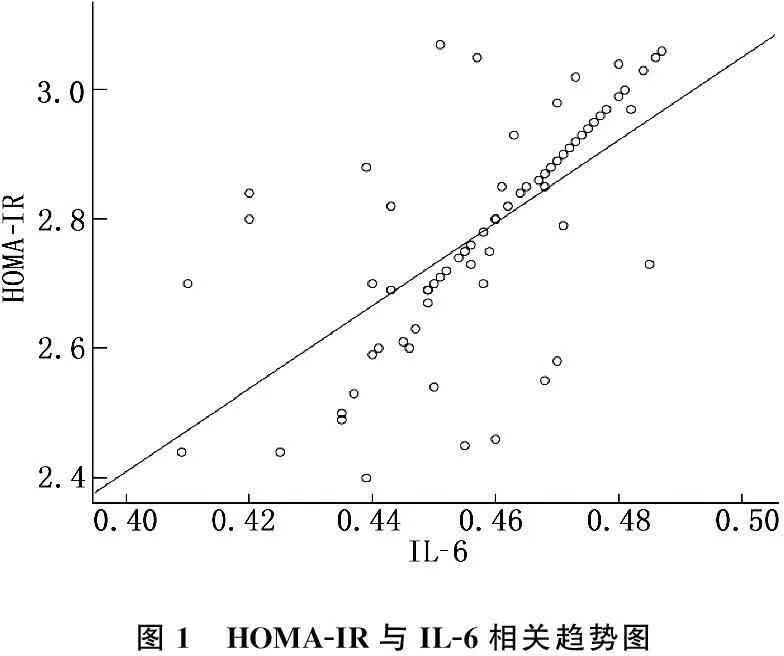
图1 HOMA-IR与IL-6相关趋势图

图2 HOMA-IR与TNF-α相关趋势图
3讨论
NAFL以弥漫性干细胞大泡性脂肪变为主要特征,由多种因素(酒精及明确的损肝因素除外)所致,发病率高,严重危害人类的生活质量和生命健康。一项关于西班牙NAFL患者的研究发现,NAFL的发生率高达26.4%[7]。NAFL的病因至今尚不完全清楚,但有研究认为胰岛素抵抗可能起重要作用,而肥胖、高脂血症及2型糖尿病等,是NAFL形成的重要危险因素[8]。通过高胰岛素血症和高脂血症,胰岛素抵抗可引起肝细胞内脂肪堆积,为NAFL发生和发展奠定了基础,且脂肪堆积的严重程度与NAFL的发展有密切关系,后期极易产生与胰岛素抵抗相关的恶性循环[9]。本研究结果发现,2组HOMA-IR存在显著性差异,提示胰岛素抵抗可能是NAFL的主要特征之一。
TNF-α被认为是单纯性脂肪肝进展为NAFL的中药细胞因子,也是一种来自体内多种细胞的最经典的炎症因子,包括脂肪细胞、巨噬细胞、单核细胞、内皮细胞及肥大细胞等,可参与多种炎性疾病(如感染性休克)和自身免疫性疾病(如风湿性关节炎)的发病机制[10]。IL-6是一种细胞因子,由内皮细胞、脂肪细胞、T细胞分泌,具有多种不同生理学效应,与炎症反应具有高度相关性[11]。炎症细胞因子的主要来源是巨噬细胞,研究表明,NAFL患者的肝脏和脂肪组织均检测出了大量异常增多的巨噬细胞,而肝脏和脂肪组织也可分泌IL-6和TNF-α, 说明NAFL的发生与IL-6和TNF-α水平变化有关[12]。另有研究表明, NAFL患者普遍存在高水平的IL-6和TNF-α, 说明IL-6和TNF-α可能参与NAFL的发生与发展[13]。本研究结果显示,NAFL组和对照组患者的IL-6和TNF-α水平具有显著差异,进一步证实了IL-6和TNF-α水平升高可能参与了NAFL的发生、发展。
近年来,大量研究结果发现,NAFL患者存在显著的胰岛素抵抗和炎症因子水平升高[14], 提示NAFL、胰岛素抵抗和炎症因子之间可能存在某种联系。IL-6同时也是一种脂肪因子和免疫调节因子,在肥胖患者脂肪组织内,其表达可高达30%,提示IL-6可参与胰岛素抵抗的发生发展。同时,TNF-α和IL-6可协同作用,介导胰岛素抵抗的发生[15]。本研究相关性分析结果显示,HOMA-IR与IL-6、TNF-α具有显著相关性,这与以上研究结果一致。
综上所述,IL-6和TNF-α在NAFL患者体内呈高表达状态,且与HOMA-IR呈显著正相关,提示其NAFL的发生、发展中可能起一定作用。
参考文献
[1]Nahandi M Z, Khoshbaten M, Ramazanzadeh E, et al. Effect of non-alcoholic fatty liver disease on carotid artery intima-media thickness as a risk factor for atherosclerosis[J]. Gastroenterol Hepatol Bed Bench, 2014, 7(1): 55.
[2]Baran B, Akyüz F. Non-alcoholic fatty liver disease: What has changed in the treatment since the beginning[J]. World J Gastroenterol, 2014, 20(39): 14219.
[3]Celinski K, Konturek PC, Slomka M, et al. Effects of treatment with melatonin and tryptophan on liver enzymes, parameters of fat metabolism and plasma levels of cytokines in patients with non-alcoholic fatty liver disease-14 months follow up[J].J Physiol Pharmacol, 2014, 65(1): 75.
[4]王军英, 王红梅, 王军, 等. 非酒精性脂肪肝患者血清TNF-α、IL-6水平及意义[J].中国现代医学杂志, 2013, 23(33): 42.
[5]Zhao J, Zheng H, Liu Y, et al. Anti-inflammatory effects of total alkaloids from Rubus alceifolius Poir [corrected]. on non-alcoholic fatty liver disease through regulation of the NF-κB pathway[J].Int J Mol Med, 2013, 31(4): 931.
[6]中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南 (2010 年修订版)[J]. 中国肝脏病杂志, 2010, 2(4): 43.
[7]Caballeria L, Pera G, Rodriguez L, et al. Metabolicsyndrome and nonalcoholic fatty liver disease in a Spanish population: influence of the diagnostic criteria used[J].Eur J Gastroenterol Hepatol, 2012, 24(9): 1007.
[8]Genc H, Dogru T, Kara M, et al. Association of plasma visfatin with hepatic and systemic inflammation in nonalcoholic fatty liverdisease[J].Ann Hepatol, 2013, 12(4): 548.
[9]Page J. Nonalcoholic fatty liver disease: the hepatic metabolicsyndrome[J].J Am Acad Nurse Pract, 2012, 24(6): 345.
[10]Mas E, Danjoux M, Garcia V, et al. The pro-inflammatory action of tumour necrosis factor-α in non-alcoholic steatohepatitis is independent of the NSMAF gene product[J]. Dig Liver Dis, 2013, 45(2): 147.
[11]Giannitrapani L, Soresi M, Balasus D, et al. Genetic association of interleukin-6 polymorphism (-174 G/C) with chronic liver diseases and hepatocellular carcinoma[J].World J Gastroenterol, 2013, 9(16): 2449.
[12]Georgoulis M, Kontogianni MD, Tileli N, et al. The impact of cereal grain consumption on the development and severity of non-alcoholic fatty liver disease[J].Eur J Nutr, 2014, 53(8): 1727.
[13]Das SK, Balakrishnan V. Role of cytokines in the pathogenesis of non-alcoholic fatty liver disease[J].Indian J Clin Biochem, 2011, 26(2): 202.
[14]张进军, 陈晓雯, 李居一, 等. 复方健胰胶囊对非酒精性脂肪肝病患者血清超敏C-反应蛋白、肿瘤坏死因子-α和白介素-18的影响[J]. 安徽中医药大学学报, 2014, 33(1): 24.
[15]Dali-Youcef N, Mecili M, Ricci R, et al. Metabolic inflammation: Connecting obesity and insulin resistance[J]. Ann Med, 2012, 4: 7.
Changes of serum tumor necrosis factor-α and interlukin-6 levels in patients with non-alcoholic fatty liver and its correlation with insulin resistance
JIN Shilu1, QU Dongdong2
(1.DepartmentofGastroenterology,BinzhouPeople′sHospital,Binzhou,Shandong, 256610;
2.SchoolofMedicine,BinzhouMedicalUniversity,Yantai,Shandong, 264003)
ABSTRACT:ObjectiveTo explore the changes of serum tumor necrosis factor-α (TNF-α) and interlukin-6 (IL-6) levels in patients with non-alcoholic fatty liver (NAFL) and its correlation with insulin resistance. MethodsThirty-nine patients with NAFL were selected as NAFL group, and 30 healthy people were selected as control group. The changes of fasting blood glucose (FBG), homeostasis model assessment-insulin resistance (HOMA-IR), IL-6 and TNF-α levels were compared between two groups, and the relationship between HOMA-IR and IL-6, TNF-α levels was analyzed. ResultsThe levels of FBG, HOMA-IR, IL-6 and TNF-α in the NAFL group were significantly higher than those in the control group (P<0.05 or P<0.01). Pearson correlation analysis revealed that HOMA-IR was positively correlated with IL-6 and TNF-α (r=0.649, 0.724, P<0.01). ConclusionThe levels of serum IL-6 and TNF-α increase significantly in patients with NAFL, and these two indexes are closely related with insulin resistance.
KEYWORDS:non-alcoholic fatty liver; tumor necrosis factor-α; interlukin-6; insulin resistance; fasting blood glucose
通信作者:屈冬冬, E-mail: qddcool@163.com
基金项目:中国高校医学期刊临床专项资金(11321991)
收稿日期:2014-12-21
中图分类号:R 575.5
文献标志码:A
文章编号:1672-2353(2015)05-048-03DOI: 10.7619/jcmp.201505015
