IP3R1在弥漫性轴索损伤后早期的表达及其意义
2015-02-23宋锦宁马旭东郭小叶刘晓斌
金 涛,宋锦宁,李 宇,马旭东,郭小叶,刘晓斌
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061; 2.安康市中心医院神经外科,陕西安康 725000)
◇专题研究◇
IP3R1在弥漫性轴索损伤后早期的表达及其意义
金 涛1,2,宋锦宁1,李 宇1,马旭东1,郭小叶1,刘晓斌1
(1.西安交通大学医学院第一附属医院神经外科,陕西西安 710061; 2.安康市中心医院神经外科,陕西安康 725000)
目的 通过观察大鼠弥漫性轴索损伤(diffuse axonal injury, DAI)后I型1,4,5-三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor type I, IP3R1)表达随时间的变化,探讨其作用,为DAI后轴索的继发性损伤及断裂提供研究基础。方法 25只健康雄性成年SD大鼠,随机分为对照组和实验组(DAI组),采用Golgi镀银染色及SP免疫组织化学染色,观察其在不同时间(3~72 h)的脑干组织病理变化及IP3R1的表达情况。结果 Golgi镀银染色证明大鼠DAI模型成功;免疫组织化学染色显示,对照组大鼠脑干中IP3R1有弱阳性表达,实验组阳性细胞较对照组明显增高,在DAI损伤后,大鼠脑干组织IP3R1表达3 h时就开始升高,至24 h高峰后开始下降,72 h下降至低水平。结论 IP3R1可能在DAI后轴索的继发性损伤及断裂中起重要作用。
弥漫性轴索损伤;I型1,4,5-三磷酸肌醇受体(IP3R1);内质网(ER);钙超载;颅脑损伤
弥漫性轴索损伤(diffuse axonal injury, DAI)是一种常见类型特殊脑外伤,意识障碍是其典型的临床表现,预后大多较差,主要病理特征为神经轴索断裂、轴索回缩球形成[1]。DAI具体的发病机制十分复杂,钙离子一直被认为其在DAI神经元的变性及死亡中起关键性作用,而神经元的钙离子超载除了有细胞外钙离子的内流发挥重要作用外,也有内质网(endoplasmic reticulum, ER)参与的钙库钙离子释放发挥的作用。ER是神经元钙库的一种主要成分,而神经元细胞ER钙库释放主要受IP3受体(IP3R)系统及Ryanodine受体(RyR)系统调控[2]。本文采用大鼠头颅瞬间旋转装置建立DAI模型,研究IP3R在DAI后的表达规律和作用,为DAI后轴索的继发性损伤及断裂提供研究基础。
1 材料与方法
1.1 动物及分组 健康雄性成年SD大鼠25只,体质量250~350 g(西安交通大学医学院实验动物中心提供)。将动物随机分为对照组(5只)和实验组(DAI组,共20只,设3 h组、12 h组、24 h组、72 h组共计4个亚组,每个亚组各5只)。选用24 h实验组进行Golgi镀银染色鉴定DAI模型。
1.2 动物模型的建立
研制的大鼠头颅瞬间旋转损伤模型,装置带动大鼠头颅在冠状面瞬间旋转,大鼠头颅经历突然的旋转加速及减速,使得致伤大鼠产生DAI,同时不伴有明显脑挫裂[4]。按照用100 g/L水合氯醛(2 mL/kg)腹腔注射麻醉后固定于上述自制损伤装置上,使躯干与实验台成30°角。待清醒后,DAI组大鼠在按下扳机使大鼠脑组织即刻在瞬间受到旋转角加速度损伤,随即限位盘与限位销的撞击会使旋转突然停止,使大鼠脑组织再次受到减速性损伤。共打击8次。致伤完毕后卸下大鼠,DAI组大鼠伤后均立即出现不同程度的原发性昏迷。清醒后放回饲养笼内保温并给予常规饲养,观察生命体征及行为学变化。对照组仅给予麻醉、固定,待其清醒后即卸下,放回饲养笼内常规饲养。
将对照组及实验组大鼠造模后3、12、24、72 h分别进行改良神经功能缺损程度评分(mNSS)。
1.3 组织切片处理 各组于相应时间点,用100 g/L水合氯醛以2.0 mL/kg的剂量腹腔麻醉大鼠。经左心室快速灌入生理盐水250 mL,然后用40 g/L多聚甲醛溶液250 mL灌注。取出整个脑组织并行石蜡包埋,矢状面连续切片。
1.4 Golgi镀银染色 组织切片脱蜡后置于已预热至37 ℃的35 g/L硝酸银溶液中避光浸银30 min,100 mL/L甲醛溶液还原5 min,滴加氨银乙醇液(每片200 μL;处理5 min)2~3次,80 mL/L甲醛水溶液中浸泡,到黄色不再加深停止,2~3次。蒸馏水清洗5 min脱水、透明及封片。
1.5 免疫组织化学染色及评分 按照SP试剂盒(北京中杉金桥)说明书进行。一抗使用兔抗IP3R1(北京博奥森,1∶100)。免疫组化评分的方法参照文献[5]进行,具体如下:A为视野下切片组织的平均染色强度,即高倍视野内免疫组化阳性细胞数的评分的总和(0、1、2、3分,分别为阴性、弱阳性、中阳性和强阳性)除以高倍视野下细胞总数;B为高倍视野内免疫组化阳性细胞占所有细胞数的百分比,百分比<1%时B=0;在1%~10%之间时B=1;在11%~50%之间时B=2;在51%~80%之间时B=3,在81%~100%之间时B=4。免疫组化评分=A×B。
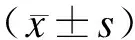
2 结 果
2.1 大体病理学改变 DAI组部分大鼠脑组织背面可见脑干部位、脑腹侧面点状出血灶及蛛网膜下腔出血,但均无明显的脑挫裂伤。灌注后脑组织表面及切面未见血管丝,除出血点外脑组织呈白色,说明脑组织灌注效果良好。
2.2 mNSS评分 DAI组损伤后3 h mNSS评分为11.57±1.39,与对照组(0)相比,差异有统计学意义(P<0.01),说明该模型造成了大鼠的神经功能中、重度损伤。此后,神经功能出现一定的恢复,12、24、72 h mNSS评分分别为9.25±2.15、5.95±1.65、5.47±1.38,但仍明显高于对照组(P<0.05)。
2.3 Golgi镀银染色 对照组大鼠脑组织经Golgi镀银染色后光镜下观察可见脑干神经元轴突光滑,走形连续(图1A)。DAI后24 h Golgi镀银染色显示神经元轴突肿胀,部分呈串珠样改变,轴突球形成(图1B)。
2.4 IP3R1免疫组织化学染色 对照组大鼠IP3R1在其正常脑干中有弱阳性表达,实验组阳性细胞较对照组明显增高,差异有统计学意义(P<0.05),阳性细胞主要为神经元细胞;在遭受DAI损伤后,大鼠脑干组织IP3R1表达3 h时就开始升高,至24 h高峰后开始下降,72 h下降至低水平(图2)。免疫组化评分结果见表1。

图1 大鼠脑干(中脑)镀银染色
Fig.1 Golgi silver-stained sections in the mesencephalon (×400)
A:对照组;B:DAI组。
表1 脑干神经细胞IP3R1免疫组化评分结果
Tab.1 The quantitative results of brainstem IP3R1 immunohistochemistry staining
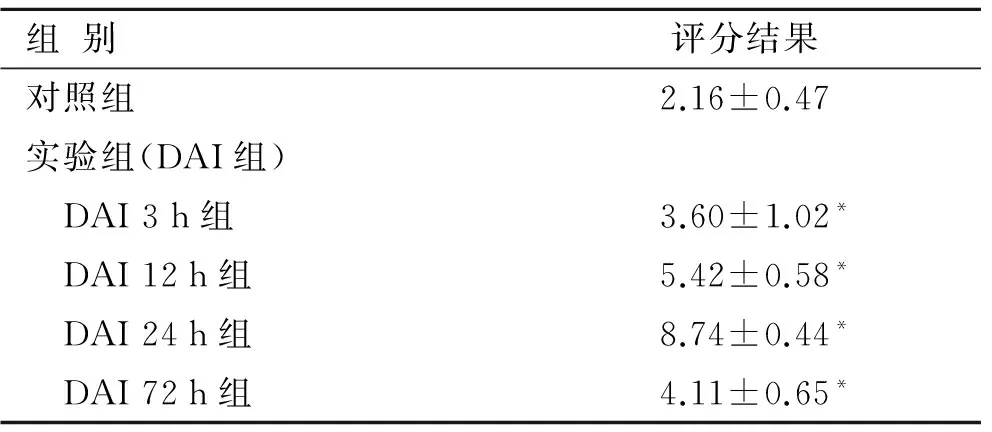
组别评分结果对照组2.16±0.47实验组(DAI组) DAI3h组3.60±1.02* DAI12h组5.42±0.58* DAI24h组8.74±0.44* DAI72h组4.11±0.65*
与对照组比较,*P<0.05。
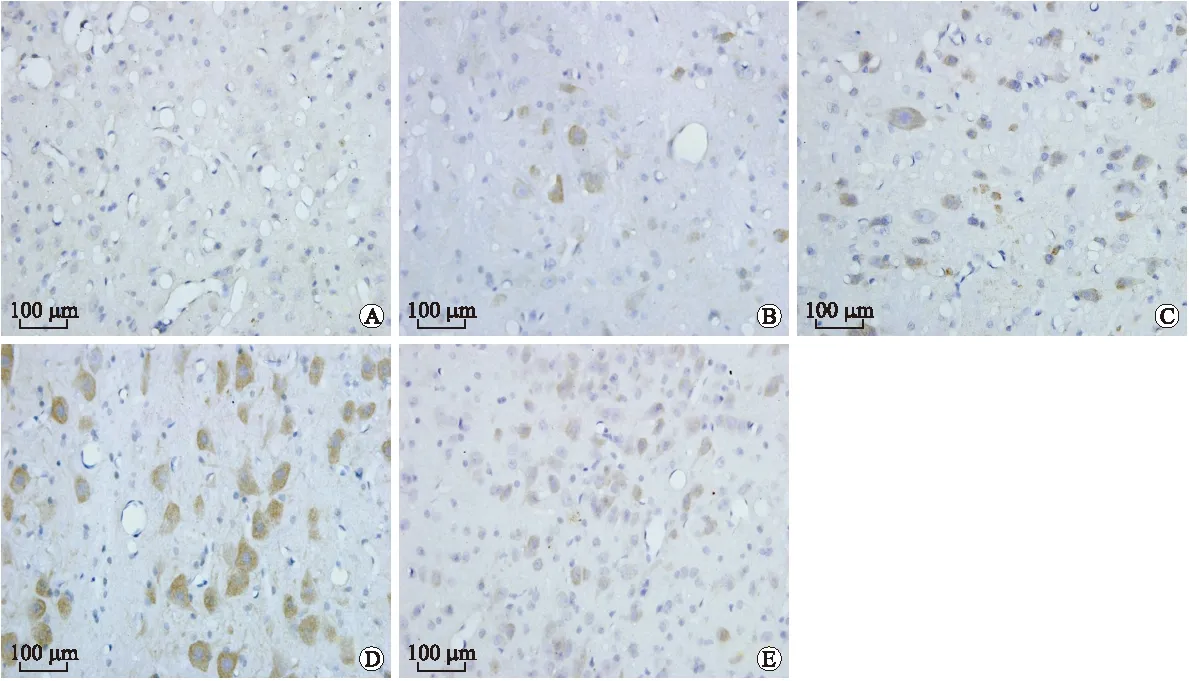
图2 各组大鼠脑干IP3R1免疫组化染色结果
Fig.2 IP3R1 immunohistochemical staining of the brain stem
A:对照组;B~E:分别为DAI后3、12、24、72h组。
3 讨 论
众所周知,ER是神经元钙库的一种主要成分,参与调控了细胞内的钙离子动态平衡。近来越来越多的研究表明ER钙释放参与脑外伤、脑缺血等疾病的病理生理过程[6]。神经元细胞ER含有IP3敏感和非IP3敏感钙库成分,分别受IP3受体(IP3R)系统及Ryanodine受体(RyR)系统调控[2]。IP3敏感钙库是一种四聚体的通道蛋白。每个通道由相对分子质量为307 ku的4个亚单位组成,根据编码基因的不同可分为Ⅰ~Ⅲ型IP3R,全部在脑组织有表达,并被PLC的代谢产物IP3激活,从而释放ER内的钙离子至细胞质中[7],但在Ⅰ~Ⅲ型IP3R中,IP3R1被认为是神经元ER钙释放激活的主要受体[8]。长期以来,对于DAI后神经元钙超载的机制研究为:钠离子通道功能障碍引发的钙离子内流;机械牵拉轴膜通透性改变引发的钙离子内流;谷氨酸的聚集导致的钙离子内流;线粒体功能障碍等,这些研究充分揭示了神经元细胞外钙离子内流是形成DAI后神经元钙超载的原因。
近年来,逐渐有学者已证实ER这一细胞内重要钙库对DAI后钙超载形成的作用,DAI后由于机械外力对轴膜的牵拉,导致神经元电压门控钠通道(voltage-gated sodium channels, NaCh)功能异常,导致持续的钠离子内流入细胞[9]。在这种持续的NaChs的非失活状态下,病态的钠离子内流导致持续的细胞去极化状态,从而开放了电压门控钙离子通道(voltage-gated Ca2+channels, VGCC)[10],并且使Na+/Ca2+交换体(Na+/Ca2+exchangers, NCX)功能发生反转[8],这些导致了钙离子由细胞外向细胞内聚集。此后,神经元内钙离子浓度升高,升高的钙离子浓度可以激活神经元内IP3的大量产生,从而活化位于ER上的IP3R1从而导致ER内钙离子释放至胞质,从而加剧DAI后钙超载的形成。本实验结果显示,DAI后IP3R1同样有着动态的表达上调趋势,这提示IP3R1结合IP3配体的能力在DAI后增强,一方面来源于IP3的大量产生,同时另一方面也来源于IP3R1的表达上调。大鼠DAI后脑干区域在损伤3 h后可见IP3R1少量表达,随后IP3R1随着时间的延长,逐步增多,在损伤48 h出现高峰,随后减少,这与IONESCU[7]用体外模型研究DAI,发现神经元内钙离子浓度在损伤后48 h内是明显升高的,48 h后逐渐减低至正常,这与DAI后IP3的表达在时间上有密切的相关性。因此,推测IP3可能在大鼠DAI后通过其表达的变化导致细胞ER中IP3R1敏感钙库释放钙离子,促进钙超载的发生,从而进一步加重DAI后轴索的继发性损伤及断裂。这为进一步了解轴索损伤后轴索的继发性损伤及断裂提供研究基础。
[1] 宋锦宁,刘守勋,戈治理,等. 脑弥漫性轴索损伤的特点及临床诊断[J]. 中国神经精神疾病杂志, 1997, 23(3): 141-144.
[2] PEREIRA GJ, HIRATA H, FIMIA GM, et al. Nicotinic acid adenine dinucleotide phosphate (NAADP) regulates autophagy in cultured astrocytes[J]. J Biol Chem, 2011, 286(32):27875-27881.
[3] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008, 29(5):595-598.
[4] SONG J, LIU X, CHEN J, et al. Dynamic changes in cerebral microcirculation and hypoxia in the early stages of diffuse axonal injury[J]. Neural Regeneration Res, 2011, 6(20):1530-1536.
[5] KRAWCZYK-RUSIECKA K, LEWINSKI A. Cyclooxygenase-2 expression and its association with thyroid lesions[J]. Arch Med Sci, 2010, 6(5):653-657.
[6] RUIZ A, MATUTE C, ALBERDI E. Endoplasmic reticulum Ca2+release through ryanodine and IP3 receptors contributes to neuronal excitotoxicity[J]. Cell Calcium, 2009, 46(4): 273-281.
[7] IONESCU L, WHITE C, CHEUNG KH, et al. Mode switching is the major mechanism of ligand regulation of InsP3 receptor calcium releasechannels[J]. Gen Physiol, 2007, 130(6):631-645.
[8] LINGOR P, KOCH JC, TÖNGES L, et al. Axonal degeneration as a therapeutic target in the CNS[J]. Cell Tissue Res, 2012, 349(1):289-311.
[9] THEILE JW, JARECKI BW, PIEKARZ AD, et al. Nav1.7 mutations associated with paroxysmal extreme pain disorder, but not erythromelalgia, enhance Navβ4 peptide-mediated resurgent sodium currents[J]. J Physiol, 2011, 589:597-608.
[10] NEHRT A, RODGERS R, SHAPIRO S, et al. The critical role of voltage-dependent calcium channel in axonal repair following mechanical trauma[J]. Neuroscience, 2007, 146(4):1504-1512.
(编辑 国 荣)
Dynamic high expression of inositol 1,4,5-trisphosphate receptor type Ⅰ and its potential role in the early stage after diffuse axonal injury
JIN Tao1,2, SONG Jin-ning1, LI Yu1, MA Xu-dong1, GUO Xiao-ye1, LIU Xiao-bin1
(1. Department of Neurosurgery, the First Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061; 2. Department of Neurosurgery, Ankang City Central Hospital, Ankang 725000, China)
Objective To detect the dynamic expression level of inositol 1, 4, 5-trisphosphate receptor type I (IP3R1) in rat brain stem after diffuse axonal injury (DAI) by immunohistochemistry so as to explore its potential contribution to the secondary injury after DAI. Methods Twenty-five male adult Sprague-Dawley rats were divided into the injury group (n=25) and the control group (n=5). Before immunohistochemistry detection, Golgi silver staining was performed to ensure all rats in DAI group met the criteria of DAI. Then the level of IP3R1 expression was detected by immunohistochemistry at 3 h, 12 h, 24 h and 72 h after DAI, respectively. Results In the DAI group, a subset of axons exhibited bead-like structure, axonal retraction balls and swollen axons, and axonal axotomy was observed with Golgi silver staining. Immunohistochemical results showed mild expression of IP3R1 in the rat brain stem in the control group. After DAI the level of IP3R1 expression increased significantly. It began to increase at 3 h after injury (PI), peaked at 24 h PI, and then gradually decreased. At 72 h PI, the expression in DAI group did not significantly differ from that in the control group. Conclusion Enhanced expression of IP3R1 may participate in the calcium overload and neuronal secondary injury in the early stage after DAI.
diffuse axonal injury; inositol 1,4,5-trisphosphate receptor type I (IP3R1); endoplasmic reticulum; calcium overload; traumatic brain injury
2014-04-21
2014-07-16
收稿日期:国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No.NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁. E-mail: jinnings@126.com
R651.1+5
A
10.7652/jdyxb201501015
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0848.003.html(2014-11-19)
