2型糖尿病合并结直肠癌患者肿瘤治疗前后体质量变化对血糖的影响
2015-02-23滕家安杨瑞平陈露文杨冬莲黄迪迪王克敏
滕家安,秦 俭,杨瑞平,陈露文,杨冬莲,黄迪迪,王克敏
·论著·
2型糖尿病合并结直肠癌患者肿瘤治疗前后体质量变化对血糖的影响
滕家安,秦 俭,杨瑞平,陈露文,杨冬莲,黄迪迪,王克敏
目的 探讨2型糖尿病合并结直肠癌患者肿瘤治疗前后体质量变化对血糖的影响。方法 选取2013年4月—2014年10月在广西壮族自治区人民医院住院的2型糖尿病合并结直肠癌患者122例,根据患者血糖情况调整降糖治疗方案,治疗用药均为胰岛素,在血糖达标后,根据患者肿瘤的病理、部位、分期及高危情况等选择不同的治疗方式:手术、放疗和化疗。肿瘤治疗结束4周后,根据血糖情况调整糖尿病治疗方案,使血糖控制达标。比较肿瘤治疗前后患者体质量、体质指数(BMI)、胰岛素用量;对体质量变化和胰岛素用量变化进行相关分析。结果 肿瘤治疗前后,患者空腹血糖和餐后2 h血糖均达标,治疗前后患者空腹血糖、餐后2 h血糖比较,差异均无统计学意义(t=1.370、1.153,P>0.05)。肿瘤治疗后94.3%(115/122)的患者体质量下降;治疗前,患者体质量为(66.5±8.7)kg,BMI为(25.4±2.4)kg/m2;治疗后,患者体质量为(60.6±7.4)kg,BMI为(23.2±2.1)kg/m2。治疗后患者体质量、BMI均低于治疗前(t=5.738、6.580,P<0.01)。肿瘤治疗后95.1%(116/122)的患者胰岛素用量减少;治疗前,患者胰岛素用量为(24.7±8.0)U,治疗后胰岛素用量为(14.1±9.1)U,治疗后胰岛素用量低于治疗前(t=9.626,P<0.01)。Pearson直线相关分析结果显示,随着患者体质量减少幅度增大,胰岛素用量减少幅度也增加,两者呈正相关关系(r=0.921,P<0.01)。结论 2型糖尿病合并结直肠癌患者经过肿瘤治疗后体质量减轻对血糖有明显影响,因此在治疗期间需定期监测血糖,及时调整降糖治疗方案,避免低血糖发生。
结直肠肿瘤;糖尿病,2型;人体质量指数;胰岛素
滕家安,秦俭,杨瑞平,等.2型糖尿病合并结直肠癌患者肿瘤治疗前后体质量变化对血糖的影响[J].中国全科医学,2015,18(26):3162-3165.[www.chinagp.net]
Teng JA,Qin J,Yang RP,et al.Effect of weight changes after oncotherapy on blood glucose of patients with type 2 diabetes mellitus and colorectal cancer[J].Chinese General Practice,2015,18(26):3162-3165.
研究发现2型糖尿病与结直肠癌的发生、发展及预后密切相关[1],糖尿病患者发生结直肠癌的风险约增加30%。与未合并糖尿病的结直肠癌患者相比,糖尿病合并结直肠癌患者的肿瘤相关病死率增加12%,全因病死率增加17%[2]。本课题组前期研究也有类似发现[3]。而良好的血糖控制则可减少糖尿病合并结直肠癌患者的病死率[4]。因此如何有效管理该人群的血糖、降低患者病死率成为重要的目标。本研究拟通过探讨2型糖尿病合并结直肠癌患者体质量变化对血糖的影响,为该人群2型糖尿病的控制提供临床依据。
1 对象与方法
1.1 研究对象 选取2013年4月—2014年10月在广西壮族自治区人民医院住院的2型糖尿病合并结直肠癌患者122例,其中男64例,女58例;年龄49~78岁,平均年龄(68.2±6.6)岁;临床分期:Ⅰ期15例,Ⅱ期58例,Ⅲ期42例,Ⅳ期7例;按照2007 UICC TNM分期,其中T1 3例,T2 17例,T3 42例,T4 60例。合并高血压的患者同时使用降压药,并使血压控制在良好范围。排除其他类型的糖尿病如1型糖尿病,合并糖尿病严重慢性并发症如糖尿病肾病(Ⅳ、Ⅴ期)、糖尿病视网膜病变增殖期、糖尿病胃肠道病变不能进食者,合并严重心功能不全Ⅱ级以上、脑血管疾病后遗症及急性冠脉综合征者,严重肿瘤恶病质无法耐受肿瘤治疗者。
1.2 诊断标准 2型糖尿病诊断标准依据1997年世界卫生组织(WHO)标准:糖尿病症状+任意时间血浆葡萄糖≥11.1 mmol/L或者空腹血浆葡萄糖≥7.0 mmol/L或者口服葡萄糖耐量试验(OGTT)2 h血糖≥11.1 mmol/L。结直肠癌诊断标准:患者均经病理检查证实并行根治性手术。
1.3 糖尿病治疗 根据血糖情况调整降糖治疗方案,治疗用药均为胰岛素,使用的胰岛素种类包括长效胰岛素、超短效胰岛素、预混胰岛素等,24 h内使用的胰岛素总和为每日胰岛素总量。糖尿病达标标准:按照《中国糖尿病2型糖尿病防治指南》2010版控制目标:空腹血糖为3.9~7.2 mmol/L,非空腹血糖≤10.0 mmol/L,糖化血红蛋白<7.0%。
1.4 肿瘤治疗 根据患者肿瘤的病理、部位、分期及高危情况等选择手术、放疗或化疗。
1.4.1 治疗模式 Ⅰ期患者选择单纯手术,术后密切随访。Ⅱ期及以上患者需手术、放疗、化疗的综合治疗模式。序贯模式有:(1)手术→放疗→辅助化疗;(2)新辅助化疗→手术→放疗→辅助化疗;(3)手术→辅助化疗→放疗→辅助化疗;(4)术前放疗→手术→辅助化疗;(5)手术→辅助化疗;(6)新辅助化疗→手术→辅助化疗。
1.4.2 手术 手术方式包括经腹或腔镜下结/直肠癌根治术±结肠造瘘术。
1.4.3 放疗 放疗包括术前放疗和术后放疗。直肠癌放疗靶区涵盖手术瘤床区域和盆腔淋巴引流区,除T3、T4患者外无需对髂外淋巴引流区进行预防照射。术前放疗,剂量45~50 Gy/25~28 Fx。术后放疗根据患者术后局部和区域是否残留,以及局部复发风险的高低给予放疗,剂量45~66 Gy/25~33 Fx。结肠癌患者以手术和化疗为主,如手术切缘阳性、切缘不确定或安全边界不够的情况下需行术后局部放疗,放疗靶区为术前影像学确定的瘤床区域和/或手术放置银夹的位置,剂量45~50 Gy/25~28 Fx。放疗技术均采用三维适形或调强放疗技术。
1.4.4 化疗 按照NCCN指南,根据患者病情给予化疗,化疗有同步放化疗、术前新辅助化疗和术后辅助化疗等,方案多选择mFolfox6、Folfox6、Folfox4、CapeOXA等,21~28 d/周期,共4~6周期,同步放化疗选择卡培他滨或替吉奥。
1.5 体质量测定及血样采集 受试者测量身高,血糖控制达标后晨起测定体质量并采集空腹及餐后2 h静脉血,采血量为2 ml,以氟化钠-草酸钾抗凝剂抗凝,静置后置于离心机以3 000 r/min离心10 min,离心半径为10 cm。采用移吸管吸出分离的上清液,0.5 h内采用葡萄糖氧化酶法测血糖。肿瘤治疗结束4周后以同样方法再次测定体质量及采集血样,测定空腹及餐后2 h血糖。
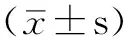
2 结果
2.1 肿瘤治疗前后血糖水平 治疗前,患者空腹血糖为(6.8±0.9)mmol/L,餐后2 h血糖为(8.5±1.0)mmol/L;治疗后,患者空腹血糖为(6.6±1.0)mmol/L,餐后2 h血糖为(8.4±0.9)mmol/L。治疗前后患者空腹血糖、餐后2 h血糖比较,差异均无统计学意义(t=1.370、1.153,P>0.05)。
2.2 肿瘤治疗前后体质量 肿瘤治疗后患者体质量基本分布于各自治疗前散点下方,其中94.3%(115/122)的患者肿瘤治疗后体质量下降,4.1%(5/122)的患者体质量无变化,1.6%(2/122)的患者体质量略有增加(见图1)。肿瘤治疗前,患者体质量为(66.5±8.7)kg,BMI为(25.4±2.4)kg/m2;治疗后,患者体质量为(60.6±7.4)kg,BMI为(23.2±2.1)kg/m2。治疗后患者体质量、BMI均低于治疗前,差异有统计学意义(t=5.738、6.580,P<0.01)。体质量下降幅度为(5.9±3.5)kg。
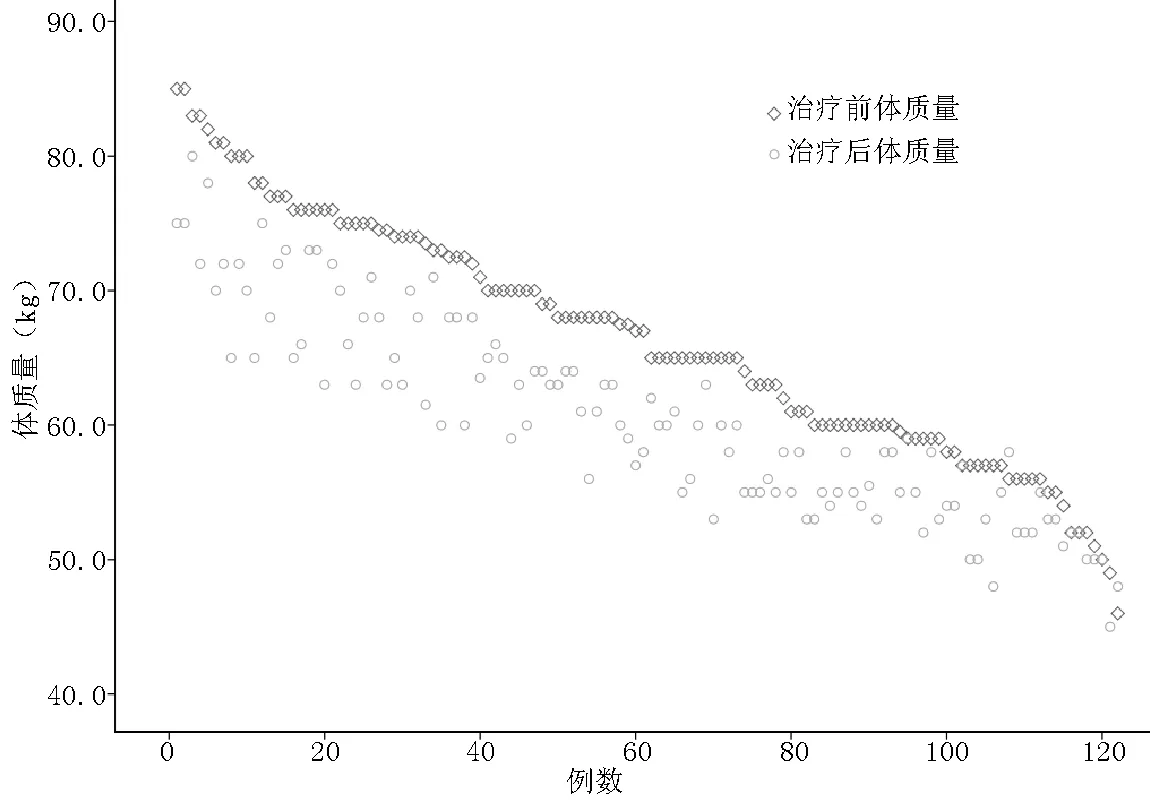
图1 肿瘤治疗前后患者体质量变化散点图
2.3 肿瘤治疗前后胰岛素用量 肿瘤治疗后患者每天胰岛素用量基本分布于各自治疗前散点下方,其中95.1%(116/122)的患者肿瘤治疗后胰岛素用量减少,1.6%(2/122)的患者胰岛素用量无变化,3.3%(4/122)的患者胰岛素用量增加(见图2)。肿瘤治疗后24例(19.7%)患者完全停用胰岛素,50例(41.0%)患者停用胰岛素后改服小剂量口服降糖药。肿瘤治疗前胰岛素用量为(24.7±8.0)U,治疗后胰岛素用量为(14.1±9.1)U,治疗后胰岛素用量低于治疗前,差异有统计学意义(t=9.626,P<0.01)。胰岛素用量减少3~26 U,减少幅度为(10.6±5.9)U。
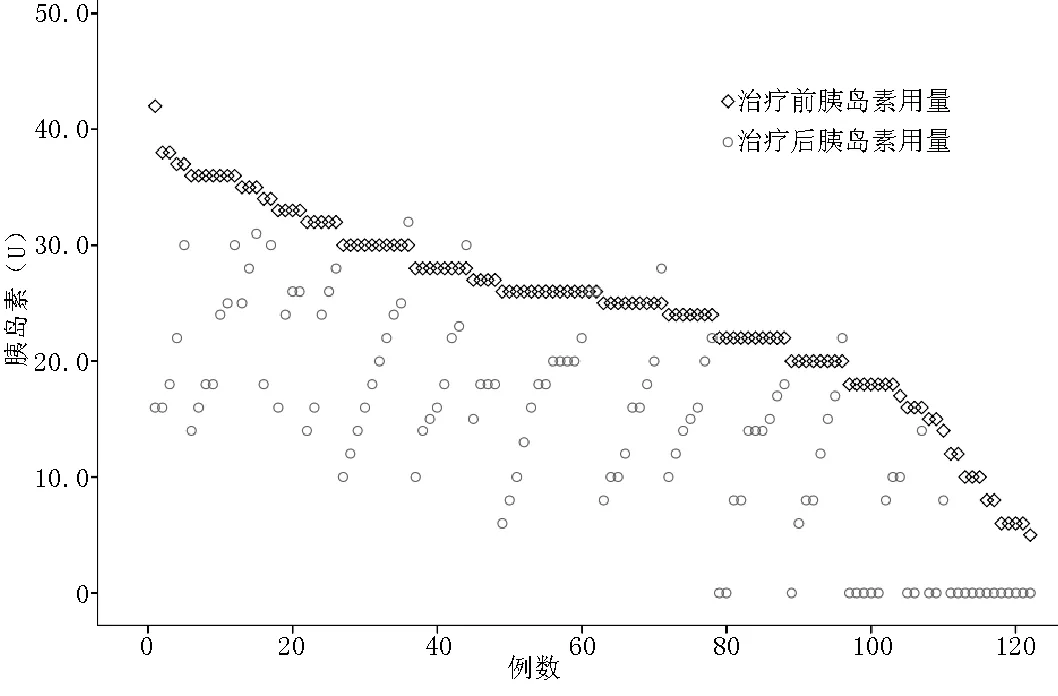
图2 肿瘤治疗前后患者胰岛素用量变化的散点图
2.4 直线相关 Pearson直线相关分析结果显示,随着患者体质量减少幅度增大,胰岛素用量减少幅度也增加,两者呈正相关关系(r=0.921,P<0.01,见图3)。
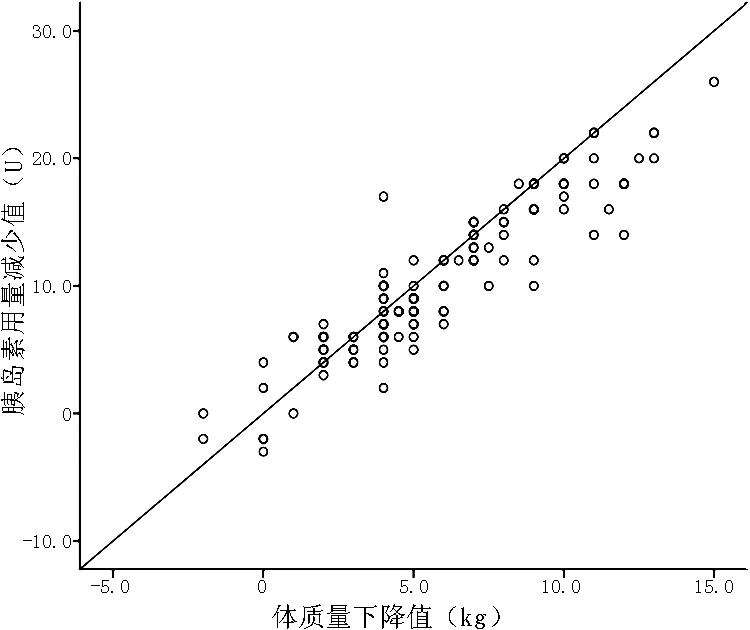
图3 体质量下降幅度和胰岛素用量下降幅度的相关性
Figure 3 Correlation between the decline of body mass and the decline of insulin dosage
3 讨论
结直肠癌是常见的消化系统恶性肿瘤之一,近年来发病率出现增高趋势。既往研究表明,其发病与遗传因素、西方化饮食、缺乏锻炼和肥胖等多种因素有关。2型糖尿病患者发生结直肠癌的风险较非糖尿病患者增加10%~50%[5-8],提示2型糖尿病可能为结直肠癌的致病因素之一。同时有研究表明,与未合并糖尿病的结直肠癌患者相比,2型糖尿病合并结直肠癌患者病死率显著升高[9]。而有效的治疗方法和良好的血糖控制则可减少合并糖尿病的结直肠癌患者病死率[4]。
然而,由于结直肠癌患者需要进行手术、化疗、放疗等特殊治疗,期间要经历禁食、流质、半流质饮食,还可能出现疼痛、腹胀、恶心、呕吐、食欲不振、感染等手术及放、化疗相关并发症,以及患者罹患肿瘤后的情绪变化、失眠等精神方面因素,均会影响患者的血糖水平。本研究在受试者围肿瘤治疗期,在内分泌科医生协助下全程使用胰岛素控制血糖,结果发现肿瘤治疗前后血糖控制均达标;肿瘤治疗后胰岛素用量减少,其中50例患者可以停用胰岛素,换用小剂量口服降糖药均可获得良好的血糖控制,24例患者完全停用胰岛素;肿瘤治疗后体质量较治疗前下降,下降幅度达(5.9±3.5)kg;对胰岛素用量减少幅度及体质量减少幅度进行相关性分析,结果发现两者呈直线相关。临床中常常可以观察到肿瘤患者体质量下降的症状,可能与肿瘤消耗、肿瘤治疗期间饮食变化、治疗并发症及患者情绪变化等导致体质量下降。
目前认为肥胖患者发生2型糖尿病的风险显著增加,体质量是糖尿病最重要的独立预测因子[10]。本组研究对象平均BMI为(25.4±2.4)kg/m2,按照中国人体质量标准处于超重状态,糖尿病发病可能与之有关。肥胖引起胰岛素抵抗和2型糖尿病的具体机制尚不十分清楚,目前认为可能与脂肪细胞产生各种细胞因子,包括肿瘤坏死因子、白介素6、抵抗素等,这些细胞因子作用于脂肪、肝脏或者肌肉,从而影响胰岛素的作用。另外,在肿瘤负荷状态下,机体会产生大量的细胞因子,如肿瘤坏死因子α、白介素6、白介素8和血管内皮生长因子等,这些细胞因子也会引起胰岛素抵抗。在胰岛素抵抗状态下,胰岛素对内源性葡萄糖产生的抑制性效应、胰岛素对外周组织葡萄糖摄取和糖原合成的刺激性效应以及胰岛素对脂肪组织分解的抑制性效应产生抵抗,胰岛素不能充分发挥其正常的生理功能,表现为糖尿病患者胰岛素用量明显增多。经过肿瘤治疗后,由于体质量下降及机体荷瘤状态的解除,体内炎性状态得到有效缓解,胰岛素抵抗状态减轻,胰岛素用量也随之减少。
因此,对于2型糖尿病合并结直肠癌患者,在进行肿瘤特殊治疗前后,应当密切监测血糖变化,并根据其体质量变化情况,及时调整糖尿病治疗方案,使血糖得到良好控制的前提下,避免低血糖的发生,以改善恶性肿瘤患者的预后。
[1]Jarvandi S,Davidson NO,Schootman M.Increased risk of colorectal cancer in type 2 diabetes is independent of diet quality[J].PLoS One,2013,8(9):e74616.
[2]Mills KT,Bellows CF,Hoffman AE,et al.Diabetes mellitus and colorectal cancer prognosis:a meta-analysis[J].Dis Colon Rectum,2013,56(11):1304-1319.
[3]Teng JA,Qin J,Liang Y,et al.Clinical research on the relationship between type 2 diabetes mellitus and colorectal cancer[J].Chinese Journal of Clinical Oncology,2010,37(3):152-155.(in Chinese) 滕家安,秦俭,梁远,等.2型糖尿病与结直肠癌关系的临床研究[J].中国肿瘤临床,2010,37(3):152-155.
[4]Bella F,Minicozzi P,Giacomin A,et al.Impact of diabetes on overall and cancer-specific mortality in colorectal cancer patients[J].J Cancer Res Clin Oncol,2013,139(8):1303-1310.
[5]Luo W,Cao Y,Liao C,et al.Diabetes mellitus and the incidence and mortality of colorectal cancer: a meta-analysis of 24 cohort studies[J].Colorectal Dis,2012,14(11):1307-1312.
[6]De Bruijn KM,Arends LR,Hansen BE,et al.Systematic review and meta-analysis of the association between diabetes mellitus and incidence and mortality in breast and colorectal cancer[J].Br J Surg,2013,100(11):1421-1429.
[7]Wu L,Yu C,Jiang H,et al.Diabetes mellitus and the occurrence of colorectal cancer:an updated meta-analysis of cohort studies[J].Diabetes Technol Ther,2013,15(5):419-427.
[8]Sun L,Yu S.Diabetes mellitus is an independent risk factor for colorectal cancer[J].Dig Dis Sci,2012,57(6):1586-1597.
[9]Waheed S,Azad N,Waheed S,et al.Racial disparities and colorectal cancer survival in older adults with and without diabetes mellitus[J].J Gastroenterol Hepatol,2014,29(12):1963-1968.doi:10.1111/jgh.12637.
[10]Flegal KM,Carroll MD,Kit BK,et al.Prevalence of obesity and trends in the distribution of body mass index among US adults,1999—2010[J].JAMA,2012,307(5):491-497.
(本文编辑:贾萌萌)
Effect of Weight Changes After Oncotherapy on Blood Glucose of Patients With Type 2 Diabetes Mellitus and Colorectal Cancer
TENGJia-an,QINJian,YANGRui-ping,etal.
DepartmentofCadreMedicine,DivisionofEndocrinologyandMetabolism,People′sHospitalofGuangxiZhuangAutonomousRegion,Nanning530021,China
Objective To investigate the effect of weight changes after oncotherapy on blood glucose of patients with type 2 diabetes mellitus and colorectal cancer.Methods We enrolled 122 patients with type 2 diabetes mellitus and colorectal cancer who were admitted into People′s Hospital of Guangxi Zhuang Autonomous Region from April 2013 to October 2014.The hypoglycemic therapy was adjusted according to the blood glucose of patients.All the patients were administrated with insulins.After blood glucose reaching standard,different oncotherapy methods,including operation,radiotherapy and chemotherapy,were undertaken for different patients according to the pathology,position,staging and critical condition of their tumors.Four weeks after oncotherapy,diabetes treatment method was adjusted according to blood glucose,in order to make blood glucose reach standard.Comparison was made between the body mass,BMI and insulin dosage before oncotherapy and those after oncotherapy,and correlation analysis was made between weight changes and insulin dosage changes.Results Before and after oncotherapy,fasting glucose and 2 hPBG all reached standard,and there was no difference between the fasting glucose and 2 hPBG before oncotherapy and those after oncotherapy(t=1.370,1.153;P>0.05).After oncotherapy,94.3%(115/122)of the patients saw decrease in body weight;before oncotherapy,the average body weight was(66.5±8.7)kg and the average BMI was(25.4±2.4)kg/m2;after oncotherapy,the average body weight was(60.6±7.4)kg and the average BMI was(23.2±2.1)kg/m2.After oncotherapy,the patients had lower body weight and BMI than those before oncotherapy(t=5.738,6.580;P<0.01).After oncotherapy,95.1%(116/122)of the patients reduced insulin dosage;the insulin dosage was (24.7±8.0)U before oncotherapy,higher(t=9.626,P<0.01)than that after oncotherapy which was(14.1±9.1)U.Pearson linear correlation analysis showed that decreasing extent of body weight was positively associated with decreasing extent of insulin dosage(r=0.921,P<0.01).Conclusion The loss of weight after oncotherapy brings enormous influence on the blood glucose of patients with type 2 diabetes mellitus and colorectal cancer.Therefore,during oncotherapy,blood glucose should be monitored regularly and the hypoglycemic therapy should be adjusted accordingly to avoid hypoglycemia.
Colorectal neoplasms;Diabetes mellitus,type 2;Body mass index;Insulin
国家自然科学基金资助项目(81160107);广西科学研究与技术开发项目资助(桂科攻1140003B-69);广西自然科学基金青年基金资助项目(2010GXNSFB013083、2012GXNSFBA053105)
530021广西南宁市,广西壮族自治区人民医院内分泌代谢干部病房(滕家安,杨瑞平,陈露文,杨冬莲,黄迪迪),临床肿瘤中心放疗病区(秦俭,王克敏)
R 735.34
A
10.3969/j.issn.1007-9572.2015.26.009
2015-03-30;
2015-07-11)
